豌豆肽缓解胰岛素抵抗形成效果探究
2019-08-26崔欣悦张瑞雪谷瑞增
崔欣悦,张瑞雪,周 明,朱 艳,陈 亮,马 勇,谷瑞增,魏 颖
(中国食品发酵工业研究院有限公司,北京市蛋白功能肽工程技术研究中心,北京 100015)
糖尿病是以持续高血糖为基本生化特征的一种机制复杂的疾病[1]。当胰岛素供应不足或胰岛素在靶细胞内不能发挥正常生理作用,致使体内糖、蛋白质及脂肪代谢发生紊乱时,继而发生糖尿病。随着糖尿病病程的延长,机体内的代谢紊乱可造成眼、肾、神经、血管和心脏组织、器官的慢性并发症,以致最终发生失明、下肢坏疽、尿毒症、脑中风或心肌梗死,甚至危及生命[2-3]。糖尿病已严重威胁人类健康,其中II型糖尿病是最常见的糖尿病,其患病比例约占世界范围内占糖尿病总数的 90%以上[4]。当胰岛素与胰岛素受体(InsR)在结合过程发生信号传导障碍时,会影响胰岛素的正常生理调节过程,发生胰岛素抵抗,同时还会影响正常的细胞凋亡。胰岛素抵抗对各种器官和组织产生不良影响[5-6],导致II型糖尿病的发生。
豌豆又称寒豆、麦豆、雪豆等,是世界性第二大食用豆类。豌豆中含有丰富的蛋白质、淀粉、矿物质和多种人体必需氨基酸[7]。豌豆肽是豌豆蛋白经过酶解技术手段获得的产物,具有较好的保水性、吸油性、乳化性和凝胶成型性,还可做为肠道营养剂促进肠道益生菌生长[8]。目前,关于豌豆水解蛋白的活性研究有一些相关报道,主要集中于豌豆蛋白的抗氧化活性[9],而对豌豆蛋白水解物对胰岛素抵抗形成效果作用鲜见报道。本研究通过高浓度胰岛素诱发HepG2细胞建立胰岛素抵抗模型,观察胰岛素抵抗对葡萄糖消耗量的影响。同时,以豌豆肽为实验对象通过观察胰岛素受体及凋亡蛋白含量的变化,探究不同浓度豌豆肽对胰岛素抵抗形成过程中的影响,旨在为豌豆肽在糖尿病疾病上的开发和利用提供有效依据。
1 实验材料与方法
1.1 材料与仪器
豌豆肽 中食海氏生物技术有限公司;人肝癌细胞(HepG2) 中国医学科学院肿瘤医院;DMEM低糖培养基 海克隆公司;BCA蛋白浓度测定试剂盒、胰酶、双抗 碧云天生物技术研究所;胎牛血清 杭州天杭生物科技有限公司;葡萄糖测定试剂盒 南京建成生物科技有限公司;PBS、胰岛素溶液 北京索莱宝科技有限公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT) Amresco公司;InsR单抗、FITC标记的单抗鼠IgG 上海拜力生物技术有限公司;DEVD-FMK ATT公司;盐酸二甲双胍肠溶胶囊 北京圣永制药有限公司。
CKX-4倒置相差显微镜 日本奥里巴斯有限公司;240i二氧化碳培养箱 美国Thermo公司;C6流式细胞仪 美国BD公司;AC2-6S1生物安全柜 新加坡ESCO公司。
1.2 实验方法
1.2.1 HepG2细胞培养与传代 利用含10%小牛血清,1%青霉素、链霉素的DMEM低糖培养液,37 ℃ 5% CO2饱和湿度下对细胞进行培养,0.25%胰蛋白酶进行消化、传代,取对数生长期的细胞进行实验。
1.2.2 HepG2细胞胰岛素抵抗模型的建立 利用DMEM低糖完全培养基调整细胞密度至1×105个/mL,接种于96孔板中,并设置空白组、胰岛素诱导实验组,每组6个重复。置于37 ℃培养箱培养24 h,待单层贴壁后加入三种不同浓度的胰岛素培养液(1×10-5、1×10-6、1×10-7mol/L)对HepG2细胞进行诱导,时间分别控制在24、36和48 h,通过葡萄糖氢化酶过氧化氢酶法(GOP-POD)测定不同浓度胰岛素诱导前后HepG2/IR细胞的葡萄糖含量及消耗量变化并测定蛋白浓度排除其影响,实验结果以mmol/mg蛋白表示,选择最适浓度进及诱导时间行后续试验。
1.2.3 豌豆肽对胰岛素抵抗葡萄糖消耗的影响 利用DMEM低糖完全培养基培养正常的HepG2细胞,调整细胞密度至1×105个/mL,37 ℃培养箱培养24 h,待单层贴壁后利用浓度为1×10-6mol/L的胰岛素对细胞进行诱导24 h,随后加入不同浓度豌豆肽溶液(20.0、10.0、5.0、1.0、0.8、0.5 mg/mL),并设置HepG2空白组、HepG2/IR模型组及不同浓度二甲双胍组阳性对照(10.0、0.8 mg/mL),继续培养24 h。利用葡萄糖氢化酶过氧化氢酶法(GOP-POD)测定不同浓度胰岛素诱导前后HepG2/IR细胞的葡萄糖含量及消耗量变化并测定蛋白浓度排除其影响。
1.2.4 豌豆肽对发生胰岛素抵抗HepG2细胞增殖的影响 待细胞贴壁后,按1.2.2确定的1×10-6mol/L胰岛素溶液诱导HepG2/IR细胞模型方法,在96孔板诱导24 h后,随加入不同浓度的豌豆肽溶液(20.0、10.0、5.0、1.0、0.8、0.5 mg/mL),每个浓度5个复孔,并设定二甲双胍对照组(10.0、0.8 mg/mL)和HepG2空白对照组。37 ℃培养继续24 h后,弃上清,每孔加入5 mg/mL的MTT 100 μL,培养箱孵育4 h,随后弃去上清,每孔加入100 μL DMSO震荡,在570 nm下进行检测各组吸光值,计算细胞增殖率。
增殖率(%)=(OD实验组/OD空白组)×100
式中:OD实验组及OD空白组分为别实验组和空白对照组的吸光值。
1.2.5 FCM检测凋亡促进蛋白Caspase-3表达 利用DMEM低糖完全培养基调整细胞密度为2.0×105个/mL接于24孔板中,每孔500 μL,培养24 h待细胞单层贴壁后,移去培养基,PBS清洗一遍,随后加入1×10-6mol/L的胰岛素对细胞进行诱导24 h,加入不同浓度的豌豆肽溶液(20.0、10.0、5.0、1.0、0.8、0.5 mg/mL),并设定二甲双胍阳性对照组(10.0、0.8 mg/mL),继续培养24 h。利用0.25%胰蛋白酶对细胞进行消化,之后用DMEM低糖完全培养基停止消化收集细胞,加入FITC标记的Caspase-3特异性抑制物DEVD-FMK 2 μL,在37 ℃培养箱中孵育30 min,随后离心去除上清液,PBS重悬细胞,采用流式细胞仪对细胞中的Caspase3阳性表达率进行测定[10]。
1.2.6 FCM检测HepG2/IR细胞中InsR蛋白的表达水平 分别对胰岛素诱导后的细胞加入不同浓度的豌豆肽溶液(20.0、10.0、5.0、1.0、0.8、0.5 mg/mL),并设定二甲双胍阳性对照组(10.0、0.8 mg/mL),培养和收集细胞方法如上述1.2.4。随后每孔加入InsR单抗1 μL,1000 r/min离心2 min,用PBS洗涤,随后加入FITC标记的IgG抗体0.5 μL,利用流式细胞仪对其中InsR蛋白的平均荧光强度(MFI)进行检测[11]。
1.3 数据处理
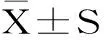
2 实验结果
2.1 HepG2细胞胰岛素抵抗模型的建立
如图1所示,随着诱导时间的不断增加,葡萄糖消耗量呈不断减少趋势。诱导24 h时,细胞生长状态良好,但对于葡萄糖消耗量实验组与空白组相比无明显差异(p>0.05)。36 h时各组细胞对葡萄糖的摄取量显著降低,但胰岛素诱导组同空白组相比不明显(p>0.05)。在细胞诱导48 h时,葡萄糖摄取量减少趋势稳定,1×10-6mol/L摄取量最小(p<0.05),达9.8%。因此采用1×10-6mol/L胰岛素溶液诱导48 h可建立稳定的HepG2细胞胰岛素抵抗模型。

图1 胰岛素抵抗对HepG2细胞葡萄糖消耗量的影响Fig.1 The effect of insulin resistance on glucose consumption in HepG2 cell注:*代表相同诱导时间下,实验组与HepG2空白组相比差异显著,p<0.05,n=6。
2.2 豌豆肽对胰岛素抵抗葡萄糖消耗的影响
择最佳胰岛素抵抗模型诱导时间48 h进行诱导,葡萄糖消耗量如图2,模型组中葡萄糖消耗量极显著降低(p<0.01),表明成功建立HepG2/IR模型。加入各浓度豌豆肽样品后的细胞葡萄糖消耗量较模型组提高44%~48%,说明豌豆肽溶液可显著促进HepG2/IR细胞葡萄糖的利用,增加糖原的合成。有研究表明,当肝脏发生胰岛素抵抗后,胰岛素抑制内源性葡萄糖生成的能力减弱同时肝糖原合成减少,导致肝脏葡萄糖的产生增加[12]。
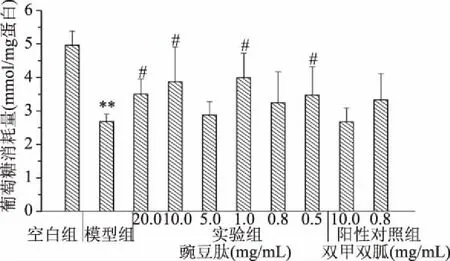
图2 豌豆肽对胰岛素抵抗细胞葡萄糖消耗影响Fig.2 The effect of pea oligopeptides on glucose consumption in HepG2/IR cells注:**代表模型组与空白组相比具有极显著差异,p<0.01; #代表实验组与模型组相比差异显著,p<0.05,n=6。
2.3 豌豆肽对发生胰岛素抵抗HepG2细胞增殖的影响
如图3所示,MTT法反映了活细胞数量的变化,在1×10-6mol/L的胰岛素浓度诱导下,模型组对正常生长的细胞有增殖促进作用,与空白组相比作用显著(p<0.05)。豌豆肽实验组除0.8 mg/mL浓度外,其余(1.0 mg/mL豌豆肽除外)与模型组相比均对细胞增殖有促进作用,具有极显著性。相反,二甲双胍组对细胞生长具有抑制效果。
图3 豌豆肽对胰岛素诱导的肝癌细胞增殖影响Fig.3 Impact of oligopeptides from pea on the proliferation of HepG2/IR cells注:*代表模型组与空白组相比具有显著差异,p<0.05; ##代表与模型组相比差异极显著,p<0.01,n=5。
2.4 FCM检测凋亡促进蛋白Caspase-3表达
胰岛素诱导后的细胞中活化Caspase-3阳性率与空白组相比极显著降低(p<0.01),降低程度达50.97%(图4),说明在细胞产生胰岛素抵抗后,凋亡促进蛋白Caspase-3的表达和活性降低抑制了Caspase激活细胞凋亡途径,Caspase-3位于细胞凋亡信号传导通路的中心位置,活化后直接参与切割细胞中多种结构与功能蛋白,李林静[13]考察了肝癌细胞发生胰岛素抵抗后的促凋亡蛋白Caspase-3活性,结果与本文一致。当豌豆肽进行干预作用后,阳性表达率的提高说明豌豆肽样品促进了Caspase-3的活化,但其活化程度与阳性对照二甲双胍水平相比还存在较大差距。

图4 豌豆肽对胰岛素抵抗肝癌细胞Caspase-3活性变化Fig.4 The change of Caspase-3 activity in HepG2/IR cells with pea oligopeptides注:**代表模型组与空白组相比具有极显著差异,p<0.01;##:与模型组相比差异极显著,p<0.01,n=3;图5同。
2.5 HepG2/IR细胞中InsR蛋白的表达水平
如图5所示,发生胰岛素抵抗后细胞中InsR蛋白表达量MFI值明显降低,与未通过胰岛素诱导的空白组细胞相比,MFI由4.36×104降至2.55×104,降低41.5%(p<0.01)。在通过豌豆肽进行干预后MFI值明显提高,豌豆肽干预浓度在1 mg/mL时MFI升高最明显,达到3.45×104。实验提示,高胰岛素诱导可使HepG2细胞表面胰岛素数目明显减少,进而导致细胞中葡萄糖消耗量的下降,最终发生胰岛素抵抗[14]。

图5 豌豆肽对胰岛素抵抗肝癌细胞InsR蛋白表达量影响Fig.5 The influence of pea oligopeptides on the expression level of InsR in HepG2/IR cells
3 结论
胰岛素的生理作用调节主要是通过与各组织细胞上的胰岛素受体结合后进行的,其过程中的信号传导出现任何一个环节缺陷时,均可影响胰岛素正常生理调节过程从而引起胰岛素抵抗的发生[15]。HepG2细胞具有正常肝细胞的生理特性并具有高表达亲和力的InsR[16]。当InsR的数目与亲和力降低时,胰岛素生理功能无法正常发挥,导致胰岛素抵抗的发生,并引起正常细胞的凋亡抑制。本研究通过不同浓度的胰岛素和诱导时间作用,建立了稳定的IR细胞模型,测定发现HepG2/IR细胞中的葡萄糖消耗量较正常HepG2细胞相比明显降低,促凋亡蛋白Caspase-3的阳性表达率降低,InsR蛋白表达下降。当在胰岛素抵抗形成过程中加以不同浓度豌豆肽溶液进行干预时,其细胞中的葡萄糖消耗量明显上升,同时提高了InsR蛋白及Caspase-3蛋白的表达,说明有效缓解了胰岛素抵抗的形成。本研究对研发具有降血糖作用的功能食品提供了理论依据,对豌豆肽的特殊肽段功能结构组成和缓解胰岛素抵抗作用机理尚需进一步深入探究。
