柠檬烯对荧光假单胞菌抑菌活性及机理研究
2019-08-26舒慧珍唐志凌陈卫军陈海明胡月英陈文学
舒慧珍,唐志凌,刘 雪,陈卫军,陈海明,胡月英,陈文学,*
(1.海南大学食品学院,海南海口 570228; 2.海南大学材料与化工学院,海南海口 570228)
食品贮藏过程中一些因素如物理、化学、酶和微生物的变化等可以导致食物腐败,能够引起食物中毒和食源性疾病,严重危害公共健康和安全。而引起食品腐败变质的最重要的原因是致腐和致病性微生物的生长,如假单胞菌属、单核增生李斯特菌、金黄色葡萄球菌、沙门氏菌和粪肠球菌等[1]。嗜冷菌是一种食品在低温贮藏条件下的关键腐败微生物,能产生耐热的、在食品加工设备和管道中以生物膜形式存在的脂肪酶或蛋白酶。在这种生存情况下,增强了嗜冷菌对加热、消毒等传统杀菌形式的耐受能力,从而导致食品的腐败变质[2]。荧光假单胞菌(Pseudomonasfluorescens)为假单胞菌属嗜冷革兰氏阴性菌,是一种广泛存在于水和土壤中的环境污染菌,能够在低温环境下生长繁殖,是引起低温条件下高蛋白和高脂肪食品腐败变质的优势菌群,也是引起败血症、感染性休克和血管内凝血等疾病的条件致病菌[3],严重威胁人类健康。
近年来,人们常常向食品中加入一些化学防腐剂来抑制或杀死病原菌从而达到延长食品货架期的目的,但是过量和长时间使用化学防腐剂会影响消费者的健康。山梨酸、苯甲酸等抑菌性较强但价格低廉的化学类食品防腐剂在食品行业得到了广泛的应用,但由于其溶解性低及安全性差等问题,其局限性也越来越明显[4]。天然防腐剂因抗菌作用强、抑菌谱广、水溶性好、增加风味等优点成为近年来的研究热点[5]。目前人们正在积极努力寻找可以替代人工合成的化学防腐剂的天然防腐剂。
柠檬烯,又称苎烯,学名为1-甲基-4-异丙基环己烯,常温下为无色油状液体,具有令人愉快的柠檬样香气[6-7],因其抑菌、增香、抗癌、平喘等功效在食品、医药、日化等行业得到广泛利用[8]。柠檬烯广泛存在于一些天然植物中,如作为海南黑、白胡椒主要香气成分——D-柠檬烯的含量为18.04%和5.5%[9]。柠檬烯具有广谱抗菌性,能够很好的抑制一些细菌及真菌的生长繁殖[10]。柠檬烯对引起肉类腐败的常见致腐菌(大肠杆菌、黑曲霉和金黄色葡萄球菌等)都有较好的抑制和杀灭效果[11]。研究发现,柠檬烯及其乳化液和丙酮溶液对金黄色葡萄球菌、单增李斯特菌和小肠结肠炎耶尔森菌3种食源性病原菌都具有较强的抑菌作用[12-13]。
柠檬烯对荧光假单胞菌具有较好的抑制作用。较多学者研究柠檬烯对一些腐败菌的抑菌活性时仅通过测定最小抑菌浓度、生长曲线等指标,简要说明了柠檬烯的抑菌效果,并未深入探究其抑菌机理。本研究通过最小抑菌浓度(MIC)和生长曲线等指标确定柠檬烯对P.fluorescens的抑菌活性,并通过扫描电镜观察、FDA染色实验、膜电位的测定、细胞内蛋白质含量、ATP 含量、琥珀酸脱氢酶活性的变化等进一步探究柠檬烯对P.fluorescens的抑菌机理,为柠檬烯作为天然抑菌剂提供理论依据。
1 材料与方法
1.1 材料与仪器
GI54DS型高压灭菌锅 致微仪器有限公司;SW-CJ-1FD型无菌超净工作台 苏州佳宝净化工程设备有限公司;SPX-288型生化培养箱 宁波江南仪器厂;SHA-2型恒温振荡器 常州澳华仪器有限公司;CR22N型落地式高速冷冻离心机、S-3000型扫描式电子显微镜 日本日立公司;TU1810型紫外可见分光光度计 北京普析通用仪器有限责任公司;Christ Alpha1型冷冻干燥机 德国Marin Christ公司;JYD-650L型超声波细胞粉碎机 上海五相仪器仪表有限公司;WGY-10型荧光分光光度计 天津港东科技发展股份有限公司;SP-Max3500FL型多功能酶标仪 上海闪谱生物科技公司。
1.2 实验方法
1.2.1 菌株活化 将荧光假单胞菌在营养琼脂培养基中传代活化并置于30 ℃ 培养18~24 h,采用麦氏比浊法[14]调整菌液浓度为106~107CFU/mL待用。
1.2.2 最小抑菌浓度(MIC)的测定 采用肉汤稀释法[15]测定最小抑菌浓度。将柠檬烯用20%乙醇溶解,二倍梯度稀释为400、200、100、50、25、12.5、6.25 mL/L抑制液备用。分别将2 mL不同浓度抑制液与18 mL营养肉汤琼脂培养基混匀,使柠檬烯终浓度分别为40、20、10、5、2.5、1.25、0.625 mL/L。以加入等量无菌水和20%乙醇为空白和阴性对照。加入200 μL用无菌生理盐水稀释至106~107CFU/mL的菌悬液涂布均匀,倒置于30 ℃恒温培养箱中培养24 h,以肉眼看不见细菌生长的最小稀释浓度为最小抑菌浓度(MIC)。
1.2.3 生长曲线的测定 通过紫外分光光度法[16]测定P.fluorescens的生长曲线。用无菌生理盐水将培养至对数生长期的P.fluorescens稀释至106~107CFU/mL,并按5%(v/v)的接种量接种至营养肉汤培养基中,加入终浓度为1×MIC、2×MIC的柠檬烯,以无菌水和20%乙醇为空白和阴性对照,放置于30 ℃,180 r/min摇床中培养,每隔1 h通过紫外分光光度计测量600 nm处吸光值,通过吸光值绘制生长曲线反映出其生长速率。
1.2.4 细胞形态的观察 采用扫描电镜法[17]观察P.fluorescens细胞外部形态的变化。在培养至12 h的菌悬液中加入终浓度为1×MIC和2×MIC的柠檬烯,以无菌水和20%乙醇为空白和阴性对照组。放置于30 ℃,180 r/min摇床中培养,分别取培养至4、8 h的菌悬液,以6000 r/min低温离心10 min收集菌体。使用无菌磷酸盐缓冲液(PBS,pH=7.2)洗涤3次,用20%、40%、60%、80%乙醇溶液梯度脱水后用无水乙醇洗脱3次。在-20 ℃预冻2 h,冷冻干燥12 h后取样镀金,在扫描电镜上放大8000倍观察细胞形态。
1.2.5 二乙酸荧光素染色实验 用二乙酸荧光素(FDA)染色实验[18]研究柠檬烯对P.fluorescens细胞膜通透性的影响。FDA是一种易通过细胞膜的无荧光的、不带电荷的脂质性分子,进入细胞后可被酶水解为荧光素,由于其极性而留存于细胞中发出黄绿色荧光,细胞膜受到破坏,则荧光素分子流失导致 FDA 荧光强度降低[21]。因此,细菌细胞膜的完整性和通透性可通过FDA荧光强度来反映。
分别将培养12 h的菌悬液以8000 r/min低温离心10 min弃上清并悬浮于生理盐水中,使菌浓度约为106~107CFU/mL。分别加入1×MIC、2×MIC浓度的柠檬烯,以无菌水和20%乙醇作为空白对照和阴性对照,置于30 ℃ 180 r/min摇床培养。分别取6、9、12 h的菌悬液4000 r/min离心10 min收集菌体,用PBS(pH=7.2)洗涤2次后离心弃上清,加入250 μL FDA-丙酮溶液(2 mg/mL)。常温下放置20 min后用PBS(pH=7.2)洗涤3次,8000 r/min低温离心10 min弃上清后重悬于PBS(pH=7.2)中,用荧光分光光度计测定平均荧光强度,激发波长为297 nm,发射波长为527 nm。
着眼于高素质创新型技能型人才的培养目标,高职语文教学目标应该包含以下几个方面:一是夯实语文基础知识和基础能力;二是提升学生审美素养,提高学生的心理和情商指数,培养学生高雅、纯正的审美情趣;三是重视语文的德育、态度、价值观的养成,促进学生健全人格的养成;在此基础上,我们提出第四种课程目标,即提升学生的创新理念、创新思维、创新实践能力,进而提高语言创新能力、思维能力、解决问题能力为目的,以有利于学生的职业发展;通过教学目标的重新定位,把创新能力培养作为高职语文教学目标的重要构成加以重视,并在具体的教学实践中加以实施。
1.2.6 膜电位的测定 膜电位的大小可反映细胞的代谢活性,为了研究柠檬烯对P.fluorescens代谢活性变化的影响,根据Zhang等[19]的罗丹明123荧光染色法并进行适当修改测定细菌的膜电位(MP)。将培养至对数期的菌悬液中(~1×107CFU/mL)中分别加入1×MIC和2×MIC浓度的柠檬烯,以无菌水和20%乙醇为空白和阴性对照,并于30 ℃,180 r/min摇床培养3 h。离心收集菌体,再用PBS洗涤2次后并溶解。将罗丹明123加入PBS中配置成1 mg/mL母液后,加入菌液中使其终浓度为2 μg/mL,在黑暗中静置30 min后,将样品洗涤3次并重悬于PBS中,用荧光分光光度计在激发波长为480 nm,发射波长为530 nm下测定平均荧光强度。
1.2.7 细胞内蛋白质含量的测定 向培养至对数生长期的菌悬液中加入终浓度为1×MIC、2×MIC柠檬烯,以无菌水和20%乙醇为空白和阴性对照,置于摇床(30 ℃,180 r/min)分别取培养0、3、6、9、12 h的菌悬液在8000 r/min条件下低温离心10 min收集菌体,用PBS(pH=7.2)洗涤3次并重悬。通过超声细胞破碎仪在冰上破碎细胞5 min,并以10000 r/min 离心10 min,弃细胞残渣,取上清保存于4 ℃。采用考马斯亮蓝法[20]用紫外-可见分光光度计于595 nm下测定吸光值,根据公式计算得出胞内蛋白含量。测得的蛋白含量的标准曲线方程为:Y=0.8299X-0.0004,R2<0.9993(X表示蛋白质质量浓度(mg/mL),Y表示吸光值)。
1.2.8 ATP含量的测定 参照Sánchez等[21]的方法并稍作修改测定细胞内ATP含量。取1.2.7超声破碎后的样液分别用ATP测定试剂盒测量胞内ATP含量。将反应后的混合物转移至96孔板中用酶标仪测定在波长为636 nm下的吸光值。
1.2.9 琥珀酸脱氢酶(SDH)活性测定 采用SDH测定试剂盒的方法,取 100 μL 1.2.7中超声破碎后的样液,冲入2.6 mL 已配制好并预温的工作液,迅速混匀并计时,将可见分光光度计波长设定为600 nm,5 s时记录吸光度值A1,65 s时记录吸光度值A2,计算2次吸光度差值ΔA=(A1-A2),并运用公式计算SDH活性:
SDH活性(U/mg)=[(ΔA值/0.01)/反应时间(min)]/[取样量(mL)×待测蛋白样本浓度(mg/mL)]
1.3 数据处理
实验数据采用DPS数据处理系统进行方差分析,使用Origin软件制图。
2 结果与分析
2.1 柠檬烯对荧光假单胞菌的最小抑菌浓度(MIC)
由表1可知,柠檬烯对荧光假单胞菌有较好的抑菌效果,且抑菌能力随着其浓度的增加而增强,当柠檬烯浓度为20 mL/L时细菌不能生长,即柠檬烯对荧光假单胞菌的最小抑菌浓度为20 mL/L,且20%乙醇溶液对荧光假单胞菌的生长没有影响。

表1 荧光假单胞菌生长情况Table 1 The growth of P. fluorescens
2.2 柠檬烯对荧光假单胞菌生长的影响
如图1所示,添加水和20%乙醇组的细菌生长呈现S型生长曲线,在2~17 h时,细菌迅速增长并在17 h时OD600分别达到2.42和2.43。20%乙醇组生长相较于空白组略为缓慢,但最终几乎同时达到稳定期,说明20%乙醇对细菌影响不大。但向菌液中加入终浓度为1×MIC和2×MIC柠檬烯时,菌液OD600均低于对照组。添加1×MIC和2×MIC柠檬烯组在0~12 h期间值处于较为平稳的状态,基本上没有变化;12~16 h OD值略有上升,之后趋于平稳状态,最大OD值仅分别达到0.43和0.51。结果表明加入终浓度为1×MIC和2×MIC的柠檬烯能够有效的抑制荧光假单胞菌的生长。

图1 柠檬烯对荧光假单胞菌生长的影响Fig.1 Effects of limonene on the growth of P. fluorescens
2.3 柠檬烯对荧光假单胞菌细胞形态的影响
扫描电镜结果如图2所示,空白组(A1、A2)的荧光假单胞菌结构形态较为完整,呈正常的短杆状,形态饱满,表面较为光滑,未出现细胞破损及内容物溢出等现象。20%乙醇组(B1、B2)的荧光假单胞菌经4 h的处理后细胞形态较为完好,没有出现明显变化,8 h处理后细胞形态受到的破坏很微小,大部分细胞仍呈正常的形态。而柠檬烯处理4 h后(C1、D1)的荧光假单胞菌的细胞菌体干瘪,表面粗糙,部分细胞黏连在一起,形态发生扭曲变形,呈狭长或断裂状,可能是细胞壁和细胞膜受到破坏;作用8 h后(C2、D2),菌体形态受到严重破坏,菌体萎陷,细胞表面粗糙不平,呈现严重破裂坍塌和孔洞,从而引起细胞原生质的外泄,而黏稠地原生质则会引起严重的细胞聚集和重叠现象。且添加2×MIC柠檬烯相较于1×MIC的菌体细胞受到的破坏更为严重,存在更多的出现坍塌和孔洞的细胞。由此可见,柠檬烯能够破坏和损伤荧光假单胞菌细胞的正常形态,导致细胞壁和细胞膜被破坏,且破坏程度随着柠檬烯浓度的增大而增大。还可能引起一些大分子物质进入细胞以及一些胞内物质溢出如细原生质的外渗[21],同时也会影响菌体细胞的正常代谢,甚至导致细胞死亡。

图2 荧光假单胞菌的扫描电镜图(8000×)Fig.2 Scanning electron microphotographs of P. fluorescens(8000×)注:A1:空白组(4 h);B1:20%乙醇组(4 h);C1:1×MIC实验组(4 h);D1:2×MIC实验组(4 h);A2:空白组(8 h);B2:20%乙醇组(8 h);C2:1×MIC实验组(8 h);D2:2×MIC实验组(8 h)。
2.4 柠檬烯对P. fluorescens细胞膜通透性的影响
FDA荧光强度低表明细胞内细胞膜完整性被破坏,引起荧光泄漏[22]。由图3可知,处理6 h后各组的荧光强度均为200 AU左右,无显著性差异(p>0.05),表明此时细胞膜结构较为完整,通透性变化较小。处理9和12 h后空白对照组(水)与阴性对照组(20%乙醇)的荧光强度变化不显著,而添加柠檬烯的荧光强度均有降低。2×MIC组的荧光强度降低更多,且12 h的实验组的荧光强度降低也更为显著(p<0.05)。说明添加柠檬烯9 h后能够破坏细胞膜结构,增强细胞膜通透性,且随着柠檬烯浓度增加,作用时间延长,破坏程度更为明显。

图3 柠檬烯对荧光假单胞菌FDA荧光强度的影响Fig.3 Effects of limonene on FDA fluorescence intensity of P. fluorescens注:相同时间不同小写字母代表差异显著,p<0.05;图4同。
2.5 柠檬烯对荧光假单胞菌膜电位的影响
膜电位指的是存在于细胞膜内外的电位差,作为质子动能势的一部分能够参与ATP的合成,是反映菌体细胞代谢和生命活力的重要指标[23]。通过罗丹明123 的平均荧光强度来表示荧光假单胞菌的膜电位大小,结果如图4所示。空白组和20%乙醇组中荧光假单胞菌的平均荧光强度分别为68.94和56.61 AU,加入1×MIC浓度的柠檬烯后,菌液中平均荧光强度下降至34.41 AU,当柠檬烯浓度达到2×MIC时,荧光假单胞菌的平均荧光强度降至仅为7.33 AU。正常情况下细菌细胞膜内外的膜电位差为100~200 mV,且膜外电压要高于膜内电压,如果细胞发生去极化现象则会引起膜电位降低,反之,细胞发生了超极化现象则会导致膜电位升高[23]。若细胞膜被破坏,由于无机离子的自由穿越,膜电位将变成零[24]。罗丹明123可通过跨膜电位进入细胞内,加入柠檬烯后细胞的膜电位遭到破坏,释放出罗丹明123,导致荧光光强度降低。结果表明加入柠檬烯降低了荧光假单胞菌的膜电位,导致细胞去极化和代谢失常。

图4 柠檬烯对荧光假单胞菌膜电位的影响Fig.4 Effect of limonene on the membrane potential(MP)of P. fluorescens
2.6 柠檬烯对荧光假单胞菌细胞内蛋白含量的影响
通过菌体内蛋白质等物质的流失可表明柠檬烯对菌体膜完整性的影响。由图5可知,在0~12 h内,20%乙醇组菌体内蛋白质的含量随着细菌的生长而增加,特别是0~6 h处于迅速增加的状态,可能是因为此时细菌还处于对数生长期,细菌快速生长。而加入1×MIC和2×MIC浓度的柠檬烯则没有引起胞内蛋白质的增加,两者蛋白质含量相差很小,说明1×MIC已经能够对菌体胞内蛋白质含量产生很大的影响。测定结果表明柠檬烯对荧光假单胞菌的细胞膜渗漏具有明显的影响,且蛋白质的渗漏现象随着柠檬烯作用时间的增加越来越明显。证明了柠檬烯通过改变菌体细胞膜的通透性,致使细菌胞内蛋白质的泄漏。
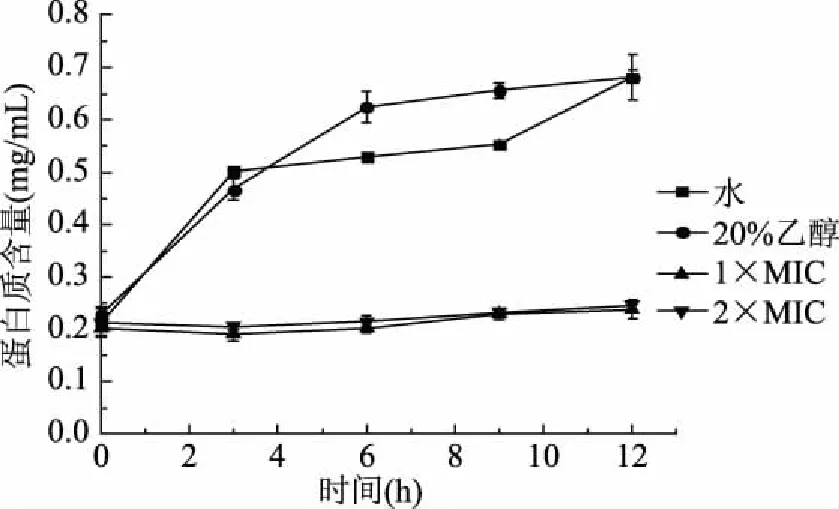
图5 柠檬烯对荧光假单胞菌细胞内蛋白质含量的影响Fig.5 Effects of limonene on intracellular protein content of P. fluorescens
2.7 柠檬烯对荧光假单胞菌细胞内ATP含量的影响
三磷酸腺苷(ATP)是体内能量代谢和转换的中心,直接为生物体的生命活动提供能量[25]。ATP含量的变化关系到各个器官的能量代谢,并对细胞的各种生理病理过程很重要,柠檬烯对荧光假单胞菌ATP含量的影响如图6所示。空白组和对照组在0~3 h时ATP含量略有增加,而实验组ATP含量总体呈明显增大趋势。3 h时,1×MIC组和2×MIC组的胞内ATP含量达到了最大值分别为10673.91 μmol/g protein和11001.02 μmol/g protein。而这可能是由于添加了柠檬烯对细胞产生了刺激,而细胞为了保持自身的正常生理功能出现应激反应,导致ATP含量的迅速上升。有研究表明,细胞处于特殊细胞形态的转化时需要高含量的ATP[26]。在3~6 h时,ATP含量总体呈下降趋势,且实验组ATP含量急剧下降;6~12 h,空白组和乙醇组的ATP含量基本没什么变化,而添加了抑菌物质的实验组ATP含量依然处于下降趋势,说明在3~12 h,柠檬烯对荧光假单胞菌ATP的合成或消耗产生了影响,导致ATP含量下降。细胞在凋亡时,为了保持细胞的质子动势平衡,ATP含量会急剧下降[27]。而且随着呼吸受到抑制,ATP的含量也会急剧下降。Sánchez等[21]发现细菌自身水解速率的增加也会导致细胞内ATP含量的下降。有研究表明抑菌剂能够通过影响三羧酸循环和还原氢的利用而对ATP的形成产生一定的影响[28]。
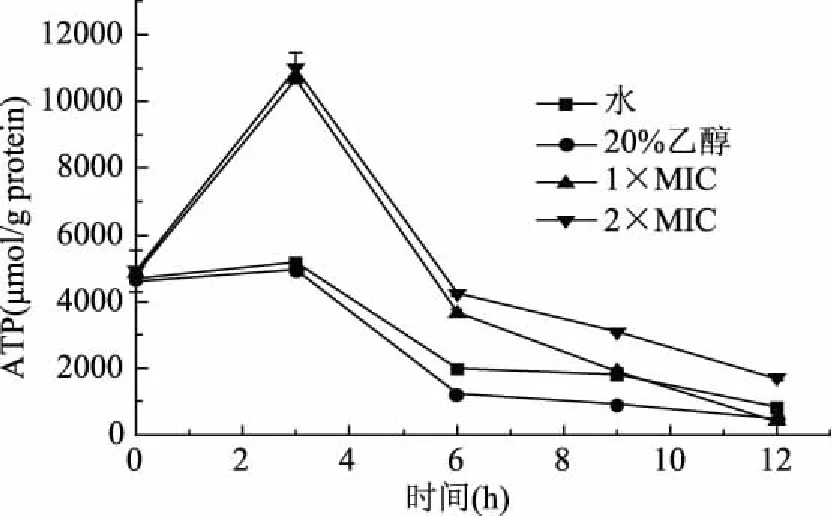
图6 柠檬烯对荧光假单胞菌ATP含量的影响Fig.6 Effects of limonene on ATP levels of P. fluorescens
2.8 柠檬烯对荧光假单胞菌琥珀酸脱氢酶活性的影响
琥珀酸脱氢酶在微生物的细胞能量代谢中起重要作用,其活性反映了细菌细胞的能量代谢状态[29]。琥珀酸脱氢酶是电子传递链中的关键酶,也是三羧酸循环中很重要的脱氢酶。琥珀酸脱氢酶受到干扰时会阻碍三羧酸循环与呼吸链之间的电子传递,从而对细胞的能量代谢产生影响,最终影响生物体的正常生命活动。柠檬烯对荧光假单胞菌的SDH活性影响如图7所示,空白组和乙醇组的荧光假单胞菌细胞中SDH活性略有下降,但是变化不大,1×MIC组的荧光假单胞菌细胞中的SDH活性先上升至32.58 U/mg,随后开始急剧下降,到12 h时下降至11.12 U/mg。但2×MIC组的荧光假单胞菌的SDH酶活则处于一种波动状态,但总体呈下降趋势,至12 h时活性为22.69 U/mg。整体而言,实验组的SDH活性要低于空白组。也许是柠檬烯与琥珀酸脱氢酶酶的侧链基团反应并改变其结构,导致酶的构象变化,从而降低酶活性[30]。此外,由于细菌的呼吸链位于细胞膜中,与抗菌剂的接触破坏了膜结构并破坏了酶系统在呼吸链中的功能[31]。说明柠檬烯对荧光假单胞菌细胞有损害作用,通过抑制琥珀酸脱氢酶的活性,阻碍细胞的正常能量代谢活动,从而阻碍荧光假单胞菌的正常生长。
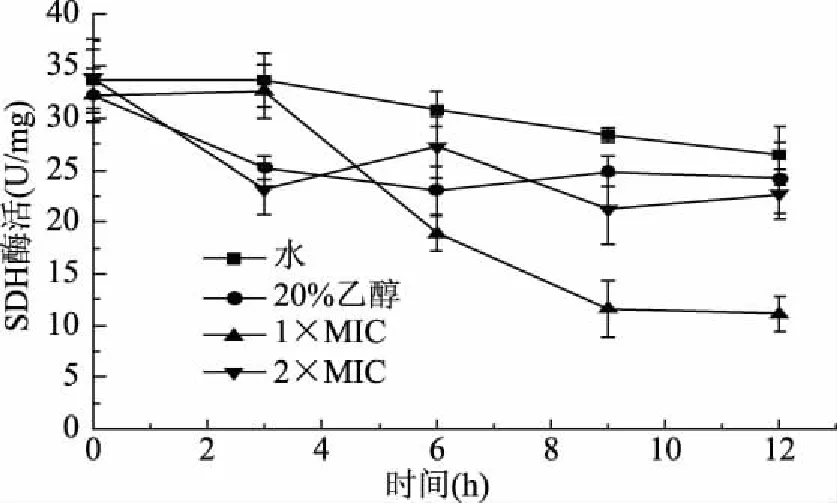
图7 柠檬烯对荧光假单胞菌SDH酶活力影响Fig.7 Effects of limonene on the activity of SDH enzyme from P. fluorescens
3 结论与讨论
本研究从细胞水平上,探究柠檬烯对荧光假单胞菌的抑菌机理,结果表明,柠檬烯对荧光假单胞菌具有较强的抑制和杀灭作用,其最小抑菌浓度为20 mL/L。柠檬烯能够使荧光假单胞菌的细胞膜完整性受到破坏,渗透性增加,菌体细胞质外渗,导致胞内蛋白质含量降低和相关酶的泄漏,干扰其正常的物质及能量代谢,甚至导致细胞死亡。
如今,消费者为保持健康的生活方式对天然和安全的食品产品越来越关注。因此,柠檬烯作为一种天然的活性物质抑菌剂,在天然防腐剂的开发等方面具有较好价值,也逐渐成为食品保鲜领域的重要组成部分。本研究已探索了柠檬烯作为天然抗菌剂对于嗜冷性腐败微生物代表的荧光假单胞菌的抑菌机理,表明柠檬烯在食品中的应用具有良好的潜力,同时也为研究天然单萜类化合物对一些腐败菌的抑菌机制等领域提供一定的参考。目前,对于柠檬烯抑菌机理的研究还不够充分,未来的研究期望能够进一步阐明柠檬烯对革兰氏阳性菌和革兰氏阴性菌的抑菌机理,并扩大柠檬烯在食品中的应用。
