臭茉莉正丁醇提取物抑菌活性研究
2019-08-26罗泽萍潘立卫
罗泽萍,潘立卫,覃 玥
(河池学院化学与生物工程学院,广西高校微生物及植物资源开发利用重点实验室,广西宜州 546300)
食源性疾病和食品病菌污染是当今世界上最广泛的卫生问题之一,也是我国食品安全问题的重点。金黄色葡萄球菌(S.aureus)是一种常见的食源性病原菌,可以通过各种途径和方式污染食品[1]。抑制食源性腐败菌和致病菌的生长、延长食品的保质期及防止食物变质等方面具有重要意义。因此,寻找新的、安全的、绿色及高效的抑菌食品添加剂已成为世界研究领域的热点课题之一。中草药活性成分具有化学合成物无法比拟的结构及生物活性多样性、多靶点抑制菌体生长繁殖、资源丰富、价格低廉、毒副作用小、不易残留及不易产生耐药性等优点,是天然防腐剂研究的宝贵资源。
臭茉莉(Clerodendrumphilippinumvar.simplex)为马鞭科大青属植物,其味微苦、平,归脾、肝、肾经,具有活血消肿、祛风除湿和化痰止咳等功效[2]。目前,对臭茉莉的研究主要集中在化学成分、提取工艺及抗氧化作用等[3-7],而对抑菌作用的研究未见文献报道。本实验拟考察臭茉莉正丁醇提取物(ECP)对4种供试菌的抑菌效果,并以S.aureus为例,通过考察其细胞膜、细胞壁及形态结构等的变化,研究ECP的抑菌活性及机理,以期为臭茉莉在食品、医疗等行业的应用提供实验依据和理论基础。
1 材料与方法
1.1 材料与仪器
臭茉莉 采摘于广西河池市宜州区小龙村,经河池学院化学与生物工程学院邓晰朝副教授鉴定为臭茉莉(Clerodendrumphilippinumvar.simplex)茎叶,将新鲜臭茉莉茎叶于50 ℃烘箱中烘干,粉碎后备用;金黄色葡萄球(S.aureusATCC6538)、伤寒杆菌(S.entericaATCC13311)、绿脓杆菌(P.aeruginosaATCC27853)、表皮葡萄球菌(S.epidermidisATCC35983) 河池学院化学与生物工程制药工程实验室保藏;活性氧(ROS)检测试剂盒 碧云天生物技术;钾离子测定试剂盒 长春汇力生物技术有限公司;SDS-PAGE凝胶配置试剂盒 上海诺伦生物医药技术有限公司;Annexin V-FITC/PI细胞凋亡检测试剂盒 江苏凯基生物技术股份有限公司;碱性磷酸酶(AKP)试剂盒、琥珀酸脱氢酶(SDH)试剂盒、苹果酸脱氢酶(MDH) 南京建成生物工程研究所;蛋白浓度测定试剂盒 北京常莱宝科技有限公司(20171116);其他试剂均国产为分析纯。
JA2003B电子天平 上海越平科学仪器有限公司;HVE-50全自动灭菌锅 华粤企业集团有限公司;ZHJH-C1209B超净工作台 上海智诚分析仪器制造有限公司;SPX-150生化培养箱 上海跃进医疗器械有限公司;SU80-40扫描电镜 日立高新技术公司;UV-8000紫外可见分光光度计 上海元析仪器有限公司;Accuri® C6 Plus流式细胞仪 美国BD;xMark酶标仪 美国伯乐BIO-RAD公司。
1.2 实验方法
1.2.1 臭茉莉提取物的制备 称600 g臭茉莉粉末,10倍量的80%乙醇超声提取3次,每次1 h,合并滤液,提取液依次用石油醚、乙酸乙酯、正丁醇萃取,减压浓缩蒸干溶剂,得到石油醚部位浸膏4.1 g、乙酸乙酯部位浸膏4.6 g、正丁醇部位浸膏26.5 g、水部位浸膏59.9 g。预实验结果显示正丁醇部位抑菌效果最好,因此,我们深入研究正丁醇部位的抑菌效果及机制。
1.2.2 药敏试验测定 牛肉膏蛋白胨琼脂培养基灭菌后倒入无菌培养皿中,待凝固后加入0.1 mL(109cfu/L)各供试菌菌悬液,无菌涂布环涂布均匀,37 ℃恒温培养箱中培养24 h。取专用药敏纸片(直径6.35 mm,吸水量为20 μL)和对照纸片均匀间隔贴于上述含菌平板表面,37 ℃恒温培养24 h后取出,用游标卡尺测定各药敏纸片抑菌圈直径,平行操作3次,计算平均抑菌圈直径(DIZ)[8]。以庆大霉素(加菌)及无菌水(不加菌)作为对照。
1.2.3 最低抑菌浓度(MIC)和最低杀菌浓度(MBC)测定 配置浓度分别为10.00、5.0、2.50、1.25、0.50、0.25、0.125、0.0625 mg/mL的ECP溶液,各取10 μL加入到含有100 μL的牛肉膏蛋白胨液体培养基与100 μL刃天青指示剂贮备液[9](由5 mL浓度为107cfu/mL的菌液和7.5 mL的刃天青指示剂配置,无菌孔以无菌水代替菌液)的96孔板中,37 ℃恒温培养24 h,无菌生长孔为蓝色,有细菌生长的孔会逐渐由蓝色变粉色。MIC确定后,吸取所有未变色浓度的样品5 μL,加入到100 μL培养基与刃天青指示剂贮备液中,培养24 h,仍旧不见颜色变化的孔,即为MBC。并设立庆大霉素组(加菌)及无菌水组(不加菌)作为对照。
1.2.4 生长曲线测定 牛肉膏蛋白胨液体培养基中分别加入对数生长期的S.aureus与ECP,使药物终浓度为1×MIC、2×MIC及3×MIC,并调整细菌的浓度为107cfu/mL,另设无菌水作为空白对照,37 ℃ 130 r/min摇床连续培养。每隔2 h紫外分光光度计测定600 nm波长下各组培养液吸光度值[10],取3次重复实验的平均值。
1.2.5 ECP对S.aureus细胞结构完整性的影响
1.2.5.1 细胞膜通透性测定 菌体处理方法同1.2.4。取连续培养1、2、3、4、5、6、7、8、9 h各组培养液2 mL,离心10 min(4000 r/min)并去除沉淀后,用紫外分光光度计测定各组培养液上清液DNA、RNA等大分子物质含量。取连续培养2、4、6、8、10、12 h各组培养液2 mL,离心10 min(4000 r/min)并去除沉淀后,试剂盒法测定培养液上清液K+含量[11-12]。取3次重复实验的平均值。
1.2.5.2 细胞壁通透性测定 菌体处理方法同1.2.4。取连续培养0、2、4、6、8、10、12 h各组培养液1.5 mL,离心10 min(4000 r/min)并去除沉淀后,试剂盒法测定各组培养液上清液AKP含量[13]。取3次重复实验的平均值。
1.2.5.3 蛋白质结构完整性的测定 菌体处理方法同1.2.4。取连续培养20 h的各组培养液,离心10 min(4000 r/min)并去除上清液,取沉淀用PBS稀释至在紫外分光光度计下吸光度为0.6(600 nm),取相同体积的各菌悬液离心去除上清液,将沉淀悬浮于样品缓冲液及无菌水的混合液中(体积比为1∶4)混匀,在100 ℃水浴中煮沸10 min,离心10 min(4000 r/min)去除沉淀,取上清液进行聚丙烯酰胺凝胶电泳[14]。
1.2.6 TCA循环中SDH、MDH活性的测定 菌体处理方法同1.2.4。取各组培养液2 mL,离心10 min(4000 r/min)并去除上清液,用0.1 mol/L的Tris-HCl(pH=7.4)缓冲液洗涤沉淀2~3次后,加入等体积的溶菌酶溶液,37 ℃水浴25 min后冰浴,再加入Tris-SDS(pH=9.0)缓冲液1 mL,低温离心15 min(10000 r/min)并去除沉淀[15]。按试剂盒说明书操作方法测定各组培养液上清液在2、4、6、8、10、12 h的SDH、MDH活性。
1.2.7 胞内ROS水平的测定 菌体处理方法同1.2.4。取连续培养12 h各组培养液,离心10 min(4000 r/min)并去除上清液,用PBS缓冲液洗涤沉淀2~3次后,再用PBS缓冲液稀释成106cfu/mL的菌悬液,按试剂盒说明书操作方法用流式细胞仪(FCM)检测各试验组荧光强度[16]。
1.2.8 细胞凋亡的测定 菌体处理方法同1.2.4。取连续培养20 h各组培养液离心10 min(4000 r/min)并去除上清液,用PBS缓冲液洗涤沉淀2~3次后,用连接素V(Annexin V)结合缓冲液稀释成1×106cfu/mL的菌悬液。按照试剂盒说明书操作方法用FCM测定各试验组荧光强度[16]。
1.2.9 细胞形态结构测定 在牛肉膏蛋白胨液体培养基中分别加入对数生长期的S.aureus与一定质量的ECP,使ECP终浓度为3×MIC,并调整细菌的浓度为1×109cfu/m,以无菌水作为空白对照组,于37 ℃、130 r/min振荡培养24 h后,按电镜制样技术准备待观察样本,通过扫描电镜(SEM)观察细胞结构[17]。
1.3 数据处理
采用SPSS 13.0软件对数据进行分析,数据用“X±S”表示,组间两两比较采用t检验,以p<0. 05 为差异有统计学意义。
2 结果与分析
2.1 ECP抑菌效果DIZ、MIC及MBC测定
由表1可见,ECP对表皮葡萄球菌、金黄色葡萄球、伤寒杆菌及绿脓杆菌均有不同程度的抑菌作用,DIZ分别为9.17、21.35、13.81及9.98 mm,MIC和MBC分别为2.50、5.00;0.50、0.50;1.25、1.25及2.50、2.50 mg/mL。表皮葡萄球菌、金黄色葡萄球属于革兰氏阳性菌,伤寒杆菌、绿脓杆菌属于革兰氏阴性菌,表明ECP对革兰氏阳性菌和阴性菌均有抑制作用,其中对金黄色葡萄球菌的抑菌作用最强,但是抑菌效果比庆大霉素弱,可能是因为庆大霉素纯度比较高,因此抑菌效果较好。因此,我们深入研究ECP对金黄色葡萄球菌的抑菌机理。
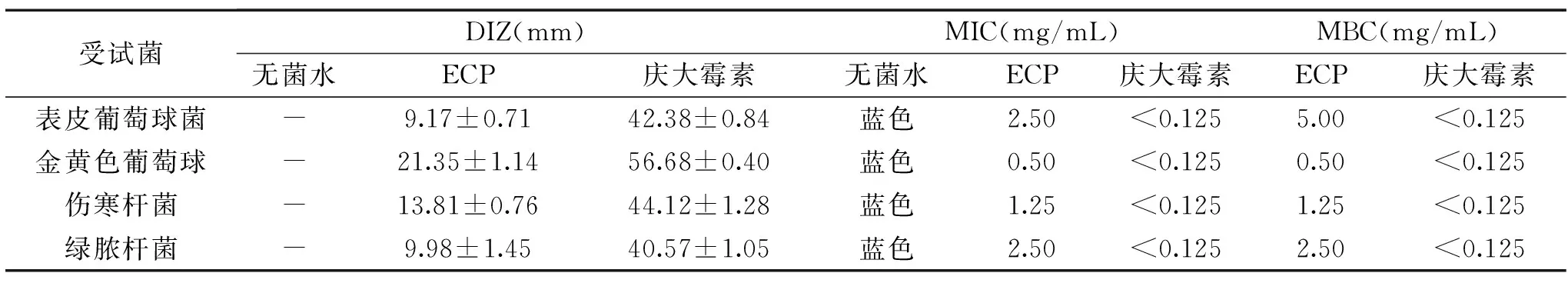
表1 ECP的DIZ、MIC及MBC测定结果Table 1 Results of DIZ,MIC and MBC of ECP
2.2 生长曲线的测定结果
细菌的生长曲线可以体现出菌体的生长规律、药物对细菌生长增殖周期的抑制情况、药物对细菌产生的作用机理及药效随时间的变化规律等[18-19]。由图1可见S.aureus在经过4 h延滞期后进入快速生长的对数期,而ECP处理组S.aureus未出现快速生长对数期,说明ECP具有缩短细菌的分裂速度,延缓其对数期,从而抑制菌体数量的增加,并且浓度越大,抑制效果越强。结果表明ECP的抑菌机理可能与影响菌体生长增殖周期有关。

图1 金黄色葡萄球菌生长曲线图Fig.1 Growth curves of S.aureus
2.3 ECP对S. aureus细胞结构完整性的影响
2.3.1 细胞膜完整性 细菌是通过细胞膜的通透性吸收周围的营养物质,同时把细胞内产生的废弃物排出细胞外[20-21]。K+是维持生命的重要矿物质之一,能维持细胞内外液的渗透压平衡及调节细胞的新陈代谢[22]。当细胞膜完整无损的时候K+不会出现外泄,但当细胞膜通透性增大时K+将出现大量外泄[23]。由图2、图3可见,与对照组相比,ECP处理组S.aureusDNA、RNA大分子物质、K+外泄逐渐增加,呈剂量-效应关系,在8 h时1×MIC、2×MIC、3×MIC组培养液S.aureus的DNA、RNA大分子物质外泄依次增加了0.74倍、1.88倍、2.39倍,K+外泄依次增加了0.68倍、2.32倍、3.49倍,且差异显著(p<0.05)。结果表明ECP对S.aureus的抑菌机理可能与破坏菌体细胞膜,使细胞膜通透性增大有关。
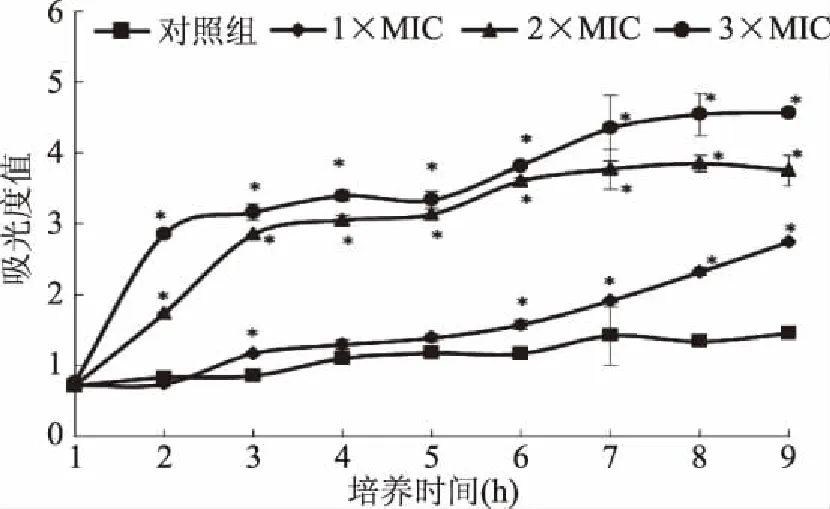
图2 DNA、RNA等大分子物质外泄曲线图Fig.2 Leakage curves of large molecules of DNA and RNA注:*代表相同培养时间下,与对照组相比差异显著,p<0.05;图3~图4、图6~图7同。

图3 K+外泄曲线图Fig.3 Leakage curves of K+
2.3.2 细胞壁完整性 细胞壁是维持细菌细胞外形完整的坚韧结构,它既能适应多样的环境变化,又能保护细菌的渗透作用[22]。AKP存在细胞壁和细胞膜之间,当细胞壁通透性增大或遭到破坏时培养液会检测到大量的AKP。由图4可以明显看出ECP处理过的菌体上清液中AKP的含量跟对照组比有明显增加,并随着浓度的增加而增大。12 h时1×MIC、2×MIC、3×MIC组与空白组相比分别增加了0.44倍、0.81倍、2.30倍,且差异显著(p<0.05)。结果表明ECP可能通过破坏细菌细胞壁完整性和通透性而起到抑菌作用。

图4 AKP外泄曲线图Fig.4 Leakage curves of AKP
2.3.3 蛋白质结构完整性 蛋白质具有维持机体新陈代谢及各类物质在体内的输送等功能,是生命活动的主要承担者。如果药物使菌体蛋白质特定的空间结构遭到破坏,其生物功能将丧失,药物将起到抑菌作用[21]。由图5可知,与对照组相比,ECP作用后,S.aureus可溶性蛋白质含量明显降低,但是种类并未发生改变,1×MIC、2×MIC、3×MIC组与对照组相比分别降低了18.39%、31.01%、38.07%。结果表明ECP的抑菌机理可能阻碍菌体某些蛋白的合成,从而起到抑制细菌生长的作用。

图5 可溶性蛋白含量的变化图Fig.5 Changes of soluble protein content注:泳道1:3×MIC;泳道2:2×MIC;泳道3:1×MIC;泳道4:对照组;泳道5:Marker。
2.4 ECP对TCA循环中SDH和MDH活性的影响
TCA循环是有氧呼吸中重要的生物化学变化过程,是物质代谢中心[24]。SDH和MDH是TCA循环的关键酶[25-26]。由图6和图7可知,ECP能降低菌体SDH、MDH活性;菌体在连续培养12 h时,1×MIC、2×MIC、3×MIC组与对照组相比SDH分别下降了61.73%、66.67%及80.25%;MDH下降了59.09%、69.06%及83.70%,且差异显著(p<0.05)。结果表明ECP的抑菌作用机理可能是通过破坏TCA循环,导致菌体新陈代谢减慢而起到抑制其繁殖和生长作用。

图6 SDH活性变化曲线图Fig.6 SDH activity change curves

图7 MDH活性变化曲线图Fig.7 MDH activity change curves
2.5 胞内活性氧水平的测定结果

图8 对照组ROS水平Fig.8 ROS levels of control group

图9 1×MIC组ROS水平Fig.9 ROS level of 1×MIC group
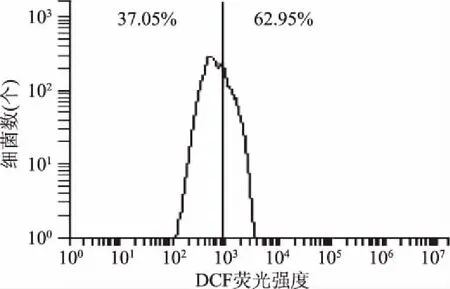
图10 2×MIC组ROS水平Fig.10 ROS level of 2×MIC groups

图11 3×MIC组ROS水平Fig.11 ROS level of 3×MIC groups
2.6 细胞凋亡测定结果
细胞凋亡是指细胞在环境条件改变时为了维护内环境稳定而通过基因调控使一些老化的细胞自动结束生命的过程。磷脂酰丝氨酸(PS)在细胞凋亡早期会从细胞膜内侧翻转到细胞膜表面。Annexin V是一种能与PS特异性结合的磷脂蛋白。用带有绿色荧光的荧光探针异硫氰酸荧光素(FITC)标记的Annexin V,即Annexin V-FITC,就可以用流式细胞仪非常简单而直接地检测到磷脂酰丝氨酸的外翻这一细胞凋亡的重要特征。碘化丙啶(propidine iodide,PI)是一种能通过凋亡中晚期破损细胞膜而对细胞核染色的染色剂,其不能通过活细胞膜。因此FITC标记的Annexin V结合PI双染色就可以将凋亡早晚期的细胞区分开来[29]。由图12~图15 FCM散点图可见,菌体经ECP处理后,Annexin V-FITC染色阳性并且PI染色阴性的细胞,即凋亡细胞增加(图的右下象限Q1-LR),Annexin V-FITC和PI染色双阳性的细胞,即坏死细胞,也有所增加(图的右上象限Q1-UR)。图中Annexin V-FITC染色阴性PI染色阳性(Annexin V-/PI+)所在象限(图的左上象限Q1-UL)出现的细胞点是许可范围内的检测误差。细胞凋亡率=Q1-UR+Q1-LR,1×MIC、2×MIC及3×MIC组细胞凋亡率对空白组对比分别增加了9.5%、16.3%、35.3%。结果表明ECP的抑菌作用可能与促使S.aureus发生细胞凋亡及影响菌体一系列基因的激活、表达以及调控具有一定关系。
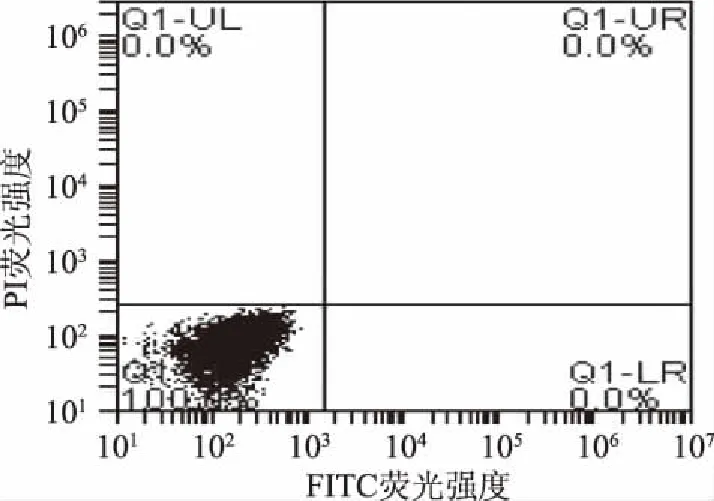
图12 对照组细胞凋亡图Fig.12 Apoptosis of control group
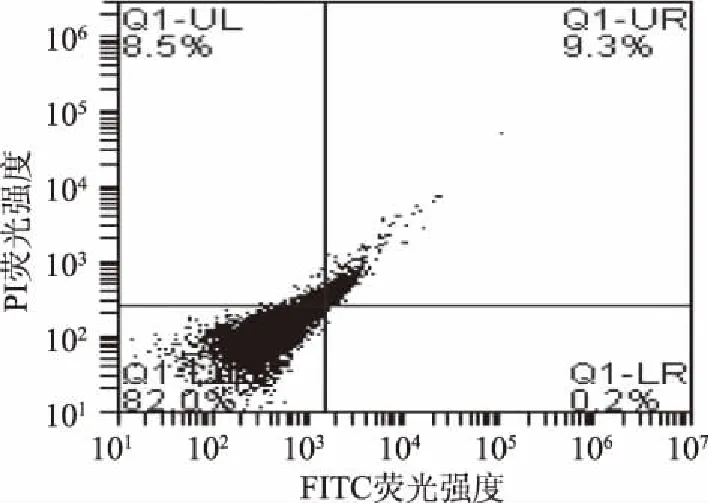
图13 1×MIC细胞凋亡图Fig.13 Apoptosis of 1×MIC group

图14 2×MIC细胞凋亡图Fig.14 Apoptosis of 2×MIC group

图15 3×MIC细胞凋亡图Fig.15 Apoptosis of 3×MIC group
2.7 形态构造变化测定结果
由图16可见对照组S.aureus扫描电镜下外观饱满、形态规则、表面光滑。图17可见ECP作用24 h后扫描电子显微镜(SEM)下菌体明显比对照组少,并且形态结构受损严重,出现皱缩、干瘪、畸形,甚至菌体自溶。表明ECP具有破坏菌体形态结构的作用,可能与破坏菌体细胞壁、细胞膜等作用有关。

图16 对照组扫描电镜图(5000×)Fig.16 SEM of the control group(5000×)

图17 3×MIC组扫描电镜图(5000×)Fig.17 SEM of 3×MIC group(5000×)
3 结论
抑菌试验结果显示ECP对革兰氏阳性菌及阴性菌均具有不同程度的抑菌作用,对S.epidermidis(G+)、S.aureus(G+)、S.enterica(G-)、P.aeruginosa(G-)的DIZ分别为9.17、21.35、13.81及9.98 mm,MIC和MBC分别为2.50、5.00,0.50、0.50,1.25、1.25及2.50、2.50 mg/mL,其中对S.aureus的抑制作用最强。S.aureus在ECP作用后,大量DNA、RNA等大分子物质、K+及AKP外泄;胞内活性氧水平失衡;细胞凋亡率明显增加;SDH活性、MDH活性均下降;蛋白质的合成受到抑制;SEM观察到菌体形态结构受损严重。结果表明ECP对S.aureus的抑菌靶点可能为细胞膜、细胞壁、三羧酸(TCA)循环关键酶、蛋白质和遗传物质等。综上所述,臭茉莉具有抑菌金黄色葡萄球菌的作用,在多个水平共同作用下发挥抑菌作用,具有控制多重耐药性细菌及应用于食品防腐的潜力。其抑菌单体化合物的进一步深入研发将丰富抗菌药筛选库,对其进行结构改造或修饰有望得到有前景的抗菌新药物。
