自配液基保存液在免疫细胞化学染色辅助细胞学诊断肺癌中的应用▲
2019-08-24韦荣干叶秋容周敏燕黄佳珍韦黎黎莫祥兰黄谟婉
韦荣干 叶秋容 周敏燕 黎 莉 黄佳珍 韦黎黎 莫祥兰 黄谟婉
(广西壮族自治区人民医院1 病理科,2 呼吸内科,南宁市 530021,电子邮箱:weironggan@163.com)
细胞学检查是诊断肺癌的主要方法之一,但肺癌的细胞学分型与组织学分型结果不尽一致,临床实践中可因活检取材不满意(如取材不到位、坏死组织多、肿瘤细胞少、组织挤压变形等),造成诊断困难或不能分类,进而延误治疗[1]。细胞学如能准确地诊断和分型既可以弥补活检的不足,又避免了再次取材的麻烦,也给一些晚期不适合手术的肺癌患者提供治疗的依据。良好的细胞涂片是细胞学检查的根本,其对诊断的准确性和及时性至关重要。传统细胞涂片由于受到涂片厚薄不一,血液、黏液、炎症细胞干扰,涂片固定不及时等诸多因素的影响,较难对肺癌进行诊断分型[2]。随着液基细胞学的引入,细胞学的诊断水平有了较大的提高[3],有文献报道,应用液基细胞制片进行免疫细胞化学染色(immunocytochemistry,ICC)辅助细胞学诊断肺癌的效果良好,但商品化的液基耗材成本较高,限制了其在细胞学诊断上的应用。本文采用自配液基保存液(以下简称“保存液”)保存纤维支气管镜(以下简称“纤支镜”)刷检和冲洗液的细胞学标本,液基制片后行ICC辅助细胞学诊断,并探讨该技术在肺癌细胞分型中的应用效果,以寻找一种经济实用、简单方便、效果理想、适合普及推广的液基制片方法,现报告如下。
1 资料与方法
1.1 资料 收集2013年6月至2014年7月我院纤支镜室送检的74份刷检和冲洗液标本,细胞学诊断均为肺癌,其中包含62例非小细胞癌和12例未能鉴别为低分化鳞癌、低分化腺癌或小细胞癌的肺癌标本,其中60例得到明确的组织学肺癌分型结果(10例鳞癌、47例腺癌和3例小细胞癌)。患者年龄31~89岁,中位年龄58岁;男46例,女28例。所有患者在纤支镜检查前均未进行放疗和化疗,细胞学诊断和组织学诊断由不同的医师独立完成。
1.2 主要试剂和设备 非小细胞癌采用抗体p63(p63基因)(批号:130506365E,140513365E)、细胞角蛋白(cytokeratin,CK)5/6(批号:130518276C,140420276C)、CK7(批号:130513166C,140402166C)和甲状腺转录因子1(thyroid transcription factor 1,TTF-1)(批号:130217599C,140505599C)进行鳞癌和腺癌的鉴别诊断,低分化鳞癌、低分化腺癌和小细胞癌采用抗体p63、CK5/6、CK7、TTF-1、突触素(synaptophysin,Syn)(批号:130418171B,140410171B)和神经细胞黏附分子(neural cell adhesion molecule,NCAM)56(又称CD56)(批号:130525256C,140417256C)进行鉴别诊断。以上抗体和本研究所用的免疫组化试剂盒(批号:1305069903,1404289903)均购自福州迈新公司。保存液的成分包含磷酸二氢钠、磷酸氢二钠和乙醇,将三者混溶后室温保存备用。离心制片机(型号:BDY-YJ)由武汉博达康激光电子设备有限公司提供。
1.3 方法
1.3.1 液基细胞制片:纤支镜刷检和冲洗液标本离体后均立即置于25 mL保存液中保存并送检。标本以1 500 r/min离心10 min,弃上清液,按沉淀量加入适量的10%二硫代苏糖醇(按10 ∶1比例),充分摇匀至黏液完全溶解,加入30 mL保存液后震荡3 min以清洗标本,1 500 r/min离心10 min,弃上清液并用保存液重悬标本沉淀制成浓度约20%的悬液,用离心制片法制成细胞涂片1张,剩余悬液保存于4℃冰箱。细胞涂片湿固定于95%乙醇15 min后进行巴氏染色,行细胞学诊断。对不能确定类型的含癌细胞标本,用离心制片法制作细胞涂片,涂片晾干后置于4℃丙酮中固定1 h,取出晾干后放入-20℃冰箱保存,用于ICC进行肺癌分型,ICC的具体操作步骤参照试剂说明书进行。
1.3.2 ICC分组:将细胞学诊断为非小细胞癌的但有明确组织学诊断的53例患者标本归为Ⅰ组,分别标记抗体p63、CK5/6、CK7和TTF-1。将7例未能鉴别为低分化鳞癌、低分化腺癌或小细胞癌的分化较差但有明确组织学诊断的癌细胞标本归入Ⅱ组,分别标记抗体p63、CK5/6、CK7、TTF-1、Syn和CD56。
1.3.3 ICC阳性判断:抗体在癌细胞着色部位:CK7、CK5/6着色于细胞质和细胞膜,Syn着色于细胞质,CD56着色于细胞膜,TTF-1和p63着色于细胞核。按着色强度判断,未着色0分,浅黄色1分,棕黄色2分,棕褐色3分。按着色细胞数量判断,癌细胞着色细胞数0%~5%为0分,着色细胞数6%~10%为1分,着色细胞数11%~25%为2分,着色细胞数>25%为3分。染色强度与阳性细胞百分比的乘积,0分为阴性(-),1~3分为弱阳性(+),4~6分为中度阳性(++),7~9分为强阳性(+++)。
1.5 统计学分析 采用SPSS 16.0软件进行统计分析。计数资料以例数(百分比)表示,组间比较采用卡方检验或Fisher确切概率法,以P<0.05为差异具有统计学意义。细胞学诊断与组织学诊断结果的一致性分析采用Kappa值检验,以Kappa值<0.4为一致性较差,0.4≤Kappa值≤0.7为一致性中等,Kappa值>0.7为一致性高。
2 结 果
2.1 细胞学+ICC检查与组织学对肺癌分型的一致性 以组织学结果为金标准,60例经组织学检查已明确肺癌分型的标本中(10例鳞癌、47例腺癌和3例小细胞癌,其中Ⅰ组鳞癌8例、腺癌45例,Ⅱ组鳞癌2例、腺癌2例、小细胞癌3例),细胞学+ICC分型结果如下:Ⅰ组诊断鳞癌8例、腺癌40例,5例因所选抗体全阴性未能进一步分类;Ⅱ组诊断鳞癌3例、腺癌2例、小细胞癌2例。Kappa一致性检验结果显示Kappa值=0.762,说明用保存液保存纤支镜刷检和冲洗液标本,可较好保存细胞抗原,使细胞学联合相关抗体对肺癌分型的结果与组织学分型的一致性较高。细胞学+ICC肺癌分型与组织学分型的比较见表1。
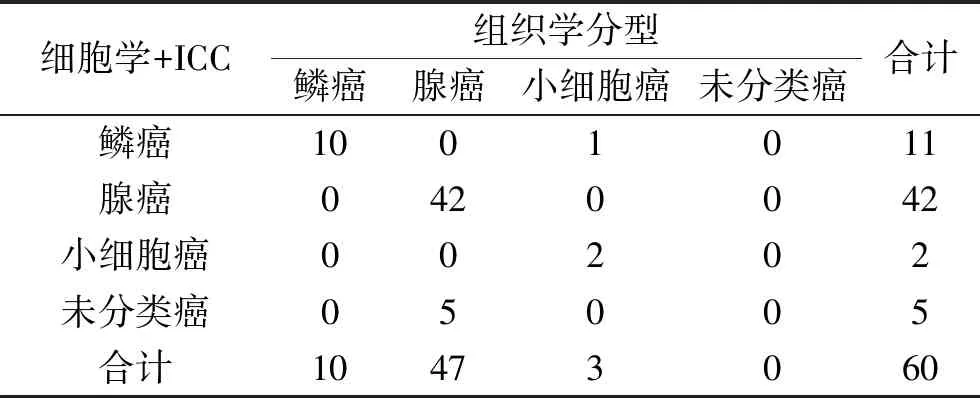
表1 细胞学+ICC分型结果与组织学的比较(n)
2.2 不同免疫细胞标志物在肺癌分型中的应用价值 以组织学结果为金标准,60例经组织学检查已明确肺癌分型的标本(10例鳞癌、47例腺癌和3例小细胞癌)中,经ICC检测p63、CK5/6对鳞癌的敏感度分别为80.0%和100.0%,CK7、TTF-1对腺癌的敏感度分别为85.1%和63.8%。在ICCⅡ组中,组织学诊断为小细胞癌的3例患者,ICC检测中Syn和CD56阳性各2例,敏感度均为66.7%。各抗体与组织学对肺癌分型结果见表2~表5,各抗体对肺癌分型的结果见图1。
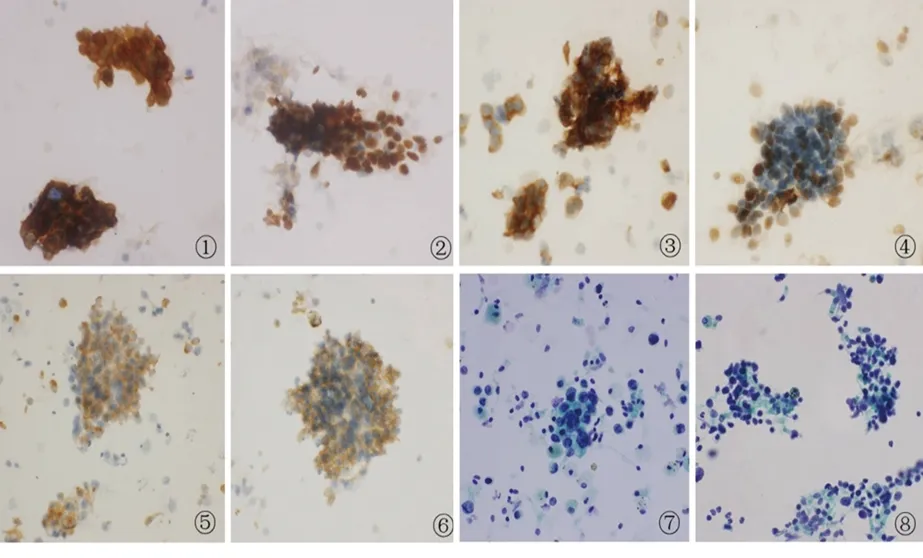
图1 各抗体对肺癌分型的结果
注:① CK5/6对肺鳞癌的分型[(+++),EnVision法,×400];② p63对肺鳞癌的分型[(+++),EnVision法,×400];③ CK7对肺腺癌的分型[(+++),EnVision法,×400];④ TTF-1对肺腺癌的分型[(+++),EnVision法,×400];⑤ Syn对肺小细胞癌的分型[(+++),EnVision法,×400];⑥ CD56对肺小细胞癌的分型[(+++),EnVision法,×400]。

表2 p63的ICC检测与组织学诊断肺鳞癌的结果比较(n)

表3 CK5/6的ICC检测与组织学诊断肺鳞癌的结果比较(n)
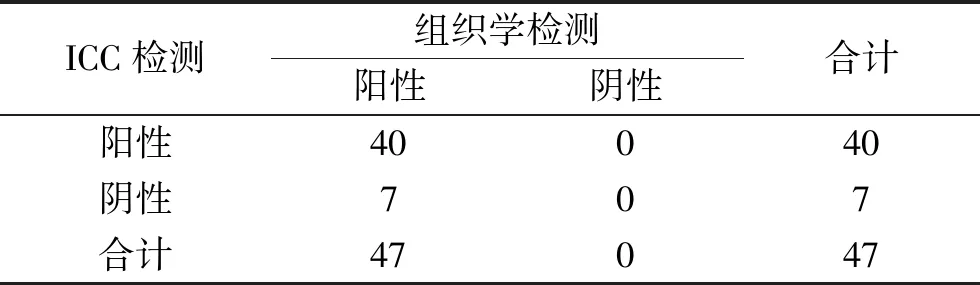
表4 CK7的ICC检测与组织学诊断肺腺癌的结果比较(n)

表5 TTF-1的ICC检测与组织学诊断肺腺癌的结果比较(n)
3 讨 论
细胞涂片巴氏染色对部分非角化型鳞癌与腺癌的鉴别,以及对低分化癌或分化较差的癌细胞的分型比较困难,加上传统细胞涂片存在厚薄不均、细胞不集中、ICC染色时细胞易脱落等问题,均不利于ICC在细胞学诊断上的应用,导致细胞学诊断时难以对疾病类型进行分型[4]。液基细胞涂片克服了传统涂片的上述弊病,同时剩余标本可以置于保存液中备用,有利于后续用于细胞学的其他检测。本研究应用自配液基保存液制作细胞涂片,在整个ICC过程中没有出现细胞脱落现象,阳性着色定位准确,无非特异性着色。
肺癌的靶向治疗要求病理诊断做到分型明确,免疫组化在肺癌分型中扮演着重要的角色[5]。研究显示,p63、CK5/6对肺鳞癌有较高的敏感性和特异性,而CK7、TTF-1则对肺腺癌有较高的敏感性和特异性[6-7],CK7、TTF-1可以联合其他抗体鉴别肺腺癌的原发性和转移性[8]。Syn、CD56是神经内分泌癌免疫组化常用的标记物,文献报道,Syn、CD56对纤支镜活检标本小细胞癌的阳性率分别为48.4%和100%[9]。本研究选用p63、CK5/6、CK7、TTF-1对细胞学诊断为非小细胞癌的标本进行肺癌分型,选用Syn和CD56对小细胞癌进行鉴别,结果显示,p63、CK5/6对鳞癌的敏感度,CK7、TTF-1对腺癌的敏感度均较高,Syn和CD56对3例小细胞癌也显示出良好的敏感性,与文献报道结果相似[10-11]。同时本研究中ICC对肺癌的分型结果与组织学分型的一致性较高(Kappa值=0.761 6)。提示保存液保存纤支镜刷检和冲洗液标本,对细胞抗原的保存较好,可用于ICC检测,结合相关抗体的表达,可提高细胞学诊断肺癌的水平。
本研究结果还显示,p63、CK7和TTF-1的敏感性较组织学偏低,可能与下列因素有关:(1)纤支镜细胞学取材时得到的肿瘤细胞数量较少;(2)脱落的肿瘤细胞其抗原的丢失程度可能较活检组织多;(3)细胞涂片ICC核抗体需穿透细胞膜才能和核抗原相结合,而组织切片核抗体可直接与核抗原结合。
综上所述,ICC可以为肺癌分型提供更多的客观依据,良好的细胞保存和固定既是ICC质量保证的先决条件,又是做出正确诊断的基础。自配液基保存液保存纤支镜刷检和冲洗液细胞标本后行液基制片再进行ICC检测,其对肺癌的分型结果与组织病理学诊断的一致性较高。与成本较高的商品化液基耗材相比,自配液基保存液费用低,检测结果稳定,且操作简便,可进行普及和推广,但其对细胞抗原保存的效果是否优于商品化液基保存液,还有待研究。
