重楼皂苷Ⅱ对高糖干预下肾小球系膜细胞增殖及氧化应激的影响▲
2019-08-24毕慧欣李清初
毕慧欣 杨 琼 李清初 曾 凝
(桂林医学院附属医院1 肾内科,2 内分泌科,广西桂林市 541000,电子邮箱:doctorkeyan@163.com)
糖尿病肾病(diabetic nephropathy,DN)患病率在全球范围内逐年升高,是导致终末期肾病的主要原因,尚无特效药物可以逆转其肾脏损伤。在DN进展中,肾小球系膜细胞(glomerular mesangial cell,GMC)在不同损伤因素作用下,可表现为增殖肥大、凋亡、裂解、迁移、分泌大量的炎症因子,而这可加重肾脏损害及促进DN持续进展[1]。由于DN存在糖、脂肪代谢紊乱,导致线粒体功能紊乱和体内氧化应激水平的升高[2]。研究表明,高糖诱导的线粒体呼吸链产生过量活性氧是DN并发症的启动因素,表现为活性氧、丙二醛增多和超氧化物歧化酶(superoxide dismutase,SOD)活性下降[3-4],因此降低氧化应激水平可有效防治DN进展。重楼皂苷Ⅱ是中药重楼提取物。现代药理学表明,重楼皂苷Ⅱ具有抗氧化、抗肿瘤、免疫调节、抗菌、消炎等作用[5]。本研究观察重楼皂苷Ⅱ对高糖干预下GMC细胞增殖及氧化应激的影响,以探讨重楼皂苷Ⅱ治疗DN的作用机制。
1 材料和方法
1.1 材料 大鼠GMC株由上海第二医科大学惠赠,低糖杜氏改良伊格尔培养基(Dulbecco′s modified Eagle medium,DMEM)、胰蛋白酶购自美国HyClone公司(批号:SH30021.01B、T1426),胎牛血清购自杭州四季青生物技术公司(批号:10082-147),SOD、丙二醛试剂盒购自武汉优尔生商贸有限公司(批号:SD103、MS1401),四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)、二甲亚砜购自美国Sigma公司(批号:M2129、D2650),重楼皂苷Ⅱ购自维克奇有限公司(批号:B01172201),二氯二氢荧光素-乙酰乙酸酯(2′,7′-dichlorodihydrofluorescein diacetate,DCFH-DA)试剂盒购自碧云天有限责任公司(批号:S0033)。青霉素购自石药集团中诺药业(批号:0171810402),链霉素购自哈药集团制药总厂(批号:23020912)。
1.2 细胞培养 大鼠GMC株培养于含10%胎牛血清、100 U/mL青霉素、100 mg/L链霉素的低糖DMEM培养基(葡萄糖浓度5.6 mmol/L),于37℃、5% CO2无菌培养箱中孵育。当细胞融合成80%时,用0.25%的胰蛋白酶消化并用计数板计数。细胞以1×105个/mL的密度培养于25 cm2培养瓶中。当80%的细胞贴壁时,按实验分组对细胞进行处理。
1.3 细胞分组 细胞稳定传代至对数生长期时,弃上清,加入无血清低糖培养液同步24 h后,将GMC按随机数字表法分为4组。(1)正常对照组:即低糖组,用含5.6 mmol/L葡萄糖的DMEM培养基进行培养;(2)甘露醇对照组:含5.6 mmol/L葡萄糖+19.5 mmol/L甘露醇的DMEM培养基进行培养;(3)高糖组:用含25 mmol/L葡萄糖的DMEM培养基进行培养;(4)重楼皂苷Ⅱ组:用含25 mmol/L葡萄糖+20 μg/mL重楼皂苷Ⅱ的DMEM培养基进行培养。将上述细胞于37℃、5% CO2无菌培养箱中培养24 h后用于后续的实验。
1.4 MTT法检测细胞增殖活性 GMC以3×103个/孔密度接种于96孔板中,贴壁24 h。按分组更换培养液,继续培养24 h后弃上清液,每孔加入含0.5% MTT的培养基200 μL。继续培养4 h,小心吸去培养液,每孔加入150 μL二甲亚砜,置温箱中低速振荡10 min,使结晶物充分溶解。在酶联免疫检测仪490 nm处测量各孔的吸光度(A)值,计算细胞增殖情况。
1.5 紫外分光光度法测定SOD、丙二醛活性的测定 收集处理24 h后上述各组细胞上清液,按照SOD试剂盒说明书使用黄嘌呤氧化酶法测定细胞上清液中SOD的活性,紫外分光光度计在550 nm处测定样品的A值,根据酶的定义,1 mL液体中SOD的抑制率为50%时对应的 SOD活性为1个单位。按照丙二醛试剂盒说明书使用硫代巴比妥酸法检测丙二醛含量,紫外分光光度计在532 nm处测定样品的A值。相同标本设3个复孔,重复3次。
1.6 DCFH-DA荧光探针标记法检测活性氧含量 按照1 ∶1 000的比例用无血清培养液稀释DCFH-DA,按照原位装载探针的方法,取出干预24 h的培养板,去除细胞培养液,加入10 μmol/L的DCFH-DA 300 μL,阳性对照孔加入Rosup作为阳性对照。37℃细胞培养箱内孵育30 min,用无血清细胞培养液洗涤细胞3次,30 s/次,以充分去除未进入细胞内的DCFH-DA,激光共聚焦显微镜(德国莱卡公司,型号:TCS SP8 DIVE)下观察GMC荧光强度并用多功能酶标仪(德国LabSystems Multiskan MS公司,型号:352型)检测荧光强度。
1.7 统计学分析 应用SPSS 17.0软件进行统计学分析。计量资料采用(x±s)表示,多组间比较采用方差分析,组间两两比较使用LSD-t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 4组GMC增殖活性比较 与正常对照组比较,高糖组、重楼皂苷Ⅱ组细胞的A值升高(P<0.05),而甘露醇对照组差异无统计学意义(P>0.05)。与高糖组比较,重楼皂苷Ⅱ组细胞的A值降低(P<0.05)。见表1。
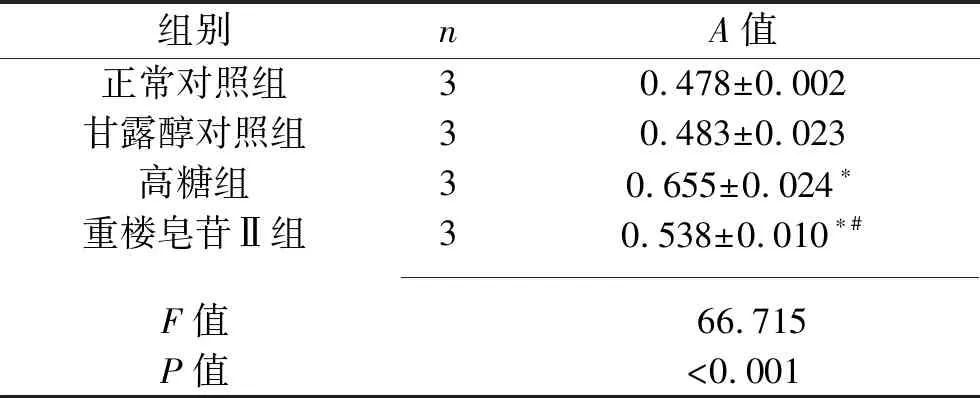
表1 4组细胞A值比较(x±s)
注:与正常对照组比较,*P<0.05;与高糖组比较,#P<0.05。
2.2 4组GMC丙二醛含量及SOD活性比较 与正常对照组比较,高糖组、重楼皂苷Ⅱ组细胞的丙二醛含量升高,SOD活性降低(P<0.05),但甘露醇对照组差异无统计意义(P>0.05)。与高糖组比较,重楼皂苷Ⅱ组细胞的丙二醛含量降低,而SOD活性升高(P<0.05)。见表2。
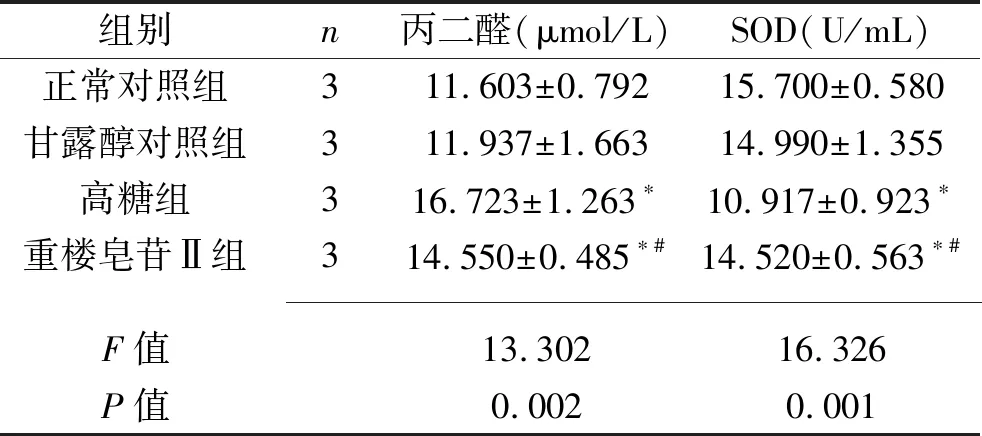
表2 4组GMC丙二醛含量及SOD活性比较(x±s)
注:与正常对照组比较,*P<0.05;与高糖组比较,#P<0.05。
2.3 4组GMC活性氧含量比较与正常对照组比较,高糖组、重楼皂苷Ⅱ组细胞的活性氧含量升高(P<0.05),甘露醇对照组差异无统计学意义(P>0.05)。与高糖组比较,重楼皂苷Ⅱ组细胞的活性氧含量降低(P<0.05)。见表3。
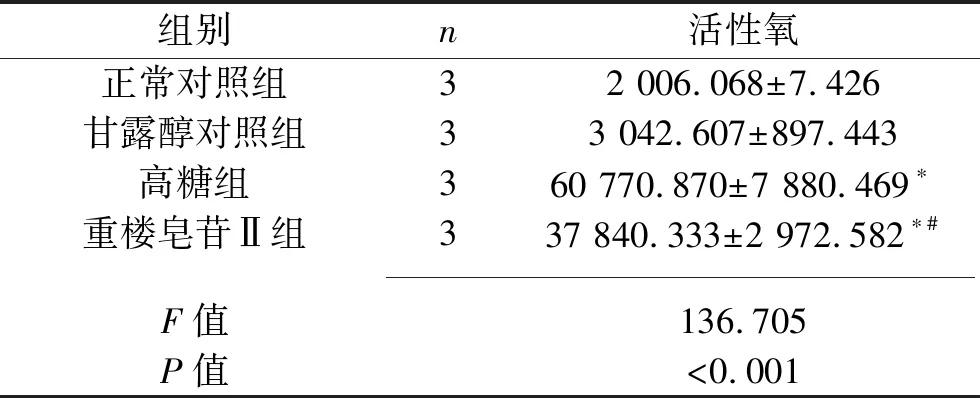
表3 4组GMC活性氧含量比较
注:与正常对照组比较,*P<0.05;与高糖组比较,#P<0.05。
3 讨 论
DN的发生涉及氧化应激、遗传因素、代谢异常、血流动力学改变、细胞因子等因素。DN患者体内活性氧的浓度较正常人明显升高,提示在DN的发病过程中,氧化应激系统起着非常重要的作用[6]。
GMC在正常情况下基本不增殖,只有在高糖、氧化应激、炎症等病理情况下可异常增殖。高糖环境下发生异常增殖的GMC,是最活跃的固有细胞成分,增殖的GMC除了突入肾小球毛细血管腔导致管腔狭窄或闭塞,还可以使细胞外基质大量地产生并积聚,最终导致肾小球硬化。因此,抑制GMC激活、增殖以及促进GMC凋亡是防治糖尿病的有效途径。既往研究表明重楼对多种肿瘤细胞均有抑制作用,可诱导肿瘤细胞凋亡、抑制肿瘤细胞增殖等[7]。本课题组前期研究也显示,脂多糖可诱导GMC增殖,重楼含药血清可通过调节B细胞淋巴瘤-2基因表达诱导GMC凋亡,抑制GMC异常增殖,发挥其治疗作用[8]。本研究利用25 mmol/L葡萄糖刺激GMC,建立细胞高糖损伤模型,观察重楼皂苷Ⅱ对GMC的保护作用,结果显示,与正常对照组比较,高糖组细胞A值明显升高(P<0.05),说明高糖可明显诱导GMC增殖,而重楼皂苷Ⅱ组细胞的A值低于高糖组(P<0.05),说明重楼皂苷Ⅱ可抑制GMC的增殖,进而保护糖尿病肾脏固有细胞,这与既往相关研究结果相似[9-10]。
重楼为百合科植物云南重楼或七叶一枝花的干燥根茎,是中国传统民间医药。目前已经从重楼里分离出许多不同的活性物质成分,具有显著的抗肿瘤、抗感染、器官保护、免疫调节及止血镇痛等功效,近年来其抗氧化应激作用备受关注[7]。氧化应激是细胞内氧自由基产生与清除的失衡,导致活性氧在细胞内蓄积而引起氧化损伤的过程。DN中活性氧的产生主要来源于糖基化终末产物途径、多元醇代谢反应途径、蛋白激酶C活化作用途径和线粒体呼吸链功能不足等[9]。高血糖直接作用于血管内皮细胞可产生活性氧,活性氧产生过多是糖尿病及其血管并发症发生的主要因素,可直接氧化和破坏与之结合的DNA、蛋白、脂质和碳水化合物,还可以作为第二信使参与细胞信号转导,激活增殖、凋亡、损伤和炎症等应激相关的信号通路,造成细胞损伤,同时参与介导促纤维化基因表达[11-13]。研究表明,重楼提取物能抑制丙二醛生成以及脂质过氧化,能稳定、有效地清除自由基,并可减轻DNA的氧化损伤,具有良好的清除自由基效果及抗氧化能力[14]。刘功成等[15]发现重楼叶多糖能增强小鼠脾脏免疫功能并提高抗氧化活性。本研究结果显示,与正常对照组比较,高糖组细胞的活性氧含量升高(P<0.05),说明高糖作用下GMC内活性氧表达增高,表明高糖造成了一定程度的氧化应激损伤;而与高糖组比较,重楼皂苷Ⅱ组细胞的活性氧含量降低(P<0.05),说明重楼皂苷Ⅱ有效抑制了高糖诱导的氧化应激反应。此外,与正常对照组比较,高糖组、重楼皂苷Ⅱ组细胞的丙二醛含量升高、SOD活性降低(P<0.05),经过重楼皂苷Ⅱ干预后,重楼皂苷Ⅱ组细胞的丙二醛含量降低而SOD活性升高(P<0.05),提示重楼皂苷Ⅱ可能通过提高SOD活性,增强其对自由基的清除能力,降低丙二醛含量,从而减轻对GMC的氧化损伤作用。
综上所述,重楼皂苷Ⅱ可以抑制高糖诱导的GMC增殖,并可减轻细胞氧化应激损伤,这可能其与减少细胞内活性氧产生和提高SOD活性有关。但本研究只局限于体外研究,下一步将建立动物模型证实相关结论及进一步探讨具体机制。
