Armcx3调控H9C2心肌细胞肥厚的作用研究*
2019-08-24蔡邦兰税新东王建东
蔡邦兰,范 玥,税新东,王建东,张 红△
1.成都医学院 检验医学院 (成都 610500);2.四川省动物源性食品兽药残留防控技术工程实验室 (成都 610500);3. 四川科伦博泰生物医药股份有限公司(成都 610072);4. 成都医学院 生物科学与技术学院 (成都 610500)
心肌肥厚是心脏为适应各种刺激而产生的心肌细胞体积增大,持续运动锻炼常诱导生理性肥厚发生,这种心肌肥厚是可逆的;而当心脏处于慢性持续压力状态,如高血压和瓣膜疾病时,则会发生病理性肥厚,最终导致心力衰竭,增加猝死的发生率[1-2]。引起心肌肥厚的生理病理因素很多,而线粒体作为心肌细胞的主要能量来源,以及维系细胞内稳态的重要细胞器,其在心肌肥厚的发生发展中的发挥了重要作用[3-4]。因此,深入研究线粒体功能障碍在心肌肥厚发生中的作用机制具有非常重要的意义。X连锁犰狳重复蛋白3 (armadillo repeat containing X-linked 3, Armcx3),又被命名为上皮癌中X染色体缺失的Arm蛋白3 (arm protein lost in epithelial cancers on chromosome X 3, Alex3),是Alex家族中的成员[5-6]。Armcx3是一个线粒体的外膜蛋白,已有研究[6-8]表明,Armcx3蛋白在调节线粒体的聚集和运动中发挥了重要作用,但是其在心肌肥厚中的作用还不清楚。本研究采用慢病毒转染H9C2细胞,通过观察过表达Armcx3与干扰Armcx3表达对H9C2细胞形态以及心肌肥厚标志物心房利钠肽(atrial natriuretic peptide, ANP)和脑钠肽(brain natriuretic peptide, BNP) mRNA含量的影响,以期探讨Armcx3在调控H9C2细胞肥厚中的作用。
1 材料与方法
1.1 实验材料与试剂
H9C2细胞株购于中科院上海细胞典藏库,慢病毒HBIV-puro、HBIV-Armcx3、HBIV-puro(shRNA)、HBIV-Armcx3(shRNA)由上海汉恒生物科技有限公司构建。DMEM完全培养基购自HyClone公司,胎牛血清购自BI公司。嘌呤霉素、辣根过氧化物酶标记的山羊抗兔IgG和山羊抗小鼠IgG、Alexa Fluor®555荧光标记驴抗兔IgG、Alexa Fluor®488荧光标记山羊抗小鼠IgG购自碧云天生物科技研究所。细胞总RNA提取试剂盒购自成都福际生物技术有限公司,一步法RNA反转录试剂盒、SYBR GREEN实时荧光定量PCR预混液购自赛默飞世尔公司。兔抗Armcx3多克隆抗体购自爱博泰克生物科技有限公司,小鼠抗β-actin单克隆抗体购自成都正能生物技术有限责任公司,兔抗BNP多克隆抗体购自北京博奥森生物技术有限公司,小鼠抗GAPDH单克隆抗体购自BioX公司。PVDF膜和ECL化学发光试剂购自Millipore公司。
1.2 实验方法
1.2.1 慢病毒感染H9C2细胞模型的建立 HBIV-puro、HBIV-Armcx3、HBIV-puro(shRNA)、HBIV-Armcx3(shRNA)等慢病毒采用梯度稀释法测定并计算病毒滴度,经计算得到各组慢病毒滴度均达到2×108PFU/mL,可以用于下一步感染实验。取对数生长期的H9C2细胞,接种于24孔板中,接种量5×104/孔,用含10%胎牛血清的DMEM培养基于37 ℃、5% CO2培养24 h,待细胞密度达70%~80%时,以病毒液与培养液体积比1∶9,分别加入HBIV-puro、HBIV-puro(shRNA)、HBIV-Armcx3、HBIV-Armcx3(shRNA)等慢病毒进行感染,24 h后,更换新鲜培养液并加入2.5 mg/L的嘌呤霉素筛选阳性细胞。持续筛选2周后,获得各组慢病毒稳定感染H9C2细胞株。
1.2.2 蛋白质印迹技术(Western blot)检测各组慢病毒稳定感染H9C2细胞中蛋白的表达 分别收集各组慢病毒稳定感染的H9C2细胞,加入RIPA裂解液冰上裂解30 min,于4 ℃,12 100 r/min,离心半径6 cm,离心15 min,收集裂解上清液,BCA法测定蛋白浓度。SDS-PAGE电泳,每组上样40 μg/泳道,PVDF膜湿转60 min,分别加兔抗Armcx3抗体(1∶1 000)、兔抗BNP抗体(1∶1 000)、鼠抗GAPDH抗体(1∶5 000),4 ℃孵育过夜,TBST洗膜3次,分别加辣根过氧化物酶标记的山羊抗兔IgG(1∶2 000)或山羊抗小鼠IgG(1∶2 000),37 ℃孵育1 h,TBST洗膜3次,ECL化学发光法检测相关蛋白的表达。
1.2.3 免疫荧光技术观察各组慢病毒稳定感染H9C2细胞形态及细胞表面积测定 分别收集各组慢病毒稳定感染的H9C2细胞,接种于放置了多聚赖氨酸包被圆玻片的24孔板中,接种量1.5×104个/孔,37 ℃、5% CO2培养24 h后,吸去培养基,PBS洗涤3次,冰甲醇-20 ℃固定15 min,PBS洗涤3次,使用含有羊血清和驴血清的封闭液室温封闭1 h,加兔抗Armcx3抗体(1∶200)、小鼠抗β-actin抗体(1∶1 000),4 ℃孵育过夜,PBS洗涤3次,再加Alexa Fluor®555荧光标记驴抗兔IgG (1∶1 000)和Alexa Fluor®488荧光标记山羊抗小鼠IgG(1∶1 000),室温孵育1 h,PBS洗涤3次,封片,利用荧光显微镜观察照相。实验重复3次,利用Image-Pro Plus软件随机统计各组慢病毒稳定感染的H9C2细胞中300个细胞的表面积。
1.2.4 实时荧光定量PCR检测各组慢病毒稳定感染H9C2细胞中ANP和BNP的mRNA含量 分别收集各组慢病毒稳定感染的H9C2细胞,按照RNA提取试剂盒说明书提取各组H9C2细胞总RNA,采用紫外分光光度法检测各组RNA的浓度,并按照反转录试剂盒操作说明合成cDNA,然后按如下程序进行实时荧光定量聚合酶链式反应(quantitative real-time PCR,qPCR):94 ℃,2.5 min;40个循环( 94 ℃,15 s;57 ℃,30 s;72 ℃,30 s);72 ℃,10 min;添加熔解曲线。采用2-ΔΔCt法计算mRNA的相对含量。qPCR引物由北京擎科新业生物技术有限公司合成,引物序列如下(表1)。

表1 qPCR扩增产物引物序列
1.3 统计学方法
2 结果
2.1 Armcx3过表达与干扰Armcx3表达H9C2细胞模型的构建
分别收集各组慢病毒稳定感染的H9C2细胞,利用Western blot方法检测各组H9C2细胞中Armcx3蛋白的表达情况。与对照组相比,过表达Armcx3慢病毒感染的H9C2细胞中,Armcx3蛋白表达明显升高(P<0.001);而与对照组相比,干扰Armcx3慢病毒感染的H9C2细胞中,Armcx3蛋白表达明显降低(P=0.033),表明Armcx3过表达与干扰Armcx3表达的H9C2细胞模型构建成功(图1)。
2.2 Armcx3可以调控H9C2细胞肥厚
对各组慢病毒稳定感染的H9C2细胞进行细胞免疫荧光染色,结果所示,与对照组相比,过表达Armcx3的H9C2细胞形态明显变得纤细,呈现收缩状态;而干扰Armcx3表达的H9C2细胞,细胞形态明显增大,呈摊饼状(图2)。
进一步利用Image-Pro Plus软件随机统计各组300个细胞的面积,结果所示,过表达Armcx3的H9C2细胞平均表面积约为(16 157±5 636)μm2,与对照组H9C2细胞平均表面积(21 465±7 265)μm2相比,其平均表面积明显降低(P<0.001);而干扰Armcx3表达的H9C2细胞平均表面积为(31 569±15 068)μm2,与对照组H9C2细胞平均表面积(21 425±7 307)μm2相比,其平均表面积明显增加(P<0.001)(图2)。
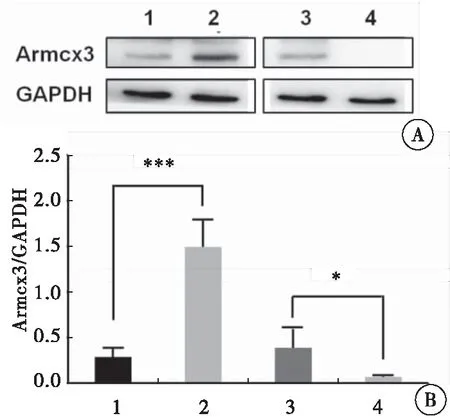
图1 Western blot检测各组H9C2细胞中Armcx3蛋白的表达
注:A:Western blot检测各组H9C2细胞中Armcx3蛋白的表达;B:各组H9C2细胞中Armcx3蛋白含量的统计分析;1:HBIV-puro慢病毒感染的H9C2细胞;2:HBIV-Armcx3慢病毒感染的H9C2细胞;3:HBIV-puro(shRNA)慢病毒感染的H9C2细胞;4:HBIV-Armcx3(shRNA)慢病毒感染的H9C2细胞;与对照组比较,*P< 0.05,***P< 0.001
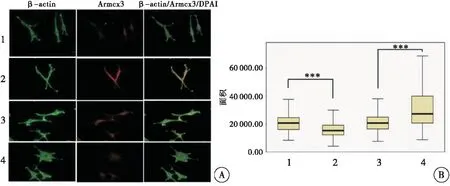
图2 Armcx3过表达与干扰Armcx3表达对H9C2细胞形态的影响(×400)
注:A:免疫荧光检测各组H9C2细胞中β-actin、Armcx3的表达和分布情况;B:各组H9C2细胞中细胞面积的统计分析;1:HBIV-puro慢病毒感染的H9C2细胞;2:HBIV-Armcx3慢病毒感染的H9C2细胞;3:HBIV-puro(shRNA)慢病毒感染的H9C2细胞;4:HBIV-Armcx3(shRNA)慢病毒感染的H9C2细胞;绿色:β-actin;红色:Armcx3;蓝色:DAPI;与对照组比较,***P< 0.001;每组统计细胞数n=300
2.3 Armcx3可以调控H9C2细胞中ANP和BNP的mRNA水平
利用实时荧光定量PCR检测各组H9C2细胞中ANP和BNP的mRNA含量。与对照组相比,过表达Armcx3慢病毒感染的H9C2细胞,ANP和BNP的mRNA含量分别为(0.32±0.16)和(0.16±0.03),均明显降低(P=0.002,P=0.005);而与对照组相比,干扰Armcx3慢病毒感染的H9C2细胞,ANP和BNP的mRNA含量分别为(2.08±0.34)和(2.90±0.53),均明显升高(P<0.001)(图3)。
2.4 Armcx3调控H9C2细胞中BNP蛋白的表达
利用Western blot方法检测各组H9C2细胞中BNP蛋白的表达情况。与对照组相比,过表达Armcx3慢病毒感染的H9C2细胞中,BNP蛋白表达明显降低(P=0.038);而干扰Armcx3慢病毒感染的H9C2细胞中,BNP蛋白表达明显升高(P<0.001)。以上结果表明,过表达Armcx3抑制H9C2细胞肥厚,而干扰Armcx3表达则诱导H9C2细胞肥厚(图4)。
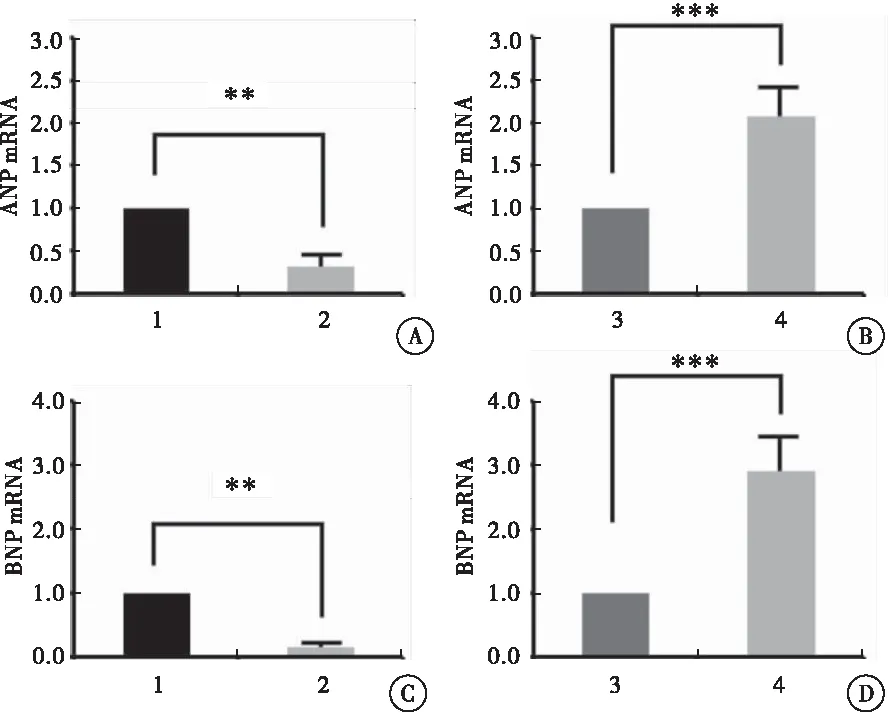
图3 qPCR检测各组H9C2细胞中ANP和BNP的mRNA含量
注:A:qPCR检测过表达Armcx3的 H9C2细胞中ANP的 mRNA含量;B:qPCR检测干扰Armcx3表达的H9C2细胞中ANP的mRNA含量;C:qPCR检测过表达Armcx3的H9C2细胞中BNP的mRNA含量;D:qPCR检测干扰Armcx3表达的H9C2细胞中BNP的mRNA含量;1:HBIV-puro慢病毒感染的H9C2细胞;2:HBIV-Armcx3慢病毒感染的H9C2细胞;3:HBIV-puro(shRNA)慢病毒感染的H9C2细胞;4:HBIV-Armcx3(shRNA)慢病毒感染的H9C2细胞;与对照组比较,**P< 0.01,***P< 0.001
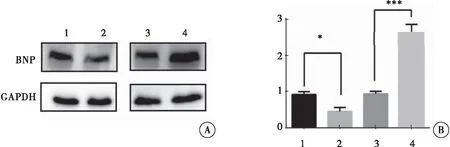
图4 Western blot检测各组H9C2细胞中BNP蛋白的表达
注:A:Western blot检测各组H9C2细胞中BNP蛋白的表达;B:各组H9C2细胞中BNP蛋白含量的统计分析;1:HBIV-puro慢病毒感染的H9C2细胞;2:HBIV-Armcx3慢病毒感染的H9C2细胞;3:HBIV-puro(shRNA)慢病毒感染的H9C2细胞;4:HBIV-Armcx3(shRNA)慢病毒感染的H9C2细胞;与对照组比较,*P<0.05,***P<0.001
3 讨论
心肌肥厚是由于压力负荷和心脏容量增加而导致心肌细胞体积或面积增大的一种典型生理病理特征,此时心肌细胞内β-肌球蛋白重链(β-MHC)、ANP、BNP等表达量明显增多[9-10]。如果心肌肥厚由代偿期发展为失代偿期,可使心肌功能不足以维持正常功能,从而导致心力衰竭的发生。因此,探究心肌肥厚的发生发展机制对延缓心力衰竭的发生具有重要临床意义[10-11]。
心脏是人体对能量需求最高的器官之一,而线粒体是心肌细胞内ATP最主要的来源。近年来研究[12-13]已证实,线粒体功能障碍和心肌肥厚的发生发展密切相关,线粒体在能量代谢、氧化应激、钙稳态、基因突变等方面参与心肌肥厚的发生过程。值得注意的是,线粒体的动力学变化,如融合和分裂导致线粒体形态的变化,也参与了心脏应激和心肌细胞死亡的病理反应过程,已有研究[14]发现,线粒体融合蛋白1/2(mitofusin 1/2,Mfn1/2)、视神经萎缩蛋白(optic atrophy 1,OPA1)、动力相关蛋白1(dynamin-like protein 1,Drp1)和线粒体分裂蛋白1(mitochondrial fission 1,Fis1)等可能通过调控线粒体的融合和分裂进而参与心肌肥厚的发生过程。除此之外,线粒体在细胞内还存在运输和停泊等胞内运动,但其是否参与心肌肥厚的发生过程,目前还不清楚。
Armcx3属于Armcx基因家族成员,该家族成员只存在于进化程度较高的哺乳动物中,都由一个共同祖先Armc10基因进化而来。已有研究[15-16]发现,该家族蛋白在调节神经轴突线粒体的运输、促进神经元存活和轴突再生中都发挥了重要作用。López-Doménech等[6]和Serrat等[7]发现,Armcx3能够与线粒体外膜GTP酶蛋白Miro1、Miro2,以及Kinesin衔接蛋白Trak2等形成的KIF5/Miro/Trak2复合物相结合,干扰Armcx3表达,能够明显降低神经元轴突中运动线粒体的比率,表明Armcx3可能通过KIF5/Miro/Trak2复合物介导线粒体在神经元轴突中的运动。那么,Armcx3调节线粒体的运输和胞内分布是否也参与心肌肥厚的发生过程?本研究采用慢病毒构建过表达Armcx3与干扰Armcx3表达的H9C2心肌细胞模型,研究Armcx3在H9C2细胞肥厚中的作用。研究结果显示,与对照组相比,过表达Armcx3的H9C2心肌细胞的表面积明显减小,细胞肥厚标志物ANP和BNP的mRNA含量明显减少,BNP的蛋白表达量也明显减少;相反,与对照组相比,干扰Armcx3表达的H9C2细胞表面积明显增大,ANP和BNP的mRNA含量明显增加,BNP的蛋白表达量也明显增加。这一结果表明过表达Armcx3可以抑制H9C2细胞肥厚,而干扰Armcx3表达可以诱导H9C2细胞肥厚,但是Armcx3是怎样通过调节线粒体的运输和胞内分布进而调节细胞肥厚,其具体机制还有待进一步研究。
综上所述,本研究初步证实Armcx3能够调控H9C2细胞肥厚的发生过程,而进一步深入研究其分子机制将为心肌肥厚的机制研究和诊治提供新的思路。
