表达人源HPD基因对酿酒酵母孢子壁二酪氨酸层正确组装的干扰
2019-08-24王晓文殷政高晓冬中西秀树
王晓文,殷政,高晓冬,中西秀树
(江南大学 生物工程学院,江苏 无锡,214122)
人和酵母在10亿年前有共同的祖先,两物种间部分代谢及其调控途径是保守的[1]。在酿酒酵母(Saccharomycescerevisiae)中,人类蛋白质的过表达会扰乱酿酒酵母内在的生理机能,导致其表型发生变化,可被直接检测,这是以酿酒酵母为模式生物进行科学研究的关键所在[2]。在本实验室之前的研究中,根据二酪氨酸的自荧光,即可在紫外光下发出荧光的特性,建立了一种特殊的筛选方法,通过酿酒酵母的相对荧光强度筛选特异性抑制其产孢过程的人类基因[3-4]。通过筛选,得到了一个具有独特性质的基因,即4-羟苯丙酮酸二加氧酶(4-Hydroxyphenylpyruvate dioxygenase,HPD),Hpd蛋白是酪氨酸分解代谢途径中的关键酶[4],如图1所示。Hpd蛋白可以催化酪氨酸的代谢产物4-羟基苯丙酮酸(4-hydroxyphenylpyruvic acid,HPP)转变为尿黑酸(homogentisate,HGA)[5-6]。尿黑酸即2,5-二羟苯乙酸,通过氧化作用会转化为黑色的醌类物质[7]。
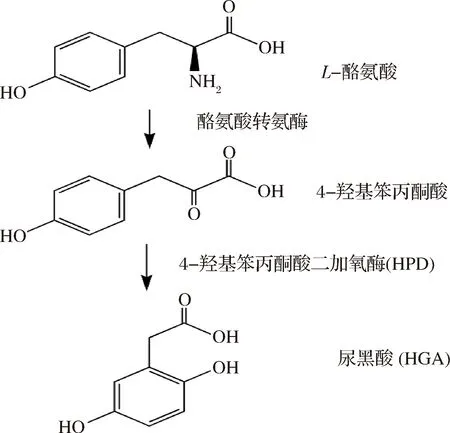
图1 L-酪氨酸的代谢途径
Fig.1 The metabolic pathways of L-tyrosine
酿酒酵母(Saccharomycescerevisiae)二倍体在氮源或发酵型碳源匮乏的条件下,会进行减数分裂并进入产孢过程,最终在二倍体细胞中形成4个单倍体孢子[8-9]。相比于营养细胞,酿酒酵母孢子可以有效抵抗外界的恶劣环境,该特性主要是由于孢子壁最外2层结构的保护作用,即壳聚糖层和二酪氨酸层。孢子壁结构由内到外依次合成,在壳聚糖层形成后,二酪氨酸层才开始合成。N,N’-二甲酰基-LL-二酪氨酸(N,N’-bisformyl-LL-dityrosine)为二酪氨酸层的主要组成成分,其形成过程分为2步:L-酪氨酸的N-甲酰基化以及N-甲酰基酪氨酸的二聚化[1]。这2个步骤分别由Dit1和Dit2两个蛋白调控完成[9]。随后,N,N’-二甲酰基-LL-二酪氨酸分子通过包括Dtr1在内的多个转运蛋白被运送到形成过程中的孢子壁上进行组装[5],但是目前这一组装过程的具体机制尚不清楚。本研究发现,筛选到的Hpd蛋白过表达时酿酒酵母产孢率不变,但自身荧光强度下降,这一现象表明Hpd蛋白的表达可能会干扰二酪氨酸层的组装。
因此,本文将已筛选得到的人类HPD基因导入酿酒酵母中,对其在生长状况、产孢率、荧光强度、乙醚敏感性、CFW染色及培养基颜色变化等方面的表型进行研究,分析人类HPD基因对酿酒酵母产孢过程及酵母孢子壁组装的影响,以此探究酵母孢子的形成机制。
1 材料与方法
1.1 菌株与生长条件
除了另外标注的技术外,本文所提到的基因操作均是按照参考文献[10]中描述的方法进行的。本文所用到的酵母菌株见表1, 质粒序列表2。

表1 本研究所用到的酿酒酵母菌株及其基因型

表2 本研究所用到的质粒
在克隆过程中,大肠杆菌在加入氨苄青霉素(100 μL/mL)的LB培养基(1%酵母提取物、2%蛋白胨、2%NaCl)中培养。酵母营养细胞是在YPAD(1%酵母提取物、2%蛋白胨、2%葡萄糖、0.033%腺嘌呤)或去除尿嘧啶的氨基酸混合物的营养缺陷型选择培养基SD-Ura(0.67%酵母基础氮源、2%葡萄糖、0.2%去除尿嘧啶的氨基酸缺陷粉末混合物)中培养。酵母产孢细胞是在YPACe培养基(1%酵母提取物、2%蛋白胨、2%乙酸钾)和KACe培养基(2%乙酸钾)中培养。
1.2 质粒
本文所用的质粒见表2。质粒的构建方法均是按照参考文献[3]操作的。
1.3 检测酿酒酵母产孢率
接种酿酒酵母单菌落到5 mL的SD-Ura液体培养基中,在30 ℃,220 r/min的条件下过夜培养;转接100 μL菌液到5 mL YPACe液体培养基中,在30 ℃ 220 r/min的条件下培养24 h;收集菌体,用ddH2O洗涤2次之后,转接到5 mL KACe产孢培养基中,在30 ℃ 220 r/min的条件下培养24 h使其产孢。随后,在血球计数板上取10 μL菌液点样,显微镜下观察细胞形态,统计酵母孢子和营养细胞的数量,计算酿酒酵母的产孢率。
1.4 检测营养细胞生长的情况
挑取酿酒酵母单菌落在SD-Ura固体平板上划线,于30 ℃培养24 h,观察营养细胞的生长情况。
1.5 检测酿酒酵母孢子在紫外光下的荧光强度
挑取酿酒酵母单克隆,在20 μL无菌水中重悬,点在SD-Ura固体培养基上, 30 ℃培养24 h。长出明显菌落后,将其影印到贴合了滤纸的新的SD-Ura固体培养基上,30 ℃培养16 h。待滤纸上长出明显酿酒酵母菌落后,用镊子将其移至KACe固体培养基上,30 ℃培养24 h。随后,在透明的塑料容器中滴上100 μL 10%的氨水,将含有酿酒酵母孢子的滤纸放入并使其浸润,在紫外光下用凝胶成像仪进行拍摄,用Image J软件处理图片从而测定酿酒酵母孢子的荧光强度。
1.6 酿酒酵母孢子乙醚敏感性的检测
产孢后,在显微镜下检测产孢率,离心收集酿酒酵母孢子,用ddH2O洗涤2次,加入适量无菌水稀释,在OD660下检测吸光度,稀释后的菌体浓度应控制在每毫升3×104个。在1.5 mL离心管中加入200 μL已调整好浓度的孢子,并加入100 μL ddH2O作为0 min的对照。另在1.5 mL离心管中加入200 μL孢子、100 μL乙醚,30 ℃静置,在0、20、40 min分别吸取50 μL孢子的混合液置于1.5 mL的离心管中,加入950 μL ddH2O,充分混匀,从中取100 μL的混合液均匀涂在YPAD固体平板上,30 ℃培养24 h。统计长出的菌落数量,计算乙醚处理后的孢子存活率。
1.7 荧光增白剂(calcofluor white,CFW)染色
CFW染色的方法见参考文献[14]。用NIS-Element AR荧光显微镜拍照的曝光时间固定为300 ms,然后用该显微镜进行图片处理并测定其荧光强度。
CFW染色步骤:离心收集细胞,用PBS洗2次后,将细胞重悬于200 μL 1×PBS溶液,再加入20 μL CFW溶液(质量浓度为1 mg/mL),混匀,30 ℃避光静置30 min,离心去上清,然后用1×PBS溶液洗2次,最后将细胞重悬于200 μL PBS溶液,进行显微镜下的观察与拍摄。
1.8 HPLC分析产孢培养基中的二酪氨酸
将二酪氨酸从含有二酪氨酸的生物大分子中释放出来的方法详见参考文献[15]。HCl处理可以水解复合的二酪氨酸并去除二酪氨酸的甲酰基,使其转化为更易被检测到的LL-二酪氨酸,因此将完成产孢后的产孢培养基离心取上清液200 μL至1.5 mL离心管中,加入200 μL 6 mol/L HCl,将混合液在95 ℃下敞口加热5 h。加入200 μL ddH2O重悬裂解粉末,充分溶解后,15 000 r/min离心10 min,然后通过0.45 μm微过滤器过滤,得到产孢培养基的二酪氨酸裂解液。
采用HPLC对二酪氨酸水解产物进行分析的方法详见参考文献[16]。HPLC采用Discovery C18柱(150 mm × 4.6 mm,5 μm),使用Waters分离模块e2475高效液相色谱系统。该方法所用流动相A为0.1%三氟乙酸,B为100%乙腈,流速为1 mL/min,注射体积为10 μL,检测的激发波为285 nm,发射波为425 nm。所用梯度程序如表3所示。
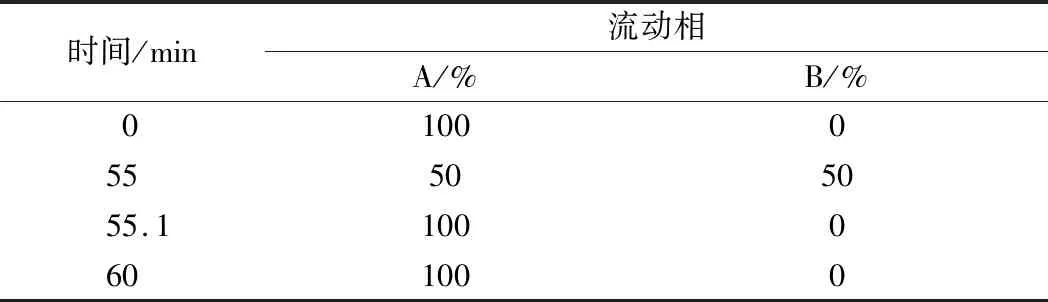
表3 HPLC的梯度程序
1.9 体外添加尿黑酸对孢子形成过程中表面氧化性检测
离心收集细胞,用无菌水洗涤2次,在OD660下检测吸光度,确保最终接入2 mL培养基的细胞浓度为每毫升3×107个。每个样品中加入50 μL的尿黑酸母液(200 mmol/L),30 ℃,220 r/min培养12 h,离心收集培养基,通过测量OD480,分析氧化性强弱。
1.10 统计学分析
至少3次独立试验,结果用平均值±标准偏差(SD)表示。
2 结果与分析
2.1 HPD基因的表达对酿酒酵母营养生长和产孢率没有明显的抑制作用
为了检测HPD基因表达对酿酒酵母营养生长的影响,将质粒pRS426-TEFpr-HPD转化入酿酒酵母AN120中,以表达空质粒pRS426-TEFpr的酿酒酵母AN120作为对照,挑取单菌落在SD-Ura固体平板上划线培养,24 h后观察菌株的生长情况,如图2-a所示。过表达HPD基因的酿酒酵母可以正常生长,与对照的生长情况基本一致,该结果说明HPD基因的表达对酿酒酵母营养细胞的生长没有明显的抑制作用。

a-在SD-Ura平板上培养24 h后的生长情况;b-产孢后的孢子形态;c-产孢率和完成减数分裂的百分比。其中,对照-过表达pRS426-TEFpr质粒的野生型(AN120);HPD-过表达pRS426-TEFpr-HPD质粒的野生型(AN120)
图2 表达HPD基因对酿酒酵母细胞生长和产孢率的影响
Fig.2 Influence on growth and sporulation rate after HPD genes expression in vegetative cells
为了检测HPD基因对酿酒酵母的产孢率的影响,将表达pRS426-TEFpr-HPD质粒的酿酒酵母接入液体培养基中进行产孢,以表达空质粒pRS426-TEFpr的酿酒酵母AN120作为对照。产孢后取部分菌液,观察孢子形态并且统计产孢率,结果如图2-b和图2-c所示,与野生型对照相比,过表达HPD基因的酿酒酵母的孢子形态以及产孢率均无明显差异,说明HPD基因的表达对酿酒酵母的产孢率没有明显的抑制作用。
2.2 HPD基因的表达影响二酪氨酸层的形成
前期筛选结果显示,过表达HPD基因的酿酒酵母与野生型相比,其孢子的荧光强度明显下降。为了验证这一结果,将过表达HPD基因的酿酒酵母孢子与过表达空质粒的野生型孢子在紫外光下的荧光强度进行对比,结果如图3-a显示,与野生型孢子相比,表达HPD基因的酿酒酵母孢子自身的荧光强度明显下降。而之前的研究结果显示,过表达HPD基因的酿酒酵母产孢率与野生型孢子的产孢率基本一致,说明该菌株减数分裂过程能够顺利完成,但其孢子壁上二酪氨酸层在形成过程中出现缺陷,从而导致该菌株产生的孢子自荧光强度下降。酿酒酵母孢子由于二酪氨酸层的保护作用能够表现出对乙醚以及CFW的抗性。
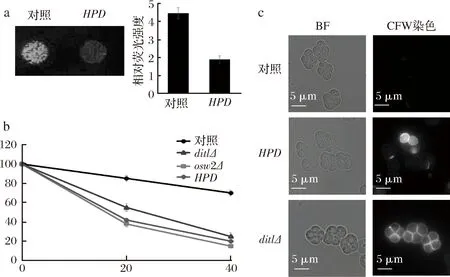
a-在紫外下的孢子荧光强度;b-乙醚敏感性的检测;c-CFW染色后在荧光显微镜下的染色。其中,对照-过表达pRS426-TEFpr质粒的野生型(AN120);HPD-过表达pRS426-TEFpr-HPD质粒的野生型(AN120)
图3 过表达HPD基因孢子的荧光强度、乙醚敏感性和CFW染色荧光检测
Fig.3 The fluorescence intensity /ether sensitive test and CFW staining of HPD expressed spores
为了确定HPD基因的表达是否会造成孢子壁上二酪氨酸层的缺陷,本研究用已知的具有二酪氨酸层缺陷酿酒酵母菌株dit1Δ突变株和osw2Δ突变株[17],作为阳性对照,用过表达空质粒的野生型孢子作为阴性对照,对过表达HPD基因的酿酒酵母孢子进行乙醚敏感性检测,结果如图3-b所示。与野生型酿酒酵母孢子相比,过表达HPD基因的孢子的乙醚敏感性显著上升,其敏感度介于dit1Δ突变株和osw2Δ突变株二者之间,表现出明显的二酪氨酸层缺陷。
为了进一步验证过表达HPD基因孢子壁中的二酪氨酸层组装是否正确,对过表达HPD基因的孢子进行了CFW染色试验。CFW染料可以与几丁质或壳聚糖结合,在荧光显微镜下可观察到几丁质或壳聚糖被染色,而孢子壁上完整的二酪氨酸层可以保护里层的壳聚糖被CFW染色[18]。酿酒酵母菌株dit1Δ突变株是已知的具有二酪氨酸层缺陷的酵母菌株,用其作为阳性对照,用过表达空质粒的野生型孢子作为阴性对照,结果如图3-c显示,过表达HPD基因的孢子壁CFW荧光明显比野生型孢子壁的CFW荧光更强,但比dit1Δ突变株的CFW荧光弱,表明其二酪氨酸层的确发生缺失。结合之前的试验结果,发现在酿酒酵母孢子中HPD基因的表达会造成二酪氨酸层在形成过程中发生缺陷,而并非完全缺失,因此,HPD基因的确会影响酿酒酵母孢子壁中二酪氨酸层的正确组装。
2.3 HPD基因的表达诱发孢子壁的二酪氨酸分泌到培养基中
为了研究过表达HPD基因的酿酒酵母孢子二酪氨酸层缺失的原理,本文检测了培养后的产孢培养基荧光强度。取过表达HPD基因的酿酒酵母孢子与过表达空质粒的野生型孢子的产孢培养基各500 μL,点在干净的滤纸上,在紫外光下检测滤纸的荧光强度,并使用Image J软件对二者的荧光图片进行定量分析,结果如图4-a和4-b所示。与野生型产孢培养基相比,过表达HPD基因的产孢培养基荧光强度明显上升。结合之前的研究结果,过表达HPD基因的酿酒酵母孢子二酪氨酸层缺失的机制可能是HPD基因的表达使孢子壁上二酪氨酸层的组装过程中发生缺陷,导致了参与二酪氨酸层组装的大量二酪氨酸复合物无法成功组装到二酪氨酸层上,从而泄漏到培养基中,使得其产孢培养基的荧光强度相对于野生型有所上升。该结果表明HPD基因的过表达可能影响二酪氨酸层的正确组装。
为了验证这一猜想,对过表达HPD基因的孢子培养基经过HCl处理之后的样品进行了HPLC的荧光检测,以合成的LL-二酪氨酸作为阳性对照,无二酪氨酸形成的dit1Δ孢子培养基的盐酸裂解液为阴性对照,结果如图4-c所示。经过HCl的处理,过表达HPD基因的酿酒酵母与野生型酿酒酵母的产孢培养基中都检测到了LL-二酪氨酸的存在,并且过表达HPD基因的产孢培养基中LL-二酪氨酸的信号峰>野生型孢子,如图4-c箭头所示。结果表明,经过6 mol/L HCl处理后,产孢培养基中出现了游离的LL-二酪氨酸。但是没有能检测到DL-二酪氨酸,由于LL-二酪氨酸是在组装到孢子壁上后部分转化为DL-二酪氨酸,说明这些二酪氨酸复合物并没有成功组装到二酪氨酸层中,而是直接泄漏到培养基中,该数据进一步证明了过表达HPD基因会导致LL-二酪氨酸泄漏至培养基中。
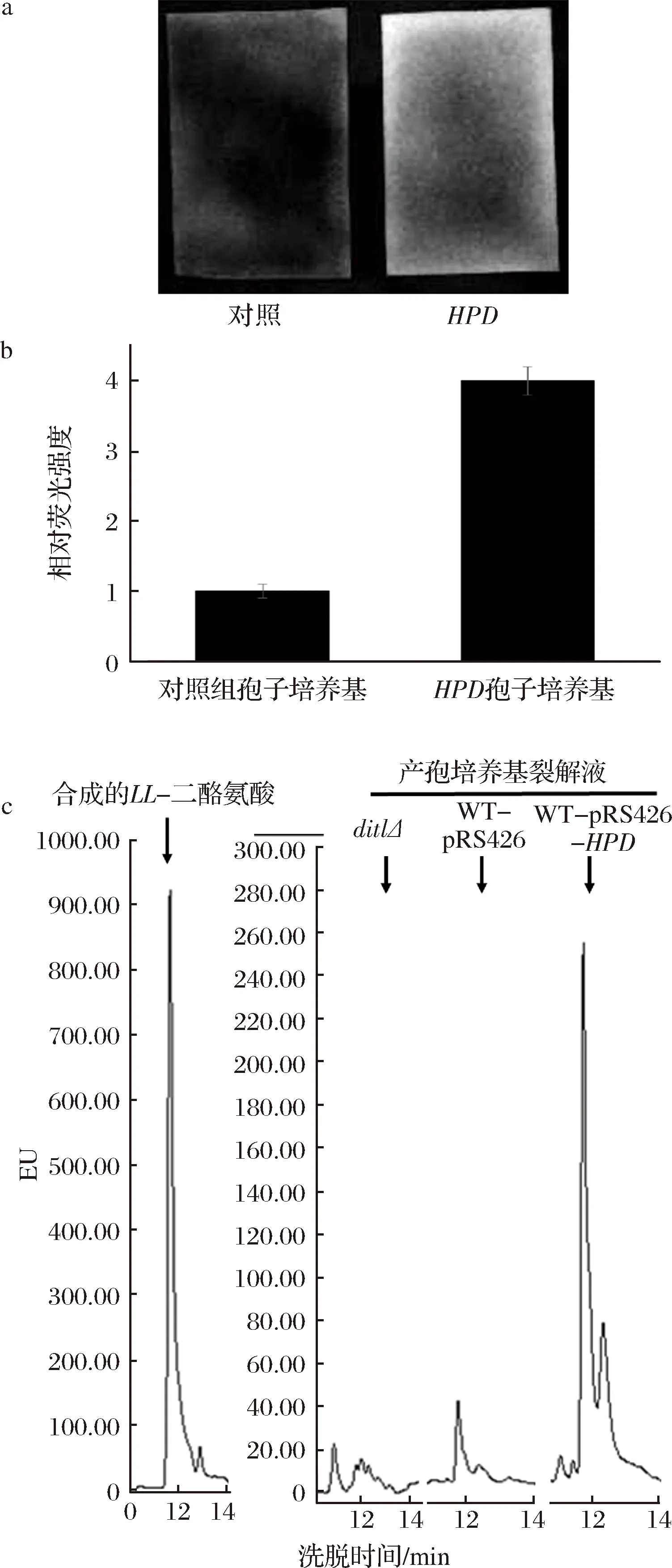
对照-过表达pRS426-TEFpr质粒的野生型(AN120);HPD-过表达pRS426-TEFpr-HPD质粒的野生型(AN120)
图4 HPD基因的表达对酿酒酵母产孢培养基荧光强度的影响
Fig.4 The effect of HPD expressed yeast on sporulating medium’s fluorescence intensity
2.4 HPD基因的表达检测出产孢过程中的氧化活性
使用过表达HPD基因的酿酒酵母进行液体产孢试验时发现,与野生型相比,在经过KACe产孢培养基培养之后,过表达HPD基因的酿酒酵母的KACe培养基的颜色转变明显,由无色透明转变为浅褐色,而野生型的产孢培养基则始终为无色透明液体,如图5中4~5所示。此外,在SD-Ura液体培养基中将过表达HPD基因的酿酒酵母和过表达空质粒的野生型酿酒酵母培养与产孢过程相同的时间,同时,将HPD基因转入无法产孢的单倍体酵母AN117-4B中,并在相同条件下使用KACe培养基培养相同时间,结果如图5中1~3所示。在营养生长时,无论HPD基因是否表达,酿酒酵母培养基颜色都不会发生变化,如图5中1~2,并且如果不是在产孢过程中,其培养基的颜色也不会出现变化,如图5中3所示。

图5 人类基因HPD的表达对酿酒酵母培养基颜色变化的影响
Fig.5 The effect of HPD expression on yeast mediums’ color change
该研究结果表明,这种培养基的颜色变化只出现在过表达HPD基因酿酒酵母的产孢过程中,出现这一颜色变化的原因可能是产孢过程中发生了特异性的氧化过程,可以使酿酒酵母中Hpd蛋白的催化产物尿黑酸氧化变色,从而使表达HPD基因的产孢培养基变色。
为了验证孢子形成过程中其表面是否具有氧化性,利用尿黑酸被氧化后颜色会发生变化的特性,分别将单倍体营养细胞、二倍体营养细胞接入SD液体培养基中,将在YPACe中培养24 h即将进入产孢过程的营养细胞、已经完成产孢过程的酿酒酵母孢子接入产孢培养基中,使用不含细胞的SD液体培养基和产孢培养基作为对照,加入50 μL的尿黑酸母液培养12 h后,离心收集培养基,测量OD480值,分析氧化性强弱,结果如图6所示。结果显示,产孢过程中的酿酒酵母具有最强的氧化能力,其次是已经完成产孢过程的酿酒酵母孢子,无论是产孢过程中还是产孢结束后其氧化能力都远高于营养细胞。
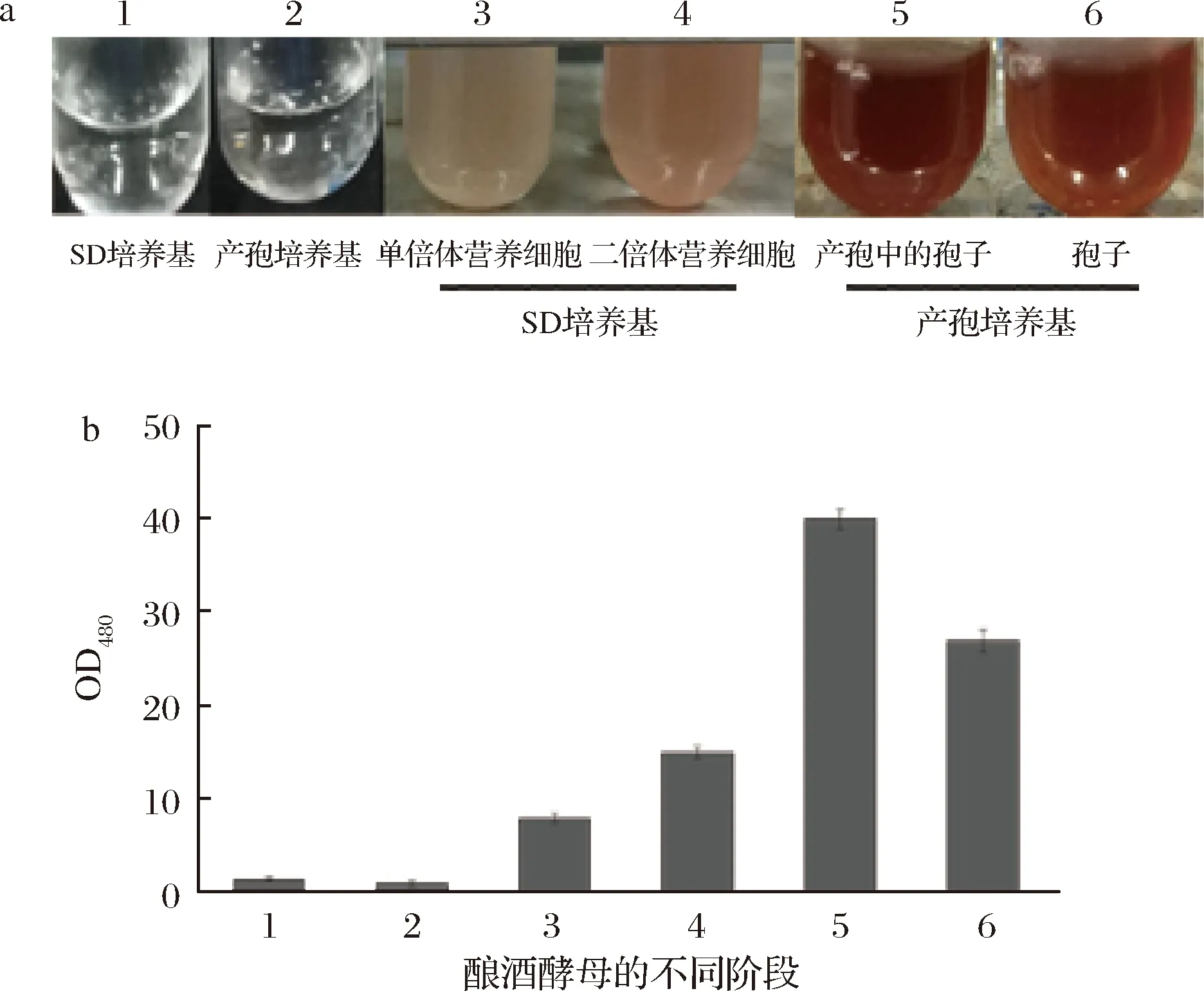
图6 酿酒酵母不同阶段氧化性分析
Fig.6 Analysis oxidation ability of yeast at different stages
3 结论
在酿酒酵母孢子内,L-酪氨酸可以经过Dit1和Dit2蛋白的催化转变为N,N-二甲酰基-LL-二酪氨酸,并由Dtr1等运输蛋白将其转运到孢子壁表面进行二酪氨酸层的组装[20],其过程如图7所示,但是二酪氨酸如何组装到壳聚糖层表面并且其单体之间如何连接形成完整的二酪氨酸聚合物的机制尚不清楚。

图7 二酪氨酸层的形成过程以及尿黑酸对其影响
Fig.7 Schematic diagram of dityrosine layer assembly process and effection of homogentisate
相较于营养细胞,酿酒酵母孢子的氧化性明显上升并且该氧化性极可能与二酪氨酸层的形成过程有关。研究结果显示,在孢子形成过程中,氧化能力提高,N,N-二甲酰基-LL-二酪氨酸的羟基被氧化,使二酪氨酸之间形成交联键从而相互连接,形成的二酪氨酸聚合物也以交联键的形式与壳聚糖层连接,完成孢子壁的完整组装,如图7红色方框所示。Hpd蛋白的催化产物尿黑酸的结构与酪氨酸相似,在尿黑酸氧化变色后可能参与到二酪氨酸的聚合过程,通过交联键与二酪氨酸连接,如图7黑色方框所示,造成二酪氨酸层无法进行准确组装,最终导致孢子壁上出现缺陷。
本文研究结果表明,表达HPD基因的酿酒酵母孢子其自身荧光强度减弱,对乙醚敏感性和CFW染色的荧光强度均明显上升,并且产孢培养基中检测到二酪氨酸含量提高。其原因可能是Hpd蛋白的催化产物尿黑酸与二酪氨酸的结构相似,使其参与到二酪氨酸层的组装过程,导致二酪氨酸层无法正确组装,并且参与组装的N,N-二甲酰基-LL-二酪氨酸泄漏至产孢培养基。此外,研究发现产孢过程中孢子表面氧化性提高,可能与N,N-二甲酰基-LL-二酪氨酸与壳聚糖层的连接以及N,N-二甲酰基-LL-二酪氨酸之间交联结合有关,这一发现揭示了二酪氨酸层的形成机制,为后续二酪氨酸层的研究提供了新的思路。
