分化型甲状腺癌术后131I清甲治疗前血清促甲状腺激素水平最佳区间的确定
2019-08-24李雪蓉肖雄张晶晶卜丽红
李雪蓉 肖雄, 张晶晶 卜丽红
1武汉大学人民医院PET中心暨分子影像中心(武汉 430060);2新疆医科大学附属肿瘤医院核医学科(乌鲁木齐830011)
甲状腺癌发病率呈逐年升高的趋势,其中以分化型甲状腺癌(differentiated thyroid carcinoma,DTC)为主要类型[1]。现在国际公认DTC治疗方案一般包括三步:“手术+131I清除潜在的甲状腺残余灶(清甲)+TSH抑制疗法”[2]。其中131I清甲前患者血清TSH水平是影响131I清甲治疗疗效的关键因素之一。文献指出[3]:对于术后符合131I清甲治疗标准者,应确保131I清甲治疗前血清TSH水平>30 mIU/L。现国内多采用DTC术后停服左旋甲状腺素(L-T4)4-6周达到负反馈来升高血清TSH水平的方法。但有研究[2,4]指出过高水平的血清TSH状态或停用L-T4会给患者带来明显的不良反应,如甲减、血脂代谢紊乱以及引发心血管损害。本研究的目的就是探讨DTC术后131I清甲治疗前血清TSH水平最佳区间,并探究血清TSH水平与心肌酶谱异常及相关肌肉症状之间的关联性,进而在保证131I清甲治疗疗效的同时,避免因过度停药给患者带来的不利影响。
1 资料与方法
1.1 一般资料随机选取并回顾性分析2015年6月至2017年7月期间,于核医学科行DTC术后131I清甲治疗的患者160名,其中男20例,女140例;年龄17~75岁,平均(45.1±11.3)岁。按照术后病理类型:乳头状癌135例,滤泡状癌患者25例。
1.2 纳入标准和排除标准纳入标准:(1)入组患者均已行甲状腺全切、次全切或局部切除,根据术后病理确定为DTC,并符合DTC术后131I治疗标准(根据2015版ATA指南确定)[4];(2)患者既往无肌肉病变及异常心肌酶谱增高的病史;(3)停服L-T4 4-6周,131I治疗前2周严格低碘饮食。排除标准:(1)131I治疗禁忌症(WBC <3.0×109/L;严重的肝肾功能受损;妊娠或哺乳期患者;甲状腺手术后伤口创面为完全愈合者);(2)131I清甲治疗预备期间误服或者停用L-T4者,未能坚持停服L-T4 4周者;(3)有心脏疾病患者及继往有甲状腺功能减退的病史患者;(4)有垂体手术史或有垂体病变的患者。
1.3 研究方法
1.3.1 基本资料收集记录入组患者的详细资料,包括:性别、年龄、甲状腺癌手术的方式、有无淋巴结及远处转移、手术距131I治疗时间的长短、血清TSH水平、血清Tg水平等基本资料,并监测患者血清FT3、血清FT4、心肌酶谱等生化指标。
1.3.2 患者准备停服L-T4 4~6周,忌碘2~4周。
1.3.3 参数检测及测量所有患者于停服L-T4 4~6周后抽取晨起空腹静脉血,用于检测甲状腺功能五项(FT3、FT4,TSH,Tg,TgAb)和心肌酶谱(肌酸激酶,CK;肌酸激酶同工酶,CK-MB)。测定方法:采集患者血液5 mL,以4 000 r/min离心10 min,离心半径12.4 cm,分离血清,采用化学速率法测定甲状腺功能;采用化学速率法测定CK水平,参考范围:5~270 IU/L,测定CK-MB水平,参考范围:0~ 25 IU/L。检测仪器及试剂盒均由罗氏诊断产品有限公司提供。另常规检查血常规、肝肾功能、心电图、胸片等。
另在131I清甲治疗前,填取患者视觉模拟评分(visual analogue score,VAS)疼痛评分表。该法比较灵敏,有可比性。
1.3.4 131I清甲治疗均采用较大剂量131I进行清甲治疗:空腹一次性口服131I 3.7 GBq(100 mCi),服用131I后嘱患者多饮水,多排尿,以减轻131I对腹腔和盆腔的照射。口服维生素C或多酸性食物,以促进唾液分泌、减轻涎腺损伤。为减轻局部症状,131I清甲治疗前1天开始常规给予强的松10 mg Tid,口服1周左右。131I治疗3~5 d后,给予常规剂量L-T4进行替代治疗,直至血清TSH升至正常低值水平。
1.3.5 清甲疗效判定标准复查时间及病人准备:131I清甲治疗后6个月复查以确定131I清甲治疗疗效。复查前要求患者低碘饮食(饮食碘<50 μg/d)及停服L-T4 4~6周,以确保达到131I-WBS复诊要求。
复查项目包括:甲状腺吸131I率测定;采用SIEMENS Simbia-T双探头单光子发射断层成像(SPECT/CT)行131I-WBS;TSH抑制状态下颈部超声;血清Tg、TgAb检测。
判定标准:甲状腺床吸131I率<1%提示131I清甲治疗成功;超声未见甲状腺癌组织残留及淋巴结转移提示131I清甲治疗成功;超声诊断甲状腺床无复发转移的声像图特征[5]。Tg检测诊断标准:在TSH抑制状态下Tg≥0.2 ng/mL为阳性,<0.2 ng/mL为阴性[5]。TgAb ≥ 50 IU/mL为阳性,TgAb<50 IU/mL为阴性[6]。
血清Tg检测结果阴性,超声检查阴性及131IWBS甲状腺组织未见显影者可视为一次131I清甲治疗成功。任何一项阳性均视为131I清甲治疗失败。
1.4 统计学方法所有数据采用excel表格进行汇总,采用IBM SPSS 21.0统计软件进行统计学操作,基本资料单因素分析符合正态分布方差齐的计量资料采用t检验;计数资料分析采用χ2检验;多因素分析采用Binary Logistic回归分析,通过绘制TSH区间预测CK升高的受试者工作曲线(ROC),统计结果以双侧P<0.05表示差异具有统计学意义。
2 结果
2.1 单因素分析131I清甲治疗前血清TSH水平、手术方式为影响清甲疗效的重要因素(表1)。以131I清甲成功与否分组,以131I清甲治疗前血清TSH水平、手术方式为变量,131I清甲成功组与失败组之间有统计学差异(P<0.05)。患者性别、年龄、DTC手术距131I治疗间隔时间的长短(本研究间隔时间均为3~6个月)、DTC有无转移,对131I清甲疗效均无明显影响(P>0.05):以131I清甲治疗成功与否分组,以患者性别、年龄、间隔时间、转移与否为变量,131I清甲治疗成功组与失败组之间差异无统计学意义(P>0.05)。

表1 患者一般临床资料Tab.1 General clinical data of patients例(%)
2.2 Logestic回归多因素分析结果以患者131I清甲治疗前血清TSH水平(赋值:<30=1,30~60=2,≥ 60=3),手术方式(赋值:全切术=1,次全切=2,局部切除=3)为自变量,以清甲成功与否(赋值:成功=1,失败=2)为因变量进行logistic回归分析,治疗前血清TSH水平与手术方式均为影响患者清甲的重要影响因素(P<0.05,表2)。
2.3 通过对单因素分析,治疗前TSH位于30~60mIU/L之间患者清甲有效率为60%。治疗前TSH>60 mIU/L患者清甲有效率为60.6%,与TSH在30~60 mIU/L时,清甲成功率未见明显升高(χ2=0.001)。对131I清甲治疗前血清TSH在30~60mIU/L组(TSH1)患者(40例),以及131I清甲治疗前血清TSH>60mIU/L组(TSH2)患者(76例)的心肌酶谱指标及VAS评分是否存在差异进行分析。结果显示,TSH1与TSH2组之间心肌酶谱指标差异有统计学意义(P<0.05)(表3),表明在TSH > 30 mU/L的情况下,治疗前TSH水平越高,心肌酶谱值越高,患者甲减程度越严重。通过以CK=270Ul为临界值对患者血清TSH水平进行预测发现:TSH水平55.5 mIU/L为最佳临界值点,ROC曲线下面积为0.742(95%CI:0.652~ 0.832)表明治疗前TSH水平55.5 mIU/L可有效避免患者肌肉酸痛等停药副作用(图1)。

表2 131I清甲疗效影响因素的logistics回归分析Tab.2 Logistic regression analysis of factors influencing the efficacy of 131I Radioiodine ablation
表3 不同血清TSH水平分组生化指标比较Tab.3 Comparison of biochemical indicators of different serum TSH levels±s
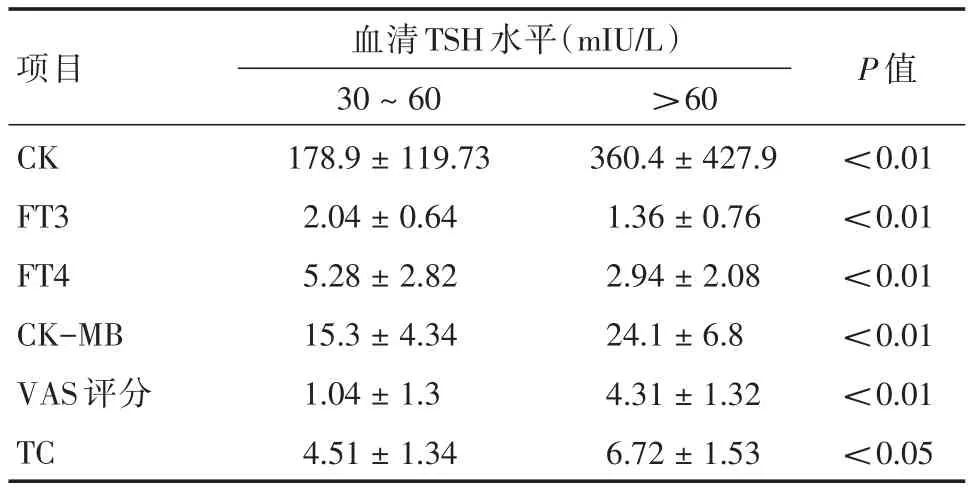
表3 不同血清TSH水平分组生化指标比较Tab.3 Comparison of biochemical indicators of different serum TSH levels±s
项目CK FT3 FT4 CK-MB VAS评分TC血清TSH水平(mIU/L)30~60 178.9±119.73 2.04±0.64 5.28±2.82 15.3±4.34 1.04±1.3 4.51±1.34>60 360.4±427.9 1.36±0.76 2.94±2.08 24.1±6.8 4.31±1.32 6.72±1.53 P值<0.01<0.01<0.01<0.01<0.01<0.05
3 讨论
本研究对治疗前血清TSH水平及其他可能影响131I清甲效果的因素进行单因素及logistics回归分析。结果显示:以131I清甲成功与否分组,以131I清甲治疗前血清TSH水平为变量,131I清甲成功组与失败组之间差异有统计学意义(P=0.032),表明DTC患者清甲前血清TSH水平达到30 mIU/L,可以确保清甲的成功率,与其他文献报道相符[7]。

图1 停药状态下血清TSH水平预测心肌酶水平升高的受试者工作(ROC)曲线Fig.1 ROC curves of for predicting elevated levels of myocardial enzymes in serum TSH levels at withdrawal
另通过对血清TSH水平处于30~60 mIU/L与>60 mIU/L两个区间段131I清甲成功率进行比较(表1),发现患者血清TSH水平达到30 mIU/L后,清甲成功率并没有随着TSH水平继续升高而增加。TSH水平处于30~60 mIU/L与>60 mU/L(60~100 mIU/L)两个区间段患者131I清甲成功率没有统计学差异。笔者进一步将TSH水平处于30~60 mIU/L与>60 mIU/L两个区间段的复查生化指标进行比较,发现两组心肌酶谱及肌肉疼痛VAS评分存在显著差异,并且该差异具有统计学意义(P=0.001)。以上实验数据表明:停用L-T4后随着血清TSH水平升高,患者甲状腺功能减退症状越来越重,机体出现低代谢综合症机率也随之增加,尤其以心肌酶谱异常及肌肉酸痛的症状为主。
本研究进一步分析发现相比血清TSH水平>60 mIU/L患者,当血清TSH水平界于30 mIU/L~60 mIU/L区间患者在不影响清甲效果的同时,能有效降低患者肌酸激酶水平,并能降低患者疼痛VAS评分的分值。并且当血清TSH水平55.5 mIU/L为最佳临界值点时,ROC曲线下面积为0.742(95%CI:0.652~ 0.832),表面血清TSH水平在55.5 mIU/L时,既能满足131I清甲前准备最佳要求,也能降低患者肌酸激酶出现异常升高的机率。本研究中,在我们将TSH水平处于30~60 mIU/L与>60 mIU/L两个区间段的复查生化指标进行比较研究时,除发现两组心肌酶谱及肌肉疼痛VAS评分存在显著差异之外,笔者同时发现血脂存在显著差异,与其他研究结果基本一致[8]。值得注意的是:心肌酶谱作为反映心肌病变特异指标,应与甲减引起心肌酶谱的改变进行鉴别,对于随访期间心肌酶谱升高特别是CK升高并伴有心脏不适或有心脏疾患风险的患者,应该通过心电图、心动超声等进行监测与鉴别[9]。
本研究结果显示:DTC患者术后131I清甲治疗前血清TSH最佳水平区间是30~60 mIU/L;最佳临界值点是TSH水平55.5 mIU/L。131I清甲治疗前血清TSH在最佳水平区间时,既能最佳满足131I清甲治疗前准备要求,也能降低患者肌酸激酶出现异常升高的机率。该研究结果可为临床带来参考意义,尤其是为将来制定131I清甲治疗前个体化管理方案提供依据。但有很多临床因素如年龄、性别以及手术方式等会影响131I清甲治疗前血清TSH水平进而影响预后[10-11]。所以如何制定131I清甲治疗前停服L-T4时间管理方案以确保血清TSH在最佳水平区间目前尚无定论,需开展更多相关研究进行证实。
