喉鳞状细胞癌淋巴结转移相关miRNAs差异表达谱分析
2019-08-24许咪咪卢仲明张思毅詹建东盛晓丽邓敏鑫
许咪咪 卢仲明 张思毅 詹建东 盛晓丽 邓敏鑫
1南方医科大学第二临床医学院(广州 510280);2广东省医学科学院,广东省人民医院耳鼻咽喉头颈外科(广州510080)
目前,头颈癌已经是全世界第六大高发癌症,根据统计,全世界每年约有645 000例新发生的头颈癌病例[1],其中超过90%头颈癌为鳞状细胞癌。喉癌作为第二位常见头颈癌,大多是鳞状细胞癌。颈淋巴结转移是影响头颈癌包括喉癌患者预后最重要的因素,有淋巴结转移者生存率降低50%[2-3]。因此,术前颈淋巴结转移的评估尤为重要。
miRNA是一类细胞内源性表达的、由22个单核苷酸组成的、单链小分子非编码RNA,其主要功能为通过降解靶基因mRNA,从而进行转录后调控相关基因的表达[4]。miRNA在某些疾病中的异常表达,因此miRNA可以作为部分疾病早期诊断的潜在标记物。同时,miRNA及其靶基因也可以作为特定疾病治疗的疗效评价预测指标及潜在药物靶点。越来越多的研究表明,miRNA与喉癌的发生、发展相关[5-12],但绝大多数研究都集中在miRNA的表达失调与喉癌发生之间的关联,至今未见与喉癌淋巴结转移相关的miRNA表达谱相关的报道。
本研究运用miRNA芯片技术,通过检测分析喉鳞状细胞癌(又称喉鳞癌、喉癌)组织中miRNA的表达特点,寻找有淋巴结转移的喉鳞癌肿瘤组织和无淋巴结转移者差异表达的miRNA,探讨其与喉癌侵袭、转移的关系,为后续寻找与喉癌早期诊断及转移相关的潜在的分子标志物打下初步基础,为提高喉癌生存率及保喉率,最终改善喉癌的治疗效果,提供初步的理论依据。
1 材料与方法
1.1 组织来源miRNA芯片入组患者:选择5例淋巴结转移的原发性喉鳞癌组织,为淋巴结转移组,5例无淋巴结转移的喉鳞癌组织,为无转移组,将两组患者的肿瘤组织进行miRNA基因芯片分析并筛选。入组患者的临床资料见表1。
qRT-PCR入组患者:选择40例原发性喉鳞癌组织,20例有淋巴结转移,20例无淋巴结转移,进行qRT-PCR验证(表2)。
1.2 标本的收集、保存采用标本库里冻存的喉鳞癌肿瘤组织,所有标本均来自广东省人民医院耳鼻咽喉头颈外科2007年10月至2018年7月手术切除的喉癌组织,术中均取病理组织证实喉癌。本次实验入组所有患者均为就诊于广东省人民医院耳鼻咽喉头颈外科并进行手术者,术前或者术中取病理确诊喉鳞状细胞癌,所有病例均为初治患者,术前未接受过放、化疗及其他肿瘤的特殊治疗。所有病例均进行详细的临床病理资料分析及随访。在参加本项实验之前所有参与患者均签署了书面知情同意术。本次实验样本的收集及使用通过了广东省人民医院伦理委员会批准。
1.3 喉癌组织miRNA表达谱分析本实验采用第六代miRCURYTMLNA寡核苷酸芯片(丹麦Exiqon公司),超过1 891个探针。
1.4 总RNA提取及质量检测应用Trizol(Invitrogen公司)和miRNeasy mini kit试剂盒(Qiagen公司)抽提总RNA,使用分光光度计ND-1000(Nanodrop公司)测定RNA的质量和定量,凝胶电泳判定RNA的完整性。
1.5 miRNA的标记与芯片杂交采用miRCURYTM Array Power标记试剂盒,按照试剂盒说明操作,进行miRNA的标记。荧光标记后的样品,按说明书进行芯片杂交。
1.6 芯片扫描及数据处理采用Axon Gene Pix 4000B进行扫描,扫描得到的图像用Gene Pix pro V6.0进行数据收集和坐标调整,数据差异显著性分析采用芯片显著性分析软件(significance analysis of microarrays,SAM)进行完成,设定错误发现率(false discovery rate,FDR)为 0.05;再采用 MEV software(v4.6,TIGR)对筛选出的miRNA进行聚类分析。根据表达水平定义高表达和低表达的miRNAs,筛选出在喉癌淋巴结转移中表达差异的miRNAs。
1.7 实时荧光定量PCR(qRT-PCR)验证另取40对喉癌组织标本(20例伴淋巴结转移,20例无淋巴结转移),提取总RNA。以U6为内参照,采用SYBR Green染料法,对芯片分析结果中的5个miRNA:miR-125a-5p、miR-144-3p、miR-193a-3p、miR-24-3p、miR-203在各样品中的表达量进行qRT-PCR验证。
1.8 统计学方法MicroRNA基因芯片实验结果采用SAM软件进行分析,设定FDR为0.05,筛选出有淋巴结转移组和无转移组之间差异表达的miRNA。用SPSS 19.0软件分析,两组间比较使用独立样本t检验。数据以均数±标准差表示,以P<0.05为差异有统计学意义。
2 结果
2.1 标本RNA纯度及质量检测使用分光光度计ND-1000测定各标本RNA的OD值,OD260/OD280比值为1.9~2.1。凝胶电泳条带分析未见明显RNA降解及DNA污染等(图1)。结果表明样品总RNA未降解、质量可靠,可用于后续实验。

图1 用于芯片实验的标本RNA凝胶电泳图像Fig.1 Gel electrophoresis image of the samples RNA
2.2 miRNA芯片扫描结果笔者通过miRNA芯片筛查得到了2 662个差异表达的miRNA,将其中无法检测到的miRNA及非人类miRNA剔除后,得到780个miRNA。采用SAM软件分析,设定FDR为0.05,发现相对无淋巴结转移组,有淋巴结转移的喉癌组织中共有387个miRNA表达显著下调,22个miRNA表达显著上调。见图2、3。

图2 喉鳞状细胞癌miRNA微阵列芯片热点图Fig.2 Heatmap ofmiRNA microarray in laryngeal squamous cell carcinoma
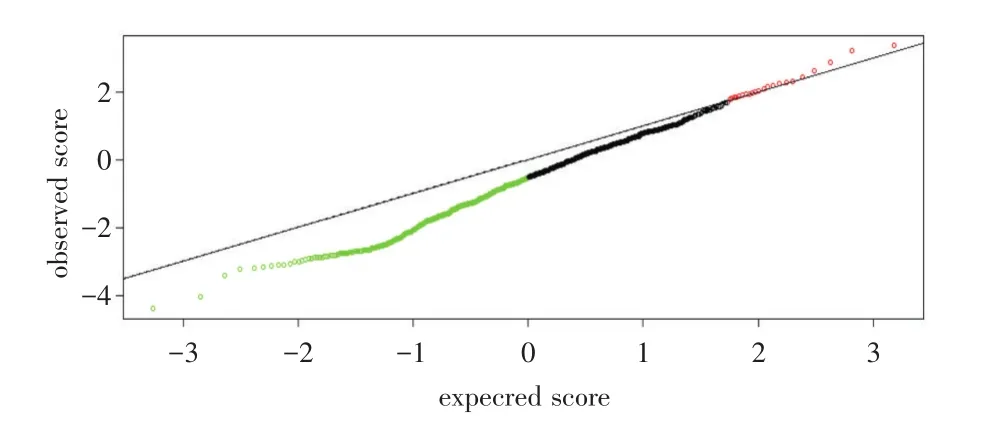
图3 通过SAM软件分析获得的显著差异的miRNA基因Fig.3 Siginificant miRNA genes identified using SAM software
2.3 qRT-PCR验证结果对miR-125a-5p、miR-144-3p、miR-193a-3p、miR-24-3p、miR-203等 5个miRNA进行qRT-PCR验证,miR-125a-5p、miR-144-3p、miR-193a-3p、miR-24-3p、miR-203在40例有淋巴结转移组和无转移组喉鳞状细胞癌组织之间的表达差异均有统计学意义(P<0.05)。将基因芯片分析结果与qRT-PCR结果进一步进行比较,结果显示这5个miRNA表达均下调,miRNA基因芯片分析结果与qRT-PCR的相符,见图4。

图4 转移组及无转移组miRNA的qRT-PCRFig.4 qRT-PCR of the lymphatic metastasis group and the control group
3 讨论
影响喉癌的预后因素很多,其中颈淋巴结转移为一重要因素,有淋巴结转移的喉癌预后较差,因此对有淋巴结转移的病例,学者们均持积极态度,主张行治疗性颈清扫术[13]。以往虽然有大量关于喉癌远处转移的研究,但仍未发现任何一个指标能够特异性的早期预测喉癌的转移。所以,找出一种可以早期预测喉癌转移的分子标志物,有助于个体化选择治疗方案。
miRNA是一类细胞内源性表达的、由22个单核苷酸组成的、单链小分子非编码RNA,其主要功能为通过降解靶基因mRNA,从而进行转录后调控相关基因的表达[4]。有研究显示,超过半数的miRNA基因位于肿瘤相关的脆性位点或基因组区[14]。miRNAs还可作用于细胞周期以及影响细胞的凋亡、血管生成、转移影响肿瘤的发生发展等过程[15-16]。自从1993年发现miRNA以来,其与肿瘤就存在着密切关联,目前miRNA已在肿瘤的发生、诊断和治疗等领域中取得一系列的研究进展。但是,就目前喉癌的相关研究而言,尚未发现兼具早期敏感性和组织特异性的miRNA。
本课题组前期通过miRNA芯片技术探测到了喉癌组织中的miRNAs表达情况,结果显示:与癌旁组织相比,在喉癌组织中11种miRNAs表达显著上调,表达显著下调的miRNAs有114个,并且发现了 miRNA-125a-5p、miRNA-144-3p、miRNA-203、let-7f-5p、miRNA-10a-5p、miRNA-195-5p等6个miRNA在基因芯片分析及qRT-PCR中表达均显著下调[8,17-18]。王蕊等[9]对4对喉癌肿瘤组织及癌旁组织行miRNA芯片技术分析发现,22种miRNAs在喉癌组织中的表达显著上调,20种表达显著下调,并发现miR-3195表达显著下调,差异具有统计学意义。魏明辉等[12]发现喉鳞癌肿瘤组织和癌旁组织中有53个差异表达的miRNAs,其中31个下调,22个上调。已有研究发现在有淋巴结转移的结肠癌[19-20]、食道癌[21]中miRNA异常表达,可能与肿瘤的转移相关。近年来越来越多对喉癌及癌旁组织miRNAs差异表达谱的分析,但是喉癌淋巴结转移相关miRNAs差异表达谱尚未见相关报道。
本研究在前期工作的基础上,选取10例喉鳞状细胞癌新鲜冻存的肿瘤组织(5例有淋巴结转移,5例无淋巴结转移),采用miRNAs表达谱芯片通过聚类分析,发现了22个在有淋巴结转移的癌组织中表达上调的miRNA和387个表达下调。本研究通过SAM软件初筛,根据检测样本≥3,q-value≤5%,差异倍数>2为显著上调,差异倍数<0.5为显著下调,在差异表达的miRNAs中发现差异倍数在2倍以上的仅有5个,且表达均下调,分别miR-125a-5p、miR-144-3p、miR-193a-3p、miR-24-3p、miR-203。其中miR-125a-5p、miR-144-3p、miR-203在本团队的前期的研究工作中已经发现其在肿瘤组织及癌旁组织中差异表达并验证。本研究对5个miRNAs进行qRT-PCR验证,这样可以延续笔者过往的研究,以期对将来的研究奠定基础。
通过qRT-PCR验证,miR-125a-5p、miR-144-3p、miR-193a-3p、miR-24-3p、miR-203在有淋巴结转移的肿瘤组织中表达均显著下调,这与基因芯片分析结果一致,说明本研究的基因芯片分析结果是准确可靠的。证明了有淋巴结转移的喉癌组织与无淋巴结转移者相比存在差异表达的miRNAs,结果提示这些差异表达的miRNAs可能在喉癌的侵袭转移中起到重要作用。
miR-144-3p已在本团队的前期研究工作中被证实可以通过靶向ETS-1调控喉癌细胞侵袭转移[22],并初步发现其可以抑制喉癌细胞的增殖[23]。这提示有无淋巴结转移的喉癌组织中差异表达的miRNAs可能与喉癌的侵袭转移相关。这为笔者后续研究miR-125a对喉癌细胞的侵袭转移方面的作用提供初步的依据。
然而,基因芯片分析及qRT-PCR验证的miRNAs是否真正参与喉癌的发省发展、侵袭转移,需要将来在细胞功能实验及大规模的临床标本中进行进一步验证。
