脊柱转移性肿瘤的手术疗效及生存危险因素分析
2019-08-23胡越皓沈宇辉张伟滨万荣
胡越皓 沈宇辉 张伟滨 万荣
脊柱肿瘤是临床中相对少见的一类肿瘤,包括原发性脊柱肿瘤和转移性脊柱肿瘤,其中脊柱转移性肿瘤约占脊柱肿瘤的97%[1]。2/3的恶性肿瘤存在肿瘤转移的发生,约40%~60%的肿瘤发生脊柱转移[2,3]。而常见的脊柱转移肿瘤为肺癌、乳腺癌、前列腺癌、肾癌、消化道腺癌等[4,5]。
脊柱转移肿瘤的最大风险在于肿瘤本身及肿瘤破坏椎体后形成脊髓压迫,约10%~20%进展为脊髓压迫[6],而脊髓压迫常造成骨相关事件的发生,包括腰背疼痛、病理性骨折、脊柱不稳定、高钙血症的症状[7]。然而,脊柱转移瘤处于肿瘤晚期,预期生存时间短、基础病情复杂、手术并发症多,因此,对于外科手术治疗脊柱转移性肿瘤仍有争议[8]。随着肿瘤内科治疗水平的发展,外科手术技术的革新,对脊柱肿瘤的外科手术治疗可以在一定程度上延长生存时间,同时减轻疼痛症状,保留完整的神经功能,改善生活质量[9]。
本研究对45例接受脊柱转移肿瘤手术的病例资料进行回顾性分析,探讨外科手术术前评估及脊柱手术治疗对疼痛症状及神经功能的改善作用;同时,分析脊柱转移瘤的生存率及其相关危险因素,为临床上手术治疗脊柱肿瘤提供一定的参考。
资料与方法
一、纳入与排除标准
纳入标准:①原发肿瘤病理诊断明确;②于我院接受外科脊柱转移瘤手术;③有完整的术前病史资料及术后随访资料;④最终病理明确为转移性肿瘤。
排除标准:①合并两种及以上的恶性肿瘤;②原发肿瘤诊断不明确;③缺少完整的病史资料及术后失访者。
二、一般资料
收集2010年6月至2018年12月在我院骨科住院接受外科手术治疗的脊柱转移肿瘤病人45例纳入研究,其中,男23例,女22例,男女比为1.05∶1;年龄为38~85岁,平均年龄为65岁。收集病人的以下指标:性别,年龄,身体质量指数(body mass index,BMI),美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体力状况评分,肿瘤等级,是否合并病理性骨折,原发肿瘤是否进行了手术治疗,肿瘤位置,肿瘤数目,Frankel分级,术中出血量(表1)。
三、术前准备及评估
完善术前检查,包括X线片、CT、MRI(图1 a、b)以及判断全身转移状况的骨扫描或PET-CT。术前应用Tomita评分[10]、改良Tokuhashi评分[11]对每位病人进行术前评估,制定相应的手术方案。根据Tomita评分原则,2~3分(预后较好)的有21例,4~5分(预后相对较好)的有17例,6~7分(预后相对较差)的有7例,8~9分(预后较差)的0例。根据Tokuhashi评分原则,0~8分(预计生存时间小于6个月)的有22例,9~11分(预计生存时间6个月到12个月)的有15例,12~15分(预计生存时间大于12个月)的有8例。
四、治疗方法
45例脊柱转移肿瘤病人均行手术治疗,椎体成形术2例,后路脊柱肿瘤刮除椎弓根螺钉减压内固定术41例,后路脊柱肿瘤刮除椎弓根螺钉减压内固定术结合术中射频消融2例。45例转移性脊柱肿瘤中有23例术前进行原发肿瘤的外科手术治疗,22例则接受相应的内科保守治疗。

表1 术前一般资料
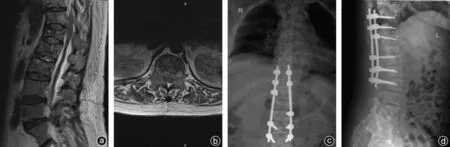
图1 女,64岁,诊断为乳腺癌脊柱转移 a、b:术前MRI提示T12及L1椎体压缩性改变,T11-12水平脊髓增粗伴异常信号;c、d:术后X线片提示T9-11椎体及L1-3椎体术后固定中,T12-L1椎体楔形变
五、术后随访
术后进行一般支持治疗并完善脊柱X线片等影像学检查(图1 c、d)。术后根据病人的一般恢复状况,指导其进行早期的功能锻炼及康复训练;根据原发肿瘤的特性制定下一阶段的治疗方式。术后采用疼痛视觉模拟量表(visual analogue scale,VAS)和ASIA脊柱损伤Frankel分级对病人的生活质量、神经功能进行评估,首次评估时间为术后2周。术后6个月进行门诊或者电话随访。随访时间定义为行手术至死亡或统计截止。
六、统计学分析
所得数据的统计学分析采用SPSS Statistic 24.0软件(IBM公司,美国)。两个分类变量之间的相关性采用皮尔逊卡方检验,若存在频数<5,则使用Fisher精确检验。采用非参数检验分析手术前后生活质量的变化。采用Kaplan-Meier法分析脊柱转移肿瘤的生存情况和生存率。对转移性脊柱肿瘤病人的生存时间进行单因素分析,纳入的变量包括性别、BMI、手术年龄是否大于60岁、原发肿瘤的恶性程度、原发肿瘤手术治疗、肿瘤的位置、转移瘤的数目、是否存在病理性骨折、术前Frankel分级、术中出血量、术前ECOG评分。根据单因素分析的结果进一步进行Cox生存分析,了解影响病人生存预后的危险因素。以P<0.05为差异有统计学意义。
结 果
一、生存情况
45例病人的随访时间为2~80个月,中位随访时间为9个月。至末次随访时,45例转移性脊柱肿瘤病人有21例死亡,转移性脊柱肿瘤病人的中位生存时间为28.1个月,1、2年生存率分别为(54±8)%、(46±10)%,图2。
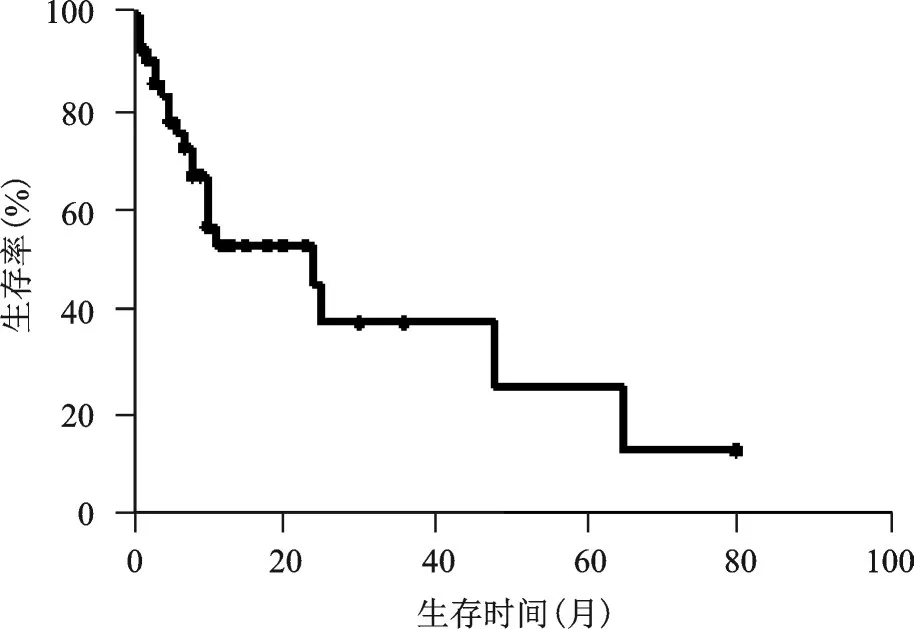
图2 脊柱转移瘤生存曲线
二、术后疼痛水平改善
术前VAS评分≥3分的有35例(78%),VAS评分<3分的有10例(22%)。术后2周对疼痛水平再评估,VAS评分≥3分的有11例(24%),VAS评分<3分的有34例(76%)。术前的VAS评分为(3.9±0.2)分,术后VAS评分为(1.8±0.2)分。术后的VAS评分较术前降低了(2.1±0.3)分。我们可以发现,手术治疗后,病人的疼痛水平得到明显改善(P<0.001,图3)。其中疼痛症状明显缓解(VAS评分减少3分及以上)的有19例(42%),疼痛部分缓解(VAS评分减少3分以下)的26例(58%)。
三、神经功能改善
按照脊柱损伤Frankel分级评估手术前后的脊髓损伤等级。术前45例中A级有2例(4%),B级有6例(13%),C级有12例(27%),D级有15例(33%),E级有10例(22%),见表1。术后对45例病人的脊柱损伤进行重新评估,45例病人中12例(27%)的脊髓损伤无明显改善,24例(53%)的Frankel等级提升了1级,8例(18%)的Frankel等级提升了2级,1例(2%)的Frankel等级提升了3级。术前的平均Frankel等级在C级与D级之间,术后的平均Frankel等级在D级与E级之间。术后较术前Frankel分级提升了(1.1±0.2)级,经统计学分析,术后的神经功能水平较术前有明显的改善,且差异具有统计学意义(P<0.001),见图4。
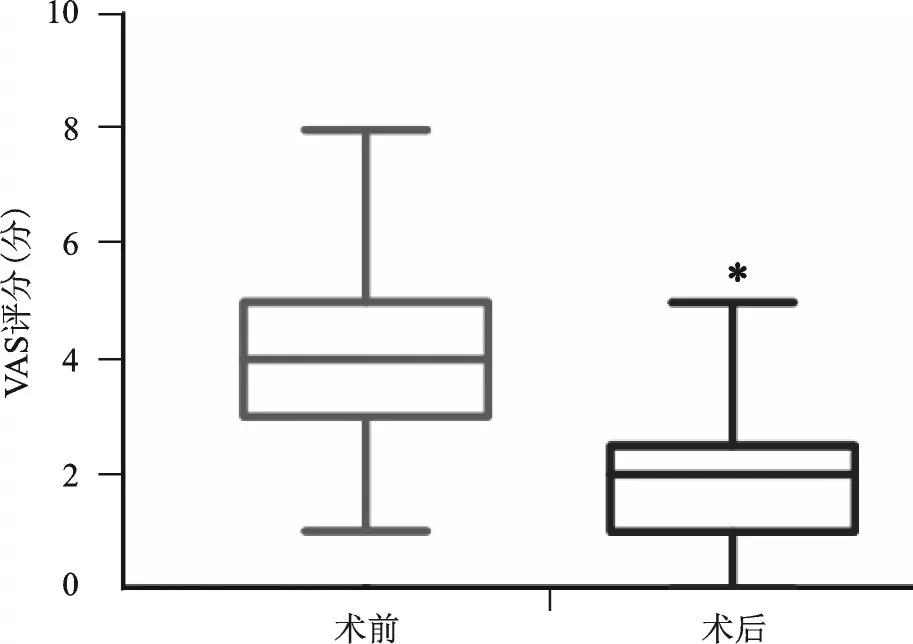
图3 脊柱手术前后VAS评分柱状分布图 术前术后的VAS评分比较,差异有统计学意义,*P<0.001
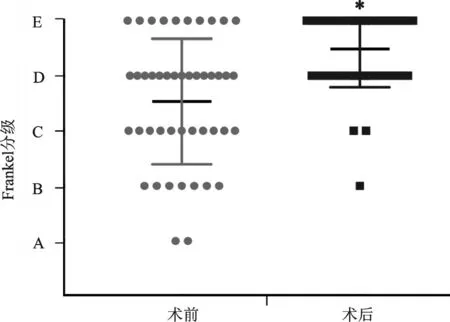
图4 脊柱手术前后Frankel等级分布图 术前术后比较,差异具有统计学意义,*P<0.001
四、转移性脊柱肿瘤的生存分析
45例转移性脊柱肿瘤病人的2年生存率为(46±10)%。单因素分析结果显示,年龄大于60岁(P=0.031)、是否存在病理性骨折(P=0.033)、ECOG评分(P=0.027)对进行脊椎手术后的生存时间有显著影响(表1)。进一步行Cox多因素分析,是否存在病理性骨折[HR=2.5,95%置信区间为(1.030,6.270),P=0.043]是影响病人预后的独立危险因素(图5),而病人的年龄是否大于 60岁(P=0.120,HR=2.4)及ECOG评分(P=0.700,HR=6.8)并不是影响病人预后的独立危险因素。

图5 Cox模型中基于术前是否合并病理性骨折的生存分析
讨 论
一、转移性脊柱肿瘤病人的流行病学特征
由于脊柱转移瘤继发于其他原发肿瘤,其发生的时间较为延后。本研究中病人的年龄分布为38~85岁,平均年龄为65岁,与既往文献报道转移性脊柱肿瘤病人发病中位年龄60岁相近,高于一般原发恶性肿瘤的发病年龄[12]。同时外国研究显示容易发生脊柱转移的恶性肿瘤为乳腺癌、前列腺癌、甲状腺癌、肺癌[13]。而我国的一项基于481例脊柱转移瘤的流行病学分析,发现原发肿瘤为肺癌、肾癌、女性中的乳腺癌以及消化道来源的恶性肿瘤较常发生脊柱转移[14]。而本研究涉及的45例转移性脊柱肿瘤以上皮来源的器官脏器肿瘤为主,例如肺癌,乳腺癌,消化道腺癌等,而间质来源的恶性肿瘤,如乳腺癌、肉瘤等相对较少。这些脊柱转移瘤通常表现为脊柱病灶处的疼痛、神经功能的减退及脊髓压迫造成的骨相关事件,并且有很大一部分因脊柱病变首诊于骨科,而对原发肿瘤尚未进行过相应的治疗。因此,对脊柱转移瘤的治疗评估更为复杂,除了评估转移病灶的病情,更应该评估病人的全身状况及对应原发肿瘤的治疗。
二、脊柱肿瘤的手术指征与术前评估
转移性肿瘤通常为肿瘤病程的终末期,脊柱转移性肿瘤亦是如此。首先脊柱肿瘤选择外科手术治疗应考虑以下几个方面:肿瘤是否单发、肿瘤的En-neking分级[15]与WBB分级[16]、肿瘤位置。同时手术治疗的目的是针对重建脊柱稳定性、减轻疼痛症状、保留完整的神经功能、改善生活质量,而非根治性切除转移瘤。
通过术前对脊柱转移瘤进行准确的评估,选择合适的手术方式,才能使转移瘤的获益最大。Tokuhashi等[17]于1990年率先提出脊柱转移肿瘤的预后评分系统,并于2005年提出改良的评分[11]。该评分系统对一般情况、脊柱外骨转移病灶数量、椎体转移数量、脏器转移情况、原发肿瘤及脊柱瘫痪6个指标进行综合评分,判断病人的预后,并建议行保守姑息治疗、姑息性手术及肿瘤切除术。Tomita等[10]在2001年提出的Tomita评分同样适用于脊柱转移的预后评估。该评分系统对原发肿瘤、有无内脏转移、有无脊柱外骨转移3个指标进行评估。Tomita评分越低,预计生存时间越长,预后越好。临床上根据Tomita评分进行治疗方式的选择,包括控制肿瘤的肿瘤切除手术、姑息性的减压手术、一般支持治疗等。此外还有Harrington分级[18],Bauer评分[19]等都是对脊柱转移性肿瘤进行术前评估的方式。
随着肿瘤内科治疗的发展,对于脊柱转移肿瘤可以采取放疗、化疗、靶向药物治疗、免疫治疗,大大延长了转移性肿瘤的生存期,手术适应证亦明显增加[20-25]。此外,对转移瘤的保守治疗的措施也在不断进步中。有研究发现用于降低骨转移病理性骨折的双磷酸盐类药物可以抑制其他肿瘤的活性[26]。此类新型分子靶向药物的应用以及姑息保守治疗手段的进步,使脊柱转移性肿瘤病人的生活质量和生存率得到了明显的改善,手术适应证亦明显增加。因此,对脊柱转移瘤病人的术前评估应包括:①通过肿瘤的内科治疗,可以获得较长的生存时间;②术前有明显的神经功能损害症状或脊柱不稳定性;③病人的疼痛症状明显,脊柱手术可以较好改善临床体征;④病人的基础生命条件可以耐受手术,无绝对的手术禁忌。
三、脊柱肿瘤手术治疗疗效评价及预后分析
研究证实手术治疗对重建脊柱稳定性、减轻疼痛症状,保留完整神经功能,改善生活质量等方面有较大的价值[27]。Choi等[28]在一项基于922例脊柱肿瘤病人的研究中发现接受脊柱手术的病人的生活质量、VAS疼痛评分、体能状态(performance status,PS)评分在术后2年内有显著的改善。而Quan[29]另一项118例脊柱转移性肿瘤病人的研究发现手术治疗1年内,病人的轴向疼痛、神经功能等有快速的提升。本研究证实:手术后的VAS评分及神经损伤Frankel分级均有显著的改善,达到了手术治疗脊柱转移性肿瘤的基本目的,即减轻病人的疼痛,改善生活质量。此外纳入本研究的45例病人中有23例进行了原发肿瘤的手术治疗,22例进行肿瘤的内科治疗。同时45例中有23例为单发转移,22例为多发转移。脊柱外科手术治疗除了较好地减轻疼痛及改善神经症状外,通过对肿瘤的刮除减轻了转移瘤的载瘤负荷。接受脊柱手术的同时,结合对原发肿瘤的积极治疗,较好地改善了预后,一定程度上可以延长脊柱转移瘤的生存时间。我们研究纳入的病人的1年生存率超过了50%,2年生存率超过40%,说明外科手术具有改善症状及减瘤延长病人预计生存时间的双重作用。
在探究可能影响预后因素中,我们纳入了基本临床信息、原发肿瘤的特性、转移病灶的特征,我们发现是否存在病理性骨折是影响术后生存时间的独立危险因素。Kataoka等[30]在对143例脊柱转移瘤病人的预后分析中发现,原发肿瘤的恶性程度,是否存在重要脏器的转移、是否存在脊柱外骨转移是重要的预后因素。而本研究中,仅有病理性骨折是影响脊柱转移瘤生存时间的独立危险因素。分析可能的原因:①本研究纳入的脊柱转移样本量较少,使得统计结果存在一定的差异;②合并主要脏器转移的肿瘤其基础条件较差而多采用姑息保守治疗;③新的肿瘤内科治疗使得恶性肿瘤的治疗获益率增加,生存时间延长,因此原发肿瘤的影响相对弱化。
四、本研究的局限性
①本研究纳入的样本量较少,采用Cox回归模型的可信度不够高;②纳入研究的病人接受开放性肿瘤刮除椎弓根螺钉减压内固定术比例较高,而其他术式比例较低,可能对预后产生影响;③本研究为回顾性研究,数据获得及分析可能对结果造成一定的偏倚。
对于脊柱转移瘤,术前应通过已有的量表判断病人的预计寿命,结合评估的脊髓神经损伤及临床疼痛水平以及对手术的耐受度来判断是否应该进行外科手术治疗或者内科保守治疗。同时,脊柱减压手术治疗对重建脊柱稳定性、减轻疼痛症状,保留完整神经功能,改善生活质量等方面有较大的价值。而术前是否存在病理性骨折是影响转移性脊柱肿瘤病人生存预后的主要因素。因此对脊柱转移瘤应做到早发现、早干预,在发生病理性骨折或产生更严重的神经损伤前,通过内科或者外科手术手段积极阻止骨相关事件的发生,改善病人的预后。