重症急性胰腺炎腹腔感染的临床诊断及治疗
2019-08-23陈曦耕刘建国
陈曦耕 刘建国
550002贵阳市第四人民医院,贵州贵阳
急性胰腺炎按严重度分为3种:轻症急性胰腺炎(MAP)、中重症急性胰腺炎(MSAP)和重症急性胰腺炎(SAP)。SAP约占急性胰腺炎(AP)的5%~10%,伴有持续(>48 h)的器官功能衰竭。SAP早期(发病1周内)病情变化快,如后期(发病2~3周)合并感染则具有较高的病死率。依据改良Marshall评分系统作为器官功能衰竭的诊断标准,任何器官评分≥2分可定义存在器官功能衰竭。临床上,重症急性胰腺炎是一种并发症多、病情复杂、病死率比较高的急腹症。由于病情发展迅猛、易发生局部或全身感染导致胰腺及胰周坏死、脓肿,外科手术治疗仍然是无可取代的[1]。收治急性重症胰腺炎伴腹腔感染患者38例,对于其临床治疗效果与炎症反应的关系进行探讨,现研究报告如下。
资料与方法
2008年2月-2018年6月收治急性重症胰腺炎伴腹腔感染患者38例,随机分为两组,各19例。对照组男11例,女8例;年龄37~63岁,平均(50.22±4.19)岁。急性胰腺炎Ranson评分为(5.59±1.22)分。观察组男10例,女9例;年龄35~67岁,平均(51.08±4.33)岁。急性胰腺炎Ranson评分是(5.67±1.18)分,APACHE-Ⅱ评分9~18分,平均(12.21±3.42)分。两组患者一般资料比较,差异无统计学意义(P>0.05)。
方法:⑴临床诊断方法:重症急性胰腺炎伴腹腔感染多数以上腹部持续疼痛剧烈,常放射其背部,多数急性发作,伴腹胀及呕吐恶心。临床可出现腹膜刺激征、腹水,偶见腰部及肋部皮下瘀斑征(Grey-Turner征)和脐周皮下瘀斑征(cullen征),因液体积聚或假性囊肿使腰部形成可触及的肿块。患者或许可能并发一个或多个脏器功能衰竭,也可伴有严重的代谢紊乱。①CT诊断:胰腺或胰周区域出现“气泡征”。②符合全身炎症反应综合征诊断标准4项中的2项或2项以上:a.心率>90次/分。b.体温>38℃或<36℃。c.外周血白细胞计数实验室检查白细胞>20×109/L。d.呼吸频率>20次/分 或PaCO2<4.27 Kpa(32 mmHg)。③腹部彩超或CT引导下行细针腹腔穿刺,抽吸物涂片找到细菌。

表1 两组死亡率比较
表2 两组临床并发症指标比较(±s)
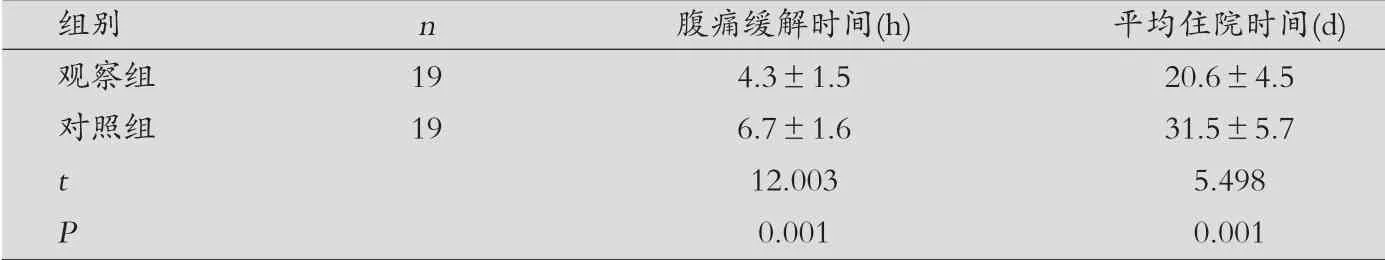
表2 两组临床并发症指标比较(±s)
组别 n 腹痛缓解时间(h) 平均住院时间(d)观察组 19 4.3±1.5 20.6±4.5对照组 19 6.7±1.6 31.5±5.7 t 12.003 5.498 P 0.001 0.001
表3 两组术前术后炎性因子水平比较(±s,μg/L)

表3 两组术前术后炎性因子水平比较(±s,μg/L)
组别 时间 TNF-α IL-6 IL-8观察组 术前 252.8±61.7 162.3±29.5 413.2±73.8术后 51.4±14.9 30.7±10.8 109.1±21.1 t 6.298 16.298 8.398 P 0.001 0.001 0.001对照组 术前 257.3±58.1 163.3±29.8 410.1±74.1术后 128.2±41.5 69.8±18.2 217.3±40.4 t 8.023 5.487 13.287 P 0.001 0.001 0.001
治疗方法:常规治疗:①所有患者禁食、胃肠减压,给予抑制胰腺外分泌及抑制胰酶活性药物。②使用能透过血液屏障的抗生素。③给予吸氧、纠正水电解质平衡与酸碱失衡、必要时行呼吸机支持、血液滤过等综合治疗。观察组在开展常规治疗的同时联合实施腹腔穿刺置管引流、腹腔镜微创治疗或开腹手术治疗,术后给予持续腹腔灌洗治疗,患者术后给予肠外营养或肠内营养支持治疗。
观察指标:①统计两组死亡率。②比较腹痛缓解时间、住院时间。③术前、术后检测患者的炎性因子(TNF-α、IL-6、IL-8)变化水平。
统计学方法:采用SPSS17.0统计学软件进行数据分析。计量资料用(±s)表示,采用t检验;计数资料用[n(%)]表示,采用χ2检验;P<0.05为差异有统计学意义。
结 果
两组均有死亡例数,观察组死亡1例,少于对照组的4例,差异有统计学意义(P<0.05),见表1。
观察组腹痛缓解时间、住院时间均明显短于对照组,差异有统计学意义(P<0.05),见表2。
两组治疗前各项炎性因子水平比较,差异无统计学意义(P>0.05);两组治疗后IL-6、TNF-α、IL-8炎性因子指标均显著下降,观察组下降更显著,差异有统计学意义(P<0.05),见表3。
讨 论
资料显示,SAP合并腹腔感染发生的原因:①SAP急性期过度的全身炎性反应综合征导致机体免疫抑制。②胰腺坏死组织及胰周积液为感染提供良好的培养基。③胃肠功能障碍、肠黏膜屏障功能受损,肠道菌群移位,为感染提供了病原菌。急性感染是由肠道菌群移位失调引起的,炎症因子可以导致肠黏膜缺血,进而导致肠壁的通透性增高,通过受损肠道部位细菌群侵入肠外组织[2-3]。重症急性胰腺炎可以使炎症介质分泌物增多,大量腹水,超多炎症因子进入血液使炎性因子水平升高[4-5]。通过手术对感染坏死的胰腺组织和腹腔内脓肿进行清除,术后通畅的灌注、引流将含胰酶等炎性介质积液和坏死组织、脓液彻底引流,以消除炎症刺激所导致的全身损伤过程。本研究结果显示,术后两组TNF-α、IL-6、IL-8炎性因子降低明显,下降更明显的是观察组,差异有统计学意义(P<0.05),从而使机体炎症因子水平降低[6]。
根据“创伤递增、损伤控制”升阶梯式治疗策略的3个步骤。第1步,胰周感染灶穿刺置管引流:当SAP患者被诊断有胰周感染后,即可在超声或CT引导下进行胰周感染灶穿刺置管引流,旨在通过引流或持续灌洗等手段控制胰周炎症。若引流效果不佳(置管引流24~72 h后症状无明显缓解或加重)则进入下一步。第2步,微创外科技术下的清创术:通过各种微创外科手段,达到清除胰周感染灶的目的。若上述两步均无法阻止患者胰周感染坏死持续进展,则进行最后一步,即第3步,开腹手术清创术。由于该治疗策略是分步骤由简单到复杂、由微创到开腹的渐进过程,因而,可以将患者的创伤控制在最小范围内,具有感染控制效果明显、预后改善显著的优势,目前在临床上已被广泛应用[7]。
SAP患者病情变化快,需要及时进行相应的处理,需要的技术来自多个学科,有ICU、消化科、普外科、超声科等,通过多学科治疗解决及时处理患者出现的问题,可以显著降低重症胰腺炎的死亡率[8]。
综上可知,重症急性胰腺炎全身感染期行相关手术治疗比非手术治疗疗效好,可显著降低患者的炎性因子水平及死亡率,取得了满意的临床疗效。
