年龄对牦牛平滑肌胶原蛋白含量和质构特性的影响
2019-08-23李升升余群力
李升升,余群力
年龄对牦牛平滑肌胶原蛋白含量和质构特性的影响
李升升1,2,余群力2
(1. 青海大学畜牧兽医科学院,西宁 810016;2. 甘肃农业大学食品科学与工程学院,兰州 730070)
为研究年龄对牦牛平滑肌胶原蛋白含量和质构特性的影响。研究了1~6岁牦牛瘤胃平滑肌中的胶原蛋白含量、溶解性和交联度以及剪切力和质构变化。结果表明:随年龄的增加,牦牛平滑肌中总胶原蛋白、不可溶性胶原蛋白、吡啶诺林含量显著增加(<0.05),增幅分别为7.61%、33.86%和196.46%;可溶性胶原蛋白含量和溶解性显著下降(<0.05),降幅分别为30.80%和35.72%;表明随着年龄增加平滑肌中胶原蛋白的交联度增加、溶解性降低。牦牛平滑肌的剪切力、硬度和咀嚼性随年龄增加而显著增加(<0.05),增幅分别为96.48%、91%和102%;内聚性、弹性和胶着性随年龄增加而显著降低(<0.05),降幅分别为25%、32%和39%;表明平滑肌的质构随年龄增加而呈现劣变趋势。相关性分析表明年龄与牦牛平滑肌总胶原蛋白含量、不可溶性胶原蛋白含量、交联度、剪切力、硬度和咀嚼性呈极显著正相关(<0.01);与可溶性胶原蛋白含量、胶原蛋白溶解性、内聚性、弹性和胶着性呈极显著负相关(<0.01);牦牛平滑肌胶原蛋白的溶解性和交联度均与剪切力和质构指标呈极显著相关(<0.01)。综合来看,年龄对平滑肌的胶原蛋白含量、溶解性、交联度和质构有显著影响;年龄越大平滑肌胶原蛋白交联度越大、溶解性越小、质构品质越差,3岁是牦牛平滑肌加工利用的适宜年龄。研究结果明确了不同年龄平滑肌的胶原蛋白特性和质构品质的变化规律,以及胶原蛋白特性对其质构品质的影响,将为平滑肌及含平滑肌内脏的产品开发和品质控制提供理论依据和数据支持。
溶解性;质构;蛋白;牦牛瘤胃;平滑肌;胶原蛋白;交联度
0 引 言
牦牛是主要分布于青藏高原及其沿线高海地区的物种。据报道[1-3],中国牦牛的存栏量约为1 600万头,约占全世界总量的95%。当前,每年约有300万头牦牛被屠宰,生产牦牛肉35万t,副产物6万t。这些副产物主要作为低附加值的产品被出售,其价格远低于牦牛肉,因此提高牦牛副产物的食用品质和经济价值势在必行。
平滑肌是畜禽肌肉组织的一种,主要存在于动物胃肠等内脏器官中,因此,在很长的一段时间内平滑肌都被作为副产物处理,没有发挥其肉用价值。从营养角度来看,平滑肌属于高蛋白低脂肪的肉品资源[1];从品质形成的角度来看,钙蛋白酶可降解平滑肌中的肌间线蛋白,改善平滑肌的嫩度[2];从加工利用角度来看,平滑肌在80~90 ℃范围内熟制具有较好的加工品质和组织形态[3],且平滑肌在转氨谷氨酰胺酶的作用下可形成较好的凝胶[4]。由此可见,平滑肌具备深度加工和开发的潜力。
质构是肉制品的主要品质指标之一,不仅影响肉品的贮藏、加工,还是消费者选购的主要指标依据[5-6]。长期以来,质构也是肉品科学家研究的焦点之一,研究表明质构主要是由基础硬度和尸僵硬度组成的,基础硬度主要受肌肉中结缔组织的影响,而胶原蛋白是结缔组织的主要成分,其含量、溶解性和交联度直接影响结缔组织的强弱,进而影响肉品的质构[7-10];尸僵硬度是宰后胴体因收缩而造成的肌肉硬度增加,可在成熟过程中改善[11-14]。据报道,不同的畜禽屠宰年龄与肉品品质密切相关[8,12]。Eyre等[15]研究表明肌肉中胶原蛋白交联稳定性随年龄的增加而增加。Slatter等[16]报道随年龄增加肌肉中胶原蛋白稳定性交联增多,胶原蛋白的热不溶解性增强,肌肉嫩度变差。卢桂松等[17]指出秦川牛肉随年龄增加表现为羟赖氨酰吡啶嗡交联度增加、胶原蛋白热溶解性降低。由此可见,不同年龄的畜禽中胶原蛋白的含量、性质和交联度有很大的变化,由此造成了肌肉质构品质的差异。然而,对于平滑肌而言,不同年龄对其胶原蛋白特性和质构的影响如何,胶原蛋白特性不同是否会引起质构品质的变化等问题尚未见报道。
为此,本试验以1~6岁牦牛瘤胃平滑肌为研究对象,分析了平滑肌中胶原蛋白的含量、溶解性和交联度以及剪切力、硬度、内聚性、弹性、胶着性和咀嚼性等肉品质构指标的变化,并进行了相关性分析。旨在明确不同年龄牦牛平滑肌中胶原蛋白含量、溶解性及交联度的变化及其对平滑肌质构品质的影响,以期为平滑肌肉用价值的开发、加工和品质控制提供理论依据和数据支持。
1 材料与方法
1.1 试验材料
新鲜牦牛瘤胃:购自青海裕泰食品有限公司,选取体况相近的1~6岁牦牛各3头,宰后取其瘤胃,除去瘤胃内容物,用水洗净瘤胃表面杂物,在(3±1)℃保温箱中运回实验室,在实验室中除去瘤胃表面的绒毛、黏膜、脂肪,肌层即为平滑肌。
1.2 主要仪器与试剂
JM-B3003电子称,诸暨市超泽衡器设备有限公司;H/T16MM台式高速离心机,湖南赫西仪器装备有限公司;CT-3质构仪,美国布鲁克菲尔德工程公司;722N紫外可见分光光度计,上海精密仪器仪表有限公司;Agilent1100高效液相色谱仪,美国安捷伦科技有限公司;HH-6电热恒温水浴锅,上海比朗仪器有限公司;JJ-2组织捣碎匀浆机,江苏国华电器有限公司;FD-1A-50冷冻干燥机,无锡沃信仪器有限公司。
主要试剂:硫酸,氯胺T,对二甲氨基苯甲醛,无水乙醇,七氟正丁酸,盐酸,乙腈,羟脯氨酸,吡啶诺林,以上试剂均为分析纯。
1.3 试验方法
1.3.1 样品处理
将每个年龄段牦牛平滑肌分成(120±5)g的肉块6块,分别测定牦牛平滑肌的胶原蛋白的含量、溶解性和交联度以及平滑肌的剪切力和质构等指标。
1.3.2 指标测定方法
1)胶原蛋白含量及溶解性的测定:参考Tamilmozhi等[18]和常海军[19]的方法测定。测定羟脯氨酸浓度的标准曲线为:=0.102+0.004,2=0.998(其中为羟脯氨酸浓度(g/mL);为吸光度)。羟脯氨酸的含量乘以系数7.25换算为胶原蛋白含量。
胶原蛋白的溶解度(%)=可溶性胶原蛋白含量(mg/g)/总胶原蛋白含量(mg/g)×100 (1)
2)胶原蛋白总吡啶诺林含量的测定:动物肌肉中的胶原蛋白随年龄的增加交联度增加,其中使胶原纤维网状结构更加稳定的主要物质是羟赖氨酰吡啶盐,即吡啶诺林,也就是说吡啶诺林的含量可以反映肌肉胶原蛋白的交联程度。为此,参考莎丽娜[20]的报道采用高效液相色谱梯度洗脱方式测定牦牛平滑肌中吡啶诺林的含量。1=0.026 81+0.046 4,2=0.998 8(其中1为吡啶诺林含量(g/mL);1为峰面积)。
从经济关系看,称之为全民所有制形式的国家所有制是苏联政治制度的经济基础,但这种所有制只把劳动者看作活劳动的体现者,而未能成为它的主人。在这种高度集中管理国家财产的条件下,这种所有制形式的空洞性越来越明显地暴露出来。在财产的分配、有效的使用和增加方面与生产者没有现实的利害关系。
3)剪切力的测定:参考李升升[3]中剪切力的测定方法。
4)质构的测定:采用美国布鲁克菲尔德工程公司CT-3型质构仪测定样品的硬度、内聚性、弹性、胶着性和咀嚼性。将肉样切成长×宽为10 mm×10 mm的方形,2~3块堆叠至样品自然高度10 mm,采用质地剖面分析(texture profile analysis,TPA)模式模拟口腔的咀嚼运动,通过对样品的2次压迫对肉样进行测定。测试参数为测试前速率为 2 mm/s,测试速率为1 mm/s,测试后速率为 1 mm/s,触发力为0.049 N,样品高度为10 mm,压缩比50%。TPA 结果采用TPA-macro 分析。每个样品测定10个平行,取平均值。
1.4 数据分析
采用SPSS17.0软件对数据进行方差分析(ANOVA),各处理平均数间采用Duncan多重比较法进行差异显著性分析,差异显著水平为=0.05,极显著水平为=0.01。
2 结果与分析
2.1 不同年龄牦牛平滑肌中胶原蛋白含量变化分析
胶原蛋白是肌肉结缔组织的主要成分,结缔组织的强弱是影响肉品质构的主要因素之一,胶原蛋白含量的变化是结缔组织强弱的主要标志物[21]。胶原蛋白根据其溶解性可分为可溶性胶原蛋白和不可溶性胶原蛋白,它们均会对肉品质产生重要的影响[22]。不同年龄牦牛平滑肌中总胶原蛋白、可溶性和不可溶性胶原蛋白含量的变化分别如图1所示,总胶原蛋白的含量随着年龄的增加而增加从1岁的(65.16±2.06) mg/g增加到6岁的(70.12±0.56)mg/g,增加了7.61%,3岁以后总胶原蛋白含量的变化不显著(>0.05);可溶性胶原蛋白的含量随年龄的增加呈减少的趋势,从1岁到6岁减少了30.80%,且可溶性胶原的含量显著减少发生在3岁之后(<0.05);不可溶性胶原蛋白的含量随年龄的增加呈显著增加的趋势(<0.05),6岁与1岁相比增加了33.86%。从数据上看,可溶性胶原蛋白减少的百分数与不可溶性胶原蛋白增加的百分数基本相当,说明随着年龄的增加,平滑肌中可溶性胶原蛋白转化成了不可溶性胶原蛋白。这与Schonfeldt和Modzelewska-Kapitula等报道不同年龄牛肉中的胶原蛋白含量的变化趋势一致[23-24]。
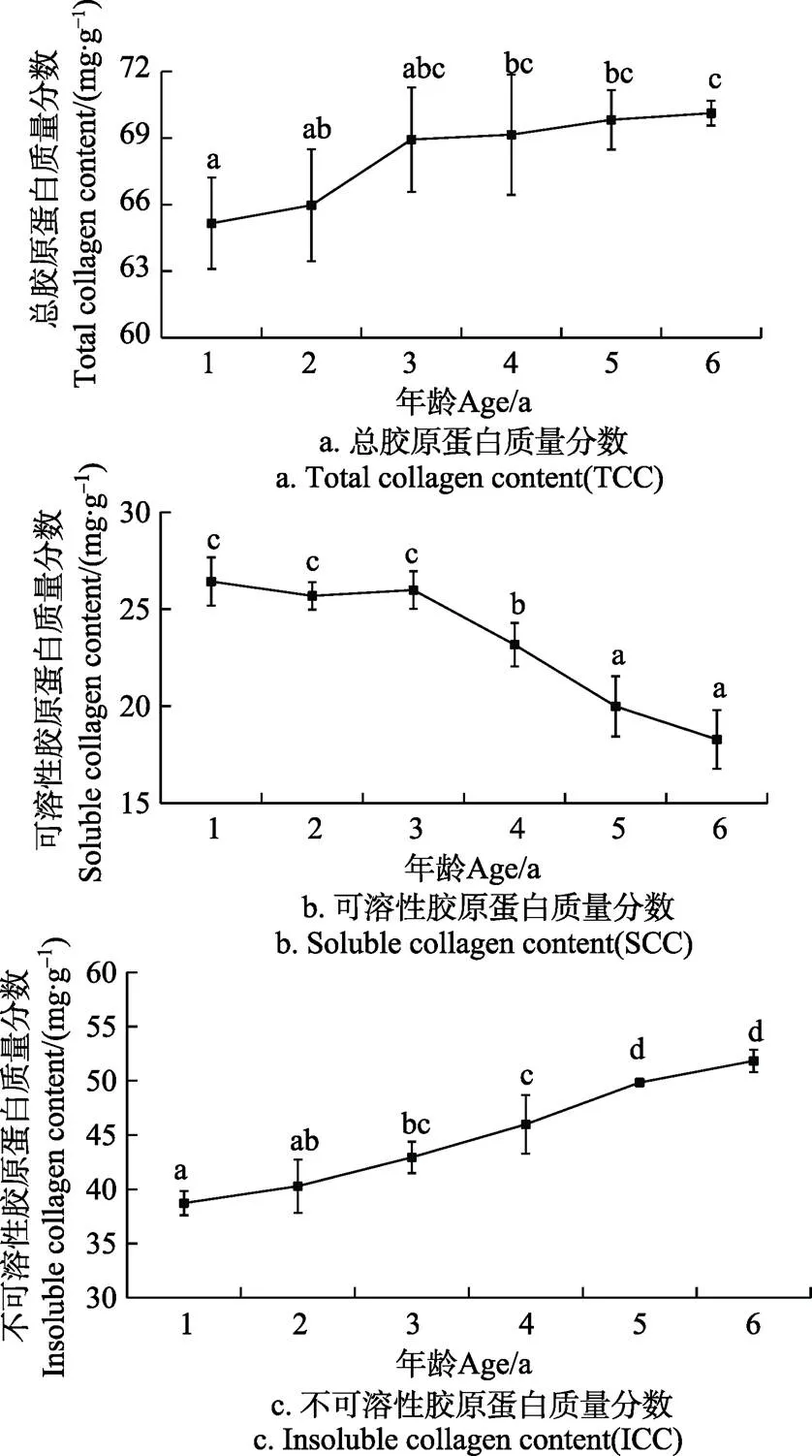
注:不同字母代表差异显著(P<0.05),下同。
2.2 不同年龄牦牛平滑肌中胶原蛋白溶解性和交联度变化分析
溶解性和交联度是胶原蛋白的主要性质,胶原蛋白在体内合成后会随着年龄的增加而发生显著的交联,交联增加会降低胶原蛋白溶解性;相关研究指出胶原蛋白的溶解度和交联度与肉品质显著相关[25-27]。不同年龄牦牛平滑肌中胶原蛋白的溶解度如图2a所示,可见胶原蛋白的溶解性随年龄的增加呈显著减少的趋势(<0.05),从1岁时的40.56%±0.96%降低到6岁26.07%±1.96%,减少了35.72%,3岁以后的降低趋势较为明显。不同年龄牦牛平滑肌中总吡啶诺林的含量如图2b所示,从1~6岁牦牛瘤胃平滑肌中总吡啶诺林的浓度基本呈“直线”趋势增加,增加了196.46%。表明随年龄的增加肌肉中胶原蛋白的交联度增加、溶解性降低,这与卢桂松等报道秦川牛肉随年龄增加表现为羟赖氨酰吡啶嗡交联度增加、胶原蛋白热溶解性降低一致[17]。
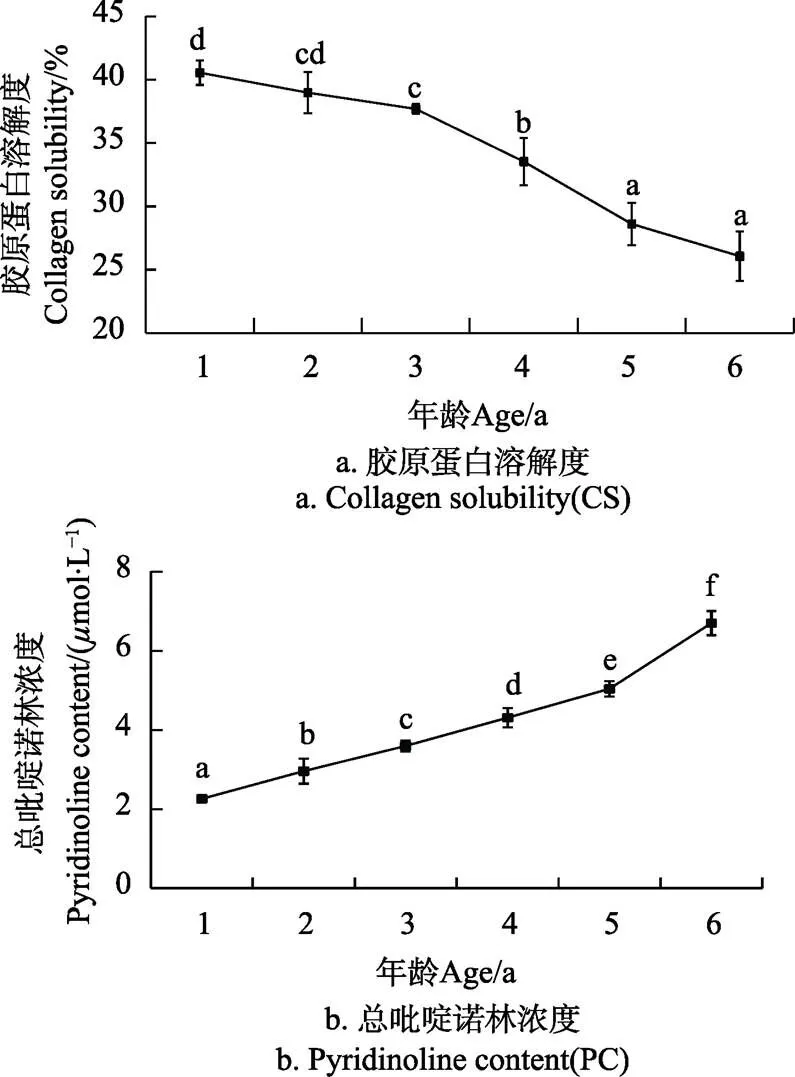
图2 不同年龄牦牛平滑肌中溶解度和总吡啶诺林浓度的变化
2.3 不同年龄牦牛平滑肌剪切力变化分析
剪切力是肉品嫩度的直接反映,也是肉品质构的主要评价指标[28-29]。由图3不同年龄牦牛平滑肌的剪切力值变化可知,牦牛平滑肌剪切力值随年龄的增加而显著增加(<0.05),其变化趋势类似“直线”,剪切力值从1岁的(49.13±1.84)N增加到6岁的(96.53±0.74)N,增加了96.48%。这与Li等报道秦川牛肉的剪切力随年龄的增加而增加结果一致[30]。
2.4 不同年龄牦牛平滑肌质构变化分析
质构是肉品品质的直接反映,对肉品的加工和产品开发有重要的影响[31-32]。不同年龄牦牛平滑肌的硬度、内聚性、弹性、胶着性和咀嚼性变化如表1所示。随着年龄的增加,牦牛平滑肌的硬度和咀嚼性显著增加(<0.05),呈“直线”增加趋势,6岁牦牛平滑肌的硬度和咀嚼性与1岁相比分别增加了91%和102%;而内聚性、弹性和胶着性则随牦牛平滑肌年龄的增加而显著降低(<0.05),其降低幅度分别为25%、32%和39%。说明随着年龄的增加,牦牛平滑肌的质构发生了显著变化,变化趋势表现为肉质食用品质下降。
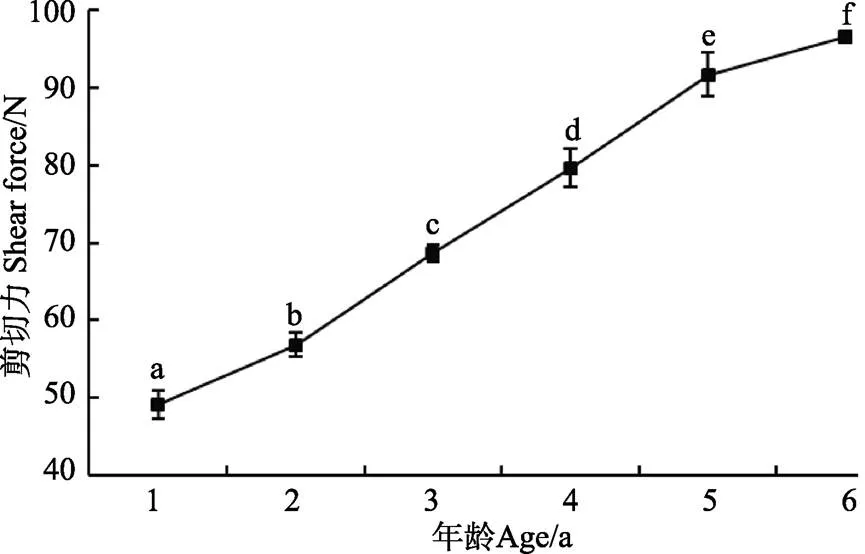
图3 不同年龄牦牛平滑肌剪切力的变化
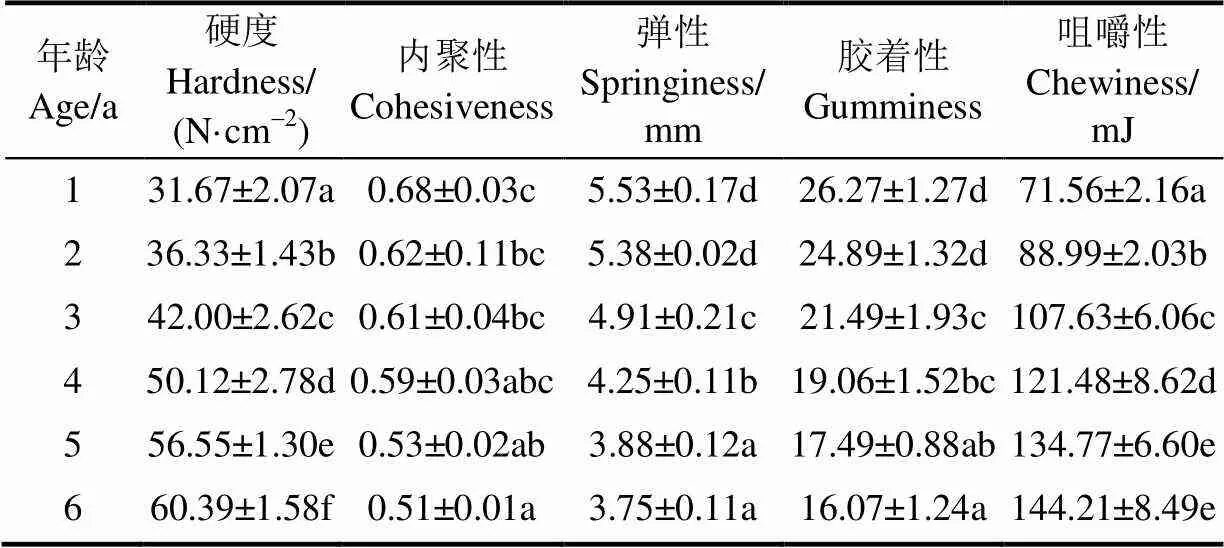
表1 不同年龄牦牛平滑肌质构的变化
2.5 相关性分析
2.5.1 年龄与牦牛平滑肌胶原蛋白特性和质构的相关性分析
牦牛平滑肌年龄与其胶原蛋白特性的相关性如表2所示。从表2可知牦牛平滑肌的年龄与其总胶原蛋白含量、不可溶性胶原蛋白含量、总吡啶诺林含量呈极显著正相关(<0.01),相关系数分别为(=0.699,=0.953,=0.973);与可溶性胶原蛋白含量、胶原蛋白溶解度呈极显著负相关,相关系数分别为(=-0.901,=-0.953;<0.01)。说明随年龄的增加胶原蛋白的交联度增加,溶解性降低。
牦牛平滑肌年龄与其质构特性的相关性见表3。牦牛平滑肌的年龄与其剪切力、硬度和咀嚼性呈极显著正相关(<0.01),相关系数分别为(=0.991,=0.983,=0.974);与内聚性、弹性和胶着性呈极显著负相关,相关系数分别为(=-0.795,=-0.969,=-0.946;<0.01)。说明牦牛平滑肌的质构品质随年龄增加而下降。
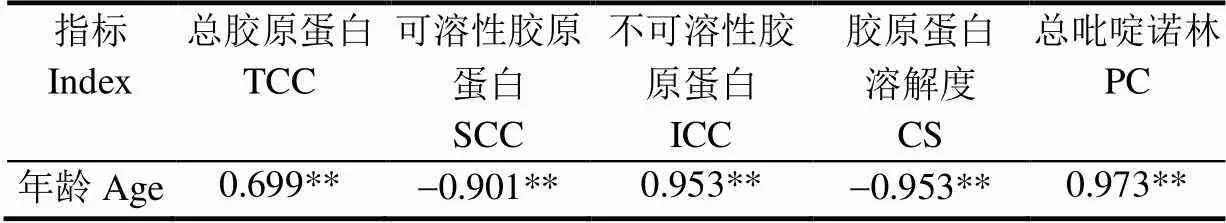
表2 牦牛平滑肌年龄与其胶原蛋白含量、性质的相关性分析
注:**表示相关性极显著<0.01,下同。
Note: Correlation is significant at<0.01, the same below.

表3 牦牛平滑肌年龄与其质构的相关性分析
2.5.2 牦牛平滑肌胶原蛋白特性与质构的相关性分析
牦牛平滑肌胶原蛋白的溶解性和交联度与其质构的相关性分析如表4所示,其中胶原蛋白交联度用吡啶诺林的含量表征。从表4可见牦牛平滑肌胶原蛋白溶解度与其内聚性、弹性和胶着性呈极显著正相关(<0.01),相关系数分别为(=0.704,=0.957,=0.880);与其剪切力、硬度和咀嚼性呈极显著负相关,相关系数分别为(=-0.947,=-0.929,=-0.929;<0.01)。牦牛平滑肌中吡啶诺林含量与其剪切力、硬度和咀嚼性呈极显著正相关(<0.01),相关系数分别为(=0.949,=0.948,=0.939);与其内聚性、弹性和胶着性呈极显著负相关,相关系数分别为(=-0.803,=-0.924,=-0.902;<0.01)。牦牛平滑肌胶原蛋白的溶解性和交联度与其质构指标相关性均达到了极显著水平(<0.01),说明牦牛平滑肌胶原蛋白的特性显著影响其质构品质。

表4 牦牛平滑肌胶原蛋白特性与其质构的相关性分析
3 讨 论
质构是肉制品的主要品质,它不仅影响肉制品的食用价值,也影响肉制品的经济价值[31]。本文研究了不同年龄牦牛平滑肌的质构品质,表明随年龄的增加平滑肌的剪切力、硬度和咀嚼性显著增加(<0.05),嫩度变差,相关性分析支持了这一结论。这与Li等[30]的报道秦川牛肉的剪切力随年龄的增加而显著增加一致。
基础硬度和尸僵硬度是影响肌肉质构品质的主要因素。在不考虑成熟过程,仅以肌肉本身为研究对象时,基础硬度是影响肌肉质构的主要因素。本试验中平滑肌总胶原蛋白、不可溶性胶原蛋白和吡啶诺林的含量随年龄增加而增加;而可溶性胶原蛋白含量和胶原蛋白溶解度随年龄增加而降低;说明随着年龄增加平滑肌中胶原蛋白的交联度增加、溶解性降低。胶原蛋白交联度的增加和溶解性降低意味着肌肉结缔组织强化,而Schonfeldt等[23]报道肌肉结缔组织的弱化与肌肉的嫩度呈正相关,说明年龄越大,肌肉中胶原蛋白的交联度越大、溶解性越低,质构越差。
质构的变化在一定程度是肌肉内部组成和结构变化的反映,研究表明肌肉主要是由肌纤维和包裹肌纤维的肌膜组成的,肌纤维随年龄的增加主要表现为体积的增大[8];而结缔组织中的主要成分是胶原蛋白,幼龄动物中胶原蛋白主要是可溶性胶原蛋白,这些蛋白由赖氨酰氨氧化酶氧化赖氨酸或羟赖氨酸形成醛赖氨酸和醛羟赖氨酸,进而醛赖氨酸形成醛亚胺交联,而醛羟赖氨酸形成酮胺交联,这些还原性交联是在两个胶原蛋白分子间形成的,随动物年龄增加,还原性的交联会被非还原性的交联代替,进而形成三共价键的交联,与此同时可溶性的胶原蛋白变成不可溶性的胶原蛋白,胶原蛋白交联度的增加和溶解性的降低使胶原蛋白的纤维网状结构更加稳定,增加肌肉结缔组织的强度,使得肌肉的质构品质劣变[20,23-24]。
从肉品加工利用的角度来说,针对不同年龄畜禽的肉用品质特点和肉品的加工利用方式,合理的选择屠宰年龄是畜禽增值的关键。从试验结果来看,牦牛平滑肌胶原蛋白含量和交联度的变化在3岁以后较为明显,结合其质构变化,对于平滑肌的加工利用来说3岁是牦牛平滑肌适宜的加工利用年龄。
4 结 论
1)牦牛平滑肌胶原蛋白特性和质构的变化表明,年龄越大,牦牛平滑肌可溶性胶原蛋白含量越少、交联度越高、溶解性越差;剪切力、硬度及咀嚼性越大、质构越差。
2)胶原蛋白含量和交联度的变化表明,1~3岁牦牛平滑肌可溶性和不可溶性胶原蛋白含量变化较小,3~6岁变化显著,可溶性胶原蛋白降幅与不可溶性胶原蛋白增幅相当,说明随年龄增加可溶性胶原蛋白转化成了不可溶性胶原蛋白,导致平滑肌胶原蛋白的溶解性降低;1~6岁牦牛平滑肌胶原蛋白的吡啶诺林含量增加了196.46%,表明随年龄增加牦牛平滑肌胶原蛋白的交联度显著增加。
3)相关性分析表明,年龄与牦牛平滑肌胶原蛋白溶解性、交联度和质构品质显著相关(<0.01);同时胶原蛋白溶解性和交联度与其质构指标显著相关(<0.01);表明随年龄增加牦牛平滑肌胶原蛋白交联度的增加和溶解性的降低是影响其质构变化的主要原因。
4)综上所述,年龄对平滑肌的胶原蛋白特性和质构品质有显著的影响,结合胶原蛋白特性及质构品质的变化,3岁是牦牛平滑肌适宜的加工利用年龄。
[1] 李升升,余群力. 牦牛骨骼肌、平滑肌和心肌氨基酸和脂肪酸组成分析及营养评价[J]. 营养学报,2018,40 (2):194-196. Li Shengsheng, Yu Qunli. Amino acid and fatty acid compositions and nutritional quality of skeletal, smooth and cardiac muscles of yak[J]. Acta Nutrimenta Sinica, 2018, 40(2): 194-196. (in Chinese with English abstract)
[2] Chang Y, Stromer M H, Chou R R.-Calpain is involved in the postmortem proteolysis of gizzard smooth muscle[J]. Food Chemistry, 2013, 139: 384-388.
[3] 李升升,余群力,靳义超. 适宜加热温度保持牦牛瘤胃平滑肌加工品质和组织结构[J]. 农业工程学报,2017,33(23):300-305. Li Shengsheng, Yu Qunli, Jin Yichao. Effect of cooking final temterature and cutting method on eating quality of pan-fried steak [J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2017, 33(23): 300-305. (in Chinese with English abstract)
[4] Abdulatef M A, Tetsuo N, Michio M. Impact of transglutaminase on the textural, physicochemical, and structural properties of chicken skeletal, smooth, and cardiac muscles[J]. Meat Science,2009,83(l): 759-767.
[5] Bao Y L, Per E. Relationship between oxygen concentration, shear force and protein oxidation in modified atmosphere packaged pork[J]. Meat Science, 2015, 110(7): 174-179.
[6] Brunton N P, Lyng J G, Zhang L, et al. The use of dielectric properties and other physical analyses for assessing protein denaturation in beef biceps femoris muscle during cooking from 5 to 85℃[J]. Meat Science, 2006, 72(2): 236-244.
[7] Song Z G, Zhu L N, Xue Z Z, et al. Extraction and structural characterization of collagen from skin of[J]. Food Science, 2018, 39(20): 260-267.
[8] Fang S H, Nishimura T, Takahashi K. Relationship between development of intramuscular connective tissue and toughness of pork during growth of pigs[J]. Journal of Animal Science, 1999, 77(1): 120-130.
[9] Powell T H, Hunt M C, Dikeman M E. Enzymatic assay to determine collagen thermal denaturation and solubilization[J]. Meat Science, 2000, 54(4): 307-311.
[10] Lepetit J. A theoretical approach to the relationships between collagen content, collagen cross-links and meat tenderness[J]. Meat Science, 2007,76(10): 147-159.
[11] Vitale M, Perez-Juan M, Lloret E, et al. Effect of aging time in vacuum on tenderness, and color and lipid stability of beef from mature cows during display in high oxygen[J]. Meat Science, 2014, 96(7): 270-277.
[12] Kemp C M, Parr T. Advances in apoptotic mediated proteolysis in meat tenderization[J]. Meat Science, 2012, 92 (2): 252-259.
[13] Huang F, Huang M, Zhang H, et al. Changes in apoptotic factors and caspase activation pathways during the postmortem aging of beef muscle[J]. Food Chemistry, 2016, 190(5): 110-114.
[14] Lana A, Zolla L. Proteolysis in meat tenderization from the point of view of each single protein: A proteomic perspective [J]. Journal of Proteomics, 2016, 147(2): 85-97.
[15] Eyre D R, Koob T J, Van K P. Quantization of hydroxyl- pyridinium cross-links in collagen by high-performance liquid chromatography[J]. Analytical Biochemistry, 1984, 137(2): 380-388.
[16] Slatter D A, Avery N C, Bailey A J. Collagen in its fibrillar state is protected from glycation[J]. The International of Biochemistry & Cell Biology, 2008, 40(10): 2253-2263.
[17] 卢桂松,王复龙,朱易,等. 秦川牛花纹肉剪切力值与胶原蛋白吡啶交联和热溶解性的关系[J]. 中国农业科学, 2013,46(1):130-135. Lu Guisong, Wang Fulong, Zhu Yi, et al. Study on the relationships between pyridinoline cross-links and solubility of collagen and shear force of Qinchuan marbling beef[J]. Scientia Agricultura Sinica, 2013, 46(1): 130-135. (in Chinese with English abstract)
[18] Tamilmozhi S, Veeruraj A, Arumugam M. Isolation and characterization of acid and pepsin-solubilized collagen from the skin of sailfish () [J]. Food Research International, 2013, 54(2): 1499-1505.
[19] 常海军. 不同加工条件下牛肉肌内胶原蛋白特性变化及其对品质影响研究[D]. 南京:南京农业大学,2010. Chang Haijun. Study on Effects of Different Processing Conditions on Characteristics Changes of Collagen and Meat Quality of Beef Muscle[D]. Nanjing:Nanjing Agricultural University, 2010. (in Chinese with English abstract)
[20] 莎丽娜. 自然放牧苏尼特羊肉品质特性的研究[D]. 呼和浩特:内蒙古农业大学,2009. Sa Lina. The Study on Meat Characteristics of Natural Grazing Sunit Sheep[D]. Hohhot:Inner Mongolia Agricultural University, 2009. (in Chinese with English abstract)
[21] Modzelewska-kapitula M, Nogalski Z, Kwiatkowska A. The influence of crossbreeding on collagen solubility and tenderness ofandmuscles of semi-intensively reared young bulls[J]. Animal Science Journal, 2016, 87(1): 1312-1321.
[22] Anton F, Madalina G A, Mihaela B, et al. Collagen hydrolysate based collagen/ hydroxyapatite composite materials [J]. Journal of Molecular Structure, 2013, 1037(4): 154-159.
[23] Schonfeldt H C, Strydom P E. Effect of age and cut on tenderness of South African beef[J]. Meat Science, 2011, 87(3): 206-218.
[24] Modzelewska-Kapitula M, Nogalski Z. Effect of gender on collagen profile and tenderness of infraspinatus and semimembranosus muscles of Polish Holstein-Friesian´Limousine crossbred cattle[J]. Livestock Science, 2014, 167 (9): 417-424.
[25] Lin Yungkai, Lin Tungyung, Su Houpin. Extraction and characterization of telopeptide-poor collagen from porcine lung[J]. Food Chemistry, 2011, 124(4): 1583-1588.
[26] Gudmundsson M, Hafsteinsson H. Gelatin from cod skins as affected by chemical treatments[J]. Journal of Food Science, 1997, 62(1): 37-39.
[27] Matthew D S, Ronald T R. Collagen structure and stability [J].Annual Review of Biochemistry, 2009, 78(3): 929-958.
[28] Bayraktaroglu A G, Kahraman T. Effect of muscle stretching on meat quality of biceps femoris from beef[J]. Meat science, 2011, 88(3): 580-583.
[29] 王鹏,陈林,徐幸莲,等. 喷淋通风宰前静养对肉鸡夏季运输屠宰肉品质的影响[J]. 农业工程学报,2018,34(22):275-281. Wang Peng, Chen Lin, Xu Xinglian, et al. Effects of pre-slaughtering holding with water-misting sprays and forced ventilation on meat quality of broiler after summer transport[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2018, 34(22): 275-281. (in Chinese with English abstract)
[30] Li Linqiang, Tian Wanqiang, Zan Linsen. Effects of age on quality of beef from Qinchuan cattle carcass[J]. Agricultural Sciences in China, 2011, 10(11): 1765-1771.
[31] Li Shengsheng, Yu Qunli, Han Ling, et al. Effect of proteomo changes on the tenderness of yak rumen smooth muscle during postmortem storage based on the label-free mass spectrometry[J]. Food Research International, 2019, 116(2): 1336-1343.
[32] Van W L, De S S, Ueland Ø, et al. Relationships between sensory evaluations of beef tenderness, shear force measure- ments and consumer characteristics[J]. Meat Science, 2014, 97(3): 310-315.
Effect of age on collagen content and texture characteristics of yak smooth muscle
Li Shengsheng1,2, Yu Qunli2
(1.810016,; 2.730070,)
Yak is mainly distributed in the Qinghai-Tibet Plateau, and there are more than 16 million yaks in China, which accounts for approximately 95% of the world’s yaks. Approximately three million yaks are slaughtered per year and the production of meat (skeletal muscle) is approximately 350 thousand tons, while the production of by-product (stomach, intestines, and other internal organs) is approximately 60 thousand tons. At present, those by-products are consumed as low-value products, and the price of by-products is much lower than that of meat, thus, increasing the edible and economic value of by-products is essential. In fact, smooth muscle belongs to a category of muscle tissue that is widely distributed in animal stomach, intestines, and other internal organs. However, smooth muscle has not been treated as meat. Therefore, enhancing the meat value of smooth muscle is a significant goal. In order to investigate the effect of age on collagen content and texture characteristics of yak rumen smooth muscle. The total, soluble, insoluble collagen content, solubility, cross-linking degree, shear force and texture of 1 - 6 years yak rumen smooth muscle were measured. The results showed that the yak rumen smooth muscle total, insoluble collagen and pyridinoline collagen content were significantly increased with the age increase (<0.05), and the increased rate were 7.61%, 33.86% and 196.46%, respectively. However, soluble collagen content and collagen solubility of yak rumen smooth muscle were significantly decreased with the age increase (<0.05), and the decreased rate were 30.80% and 35.72%, respectively, which showed the cross-linking degree of yak rumen smooth muscle increased with age increase, while collagen solubility of yak rumen smooth muscle decreased with the age increase. The shear force, hardness and chewiness of yak rumen smooth muscle significantly increased with the age increase (<0.05), and the increased rate were 96.48%, 91% and 102%, respectively, while cohesiveness, springiness and gumminess of yak rumen smooth muscle were significantly decreased with the age increase (<0.05), and the decreased rate were 25%, 32% and 39%, respectively, which showed the texture of yak rumen smooth muscle decreased with age increase. Correlation analysis confirmed that the age of yak rumen smooth muscle had a positive significant correlation with the total collagen content, cross-linking degree, shear force, hardness and chewiness (< 0.01), and had a negative significant correlation with soluble collagen content, collagen solubility, cohesiveness, springiness and gumminess (<0.01). Moreover, collagen solubility and cross-linking degree of yak rumen smooth muscle had significant effect on shear force and texture (<0.01). In summary, age of yak rumen smooth muscle had significant effect on the content, solubility, cross-linking degree of collagen and texture. Texture worse with the age increase of yak rumen smooth muscle. Collagen solubility and cross-linking degree of yak rumen smooth muscle had significant effect on shear force and texture. The rumen smooth muscle had suitable eating quality when the yak three years old. Our research identified the collagen content and texture characteristics change rules of smooth muscle at different ages, and the influence of collagen content and texture characteristics, which will provide theoretical basis and data support for the smooth muscle product development and quality control.
solubility; texture; protein; yak rumen; smooth muscle; collagen; cross-linking
10.11975/j.issn.1002-6819.2019.13.037
TS251.5
A
1002-6819(2019)-13-0306-06
2019-01-17
2019-05-29
国家自然科学基金资助项目(31701625);种间杂交牦牛肉乳特性及差异基因分析资助(2018-HZ-816);国家肉牛牦牛产业技术体系资助(CARS-38)
李升升,山西临汾人,博士,副研究员,主要研究方向为畜产品科学与工程。Email:lishsh123@163.com
李升升,余群力.年龄对牦牛平滑肌胶原蛋白含量和质构特性的影响[J]. 农业工程学报,2019,35(13):306-311. doi:10.11975/j.issn.1002-6819.2019.13.037 http://www.tcsae.org
Li Shengsheng, Yu Qunli.Effect of age on collagen content and texture characteristics of yak smooth muscle[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2019, 35(13): 306-311. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2019.13.037 http://www.tcsae.org
