大鼠脊髓背角胶状质神经元去极化反跳参与大鼠慢性神经病理性疼痛*
2019-08-23李凌超朱梦叶吴艳盈张达颖
李凌超 朱梦叶 吴艳盈 张达颖
(1大连医科大学附属第二医院疼痛科,大连 116000;2南昌大学第一附属医院疼痛科,南昌 330006;3大连花园口新城医院内科,大连 116000)
慢性疼痛被定义为持续或复发的时间超过1个月的疼痛[1]。慢性疼痛不仅影响工作及生活质量,还可能诱发焦虑、抑郁等负面情绪,给家庭和社会带来沉重的负担。调查显示:我国慢性疼痛的发病率为52.99%[2],而且随年龄的增长而增加,50%~75%的老年人存在一种或多种慢性疼痛[3]。慢性疼痛的发病率高,其病理生理机制尚未完全明确,临床治疗效果不佳。
神经元在接受超极化刺激后爆发动作电位的现象叫做“去极化反跳(rebound depolarization)”[4,5]。有研究发现,去极化反跳在生理和病理状态下都发挥作用[6,7],而且发生部位不同其功能也不同。去极化反跳还可能与抑制性和兴奋性信息之间的转换以及与外周刺激强度识别相关[8~10]。
脊髓背角II层被称为胶状质(substantia gelatinosa, SG)区,是痛觉信号由外周传入中枢的第一个中继站[11],在痛觉传递与调制中起到关键的作用。Rivera-Arconada等人对脊髓背角IV、V、VI层神经元的去极化反跳进行了研究[10],但II层SG神经元在慢性疼痛状态下的去极化反跳特点尚无报道,因此,本研究制作坐骨神经部分结扎(partial sciatic nerve ligation, PSNL)模型,结合膜片钳电生理技术,初步探讨离体脊髓切片中SG神经元去极化反跳的基本特点,为明确慢性疼痛的脊髓机理以及发现慢性疼痛治疗的新靶点提供理论依据。
方 法
1.实验动物
选取4周龄雄性SD大鼠66只,体重为90 ~ 100 g,采用随机数字表法随机分为3组:模型组模型组(坐骨神经部分结扎,PSNL)、假手术组(sham)和对照组(control),每组各22只。模型组行坐骨神经部分结扎(partial sciatic nerve ligation,PSNL),假手术组不缝扎神经,余步骤同模型组,对照组不做任何处理。本实验中所有大鼠均来源于江西中医药大学动物实验中心,本研究严格按照《南昌大学动物实验伦理审查》原则和《南昌大学实验动物管理办法》进行。
2.实验相关溶液配制
(1)解剖液组成成分为(mmol/L):sucrose 240,NaHCO325,KCl 2.5,NaH2PO4·2H2O 1.25,CaCl2·2H2O 0.5,MgCl2·6H2O 3.5,ascorbic acid 0.4,sodium pyruvate 2 (pH=7.4, 310 mOsm)。
(2)人工脑脊液(ACSF)组成成分为(mmol/L):NaCl 117,KCl 3.6,NaH2PO4·2H2O 1.2,CaCl2·2H2O 2.5,MgCl2·6H2O 1.2,NaHCO325,glucose 11,ascorbic acid 0.4,sodium pyruvate 2 (pH=7.4,310 mOsm)。
(3)电极内液成份为(mmol/L):K-gluconate 130,KCl 5,EGTA 0.5,HEPES 10,Mg-ATP 4,Li-GTP 0.3,phosphocreatine di (tris) salt 10 (pH=7.2,300 mOsm)。K-gluconate购自Wako,余试剂均购自Sigma。
3.实验方法
参照Seltzer等[12]的方法,制作坐骨神经部分结扎(PSNL)模型:取 4周龄雄性 SD 大鼠,乙醚麻醉后,无菌操作下在右侧股段高位切开皮肤,钝性分离肌肉,暴露坐骨神经,将7-0尼龙丝线缝入神经干内,使神经的背侧1/3~1/2被收在线圈内,然后较松结扎套在线圈内的部分神经干,逐层缝合至皮肤。假手术组不缝扎神经,其他步骤和模型组相同,对照组不做任何处理。应用Von Frey触觉测痛仪,采用 Dixon 的Up and down方法[13]测量模型组和假手术组术前、术后3、7、10和14 d以及对照组相应时间点的机械痛阈,克数递增或递减的方式进行测试,每次测试重复10次,持续时间6 ~ 8 s,每两次测试间隔超过15 s,若10次中出现缩爪或舔爪反应≥5次被认为阳性,并记录出现阳性反应的最小克数作为其缩爪阈值。
模型组和假手术组均于术后15 d制作离体脊髓切片后处死,对照组同期制作脊髓切片。腹腔注射乌拉坦(每公斤体重1.2 g),行心脏灌流,剪下并取出以腰骶膨大为中心的脊髓,用振动切片机在冰水混合状态下的解剖液中切取300 μm厚的脊髓纵切片。将切好的脊髓切片转入32 ℃恒温并持续充氧(95% O2+ 5% CO2)的人工脑脊液中孵育半个小时,目的为尽可能模拟SG神经元正常的生理环境。获取所需标本后,采用放血法处死仍在麻醉状态下的实验动物。
应用全细胞膜片钳技术记录模型组、假手术组和对照组SG神经元(n=34)的去极化反跳反应及其他电生理特性。把孵育后的脊髓纵切片移到电生理记录槽内,表面持续恒速灌流充以95% O2和5% CO2混合气体的人工脑脊液。参照我们以前的方法[14],首先在显微镜低倍镜(BX51WI, Olympus),10倍下找到半透明的脊髓背角SG区(见图1A),然后换用高倍红外微分干涉相差镜(IR-1000, Dage-MIT)40倍,选取状态良好的神经元(表现为细胞立体感强,胞膜较为清晰,富有弹性)进行全细胞膜片钳记录(见图1B)。通过调节显微镜粗调和微操控系统,使电极尖端和神经元细胞膜紧密连接,然后将钳制电位(holding potential, HP)控制在-70 mV,破膜,形成全细胞膜片钳(whole cell patch clamp)记录模式。所有实验结果的记录均在封接5 ~ 10 min电流稳定之后进行。给予时程1 s,大小 -120 pA的超极化电流刺激,可观察到细胞受超极化刺激(见图1C紫色框内部分)后产生的去极化反应(见图1CE黑色箭头所指)。根据有或无去极化反跳及是否伴有放电,将SG神经元分为三组:无去极化反跳(见图1C)、去极化反跳无放电(见图1D)和去极化反跳伴放电(见图1E),后两者归纳为有去极化反跳。本实验应用EPC-10放大器(HEKA公司生产)进行细胞电信号的采集并使用Patchmaster软件进行记录和分析,整个记录过程在室温下进行。
4.统计学分析
所有数据均以均数±标准误()表示。各组数据采用GraphPad Prism 5.0进行曲线拟合。采用SPSS 17.0统计软件进行统计学分析。多组样本差异比较采用方差分析;重复测量数据采用重复测量方差分析;计数资料采用卡方检验。P˂0.05为差异具有统计学意义。
结 果
1.大鼠疼痛行为学
模型组(n= 22)术后3天机械痛阈(3.1±0.3 g)相比假手术组(3.7±0.3 g)和对照组(3.8±0.3 g)有下降趋势,但无统计学意义;模型组术后7天(2.1±0.2 g)、10天(1.7±0.2 g)、14天(1.5±0.2 g)机械痛阈比假手术组 (3.9±0.3 g)、(3.7±0.3 g)、(4.0±0.3 g)和对照组 (3.9±0.2 g)、(3.7±0.3 g)、(3.8±0.3 g)显著降低(P˂0.05,见图2)。
2.PSNL术后SG神经元去极化反跳现象增加
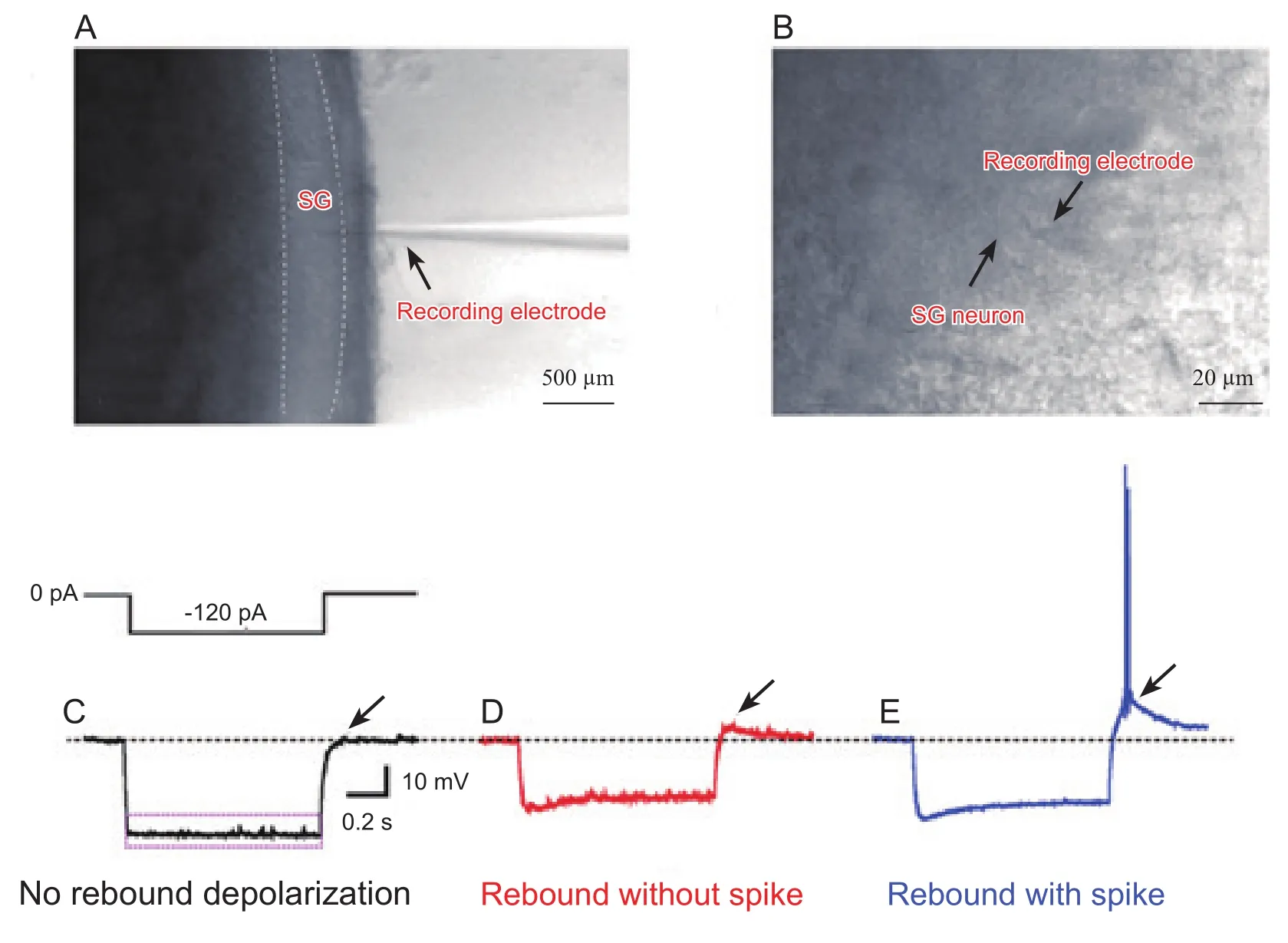
图1 SG神经元在显微镜下的形态及接受超极化电流刺激后反应代表图Fig.1 The representative diagram of morphology under microscope and the response after hyperpolarizing current stimulation of SG neurons
本实验共记录102个SG神经元的电生理记录,模型组、假手术组和对照组每组均记录了34个,每组中有去极化反跳的神经元数分别为26、19和17。SG神经元中50%以上有去极化反跳,而且模型组去极化反跳的出现概率明显高于假手术组和对照组(P˂0.05,见图3)。
3.PSNL术后SG神经元电生理特性的变化
模型组(n= 34)、假手术组(n= 34)和对照组(n= 34)神经元的电生理特点(见表1):模型组SG神经元的动作电位阈值(-36.0±2.0 mV)明显低于假手术组(-29.1±1.0 mV)和对照组(-28.7±1.6 mV) (P˂0.05),而输入阻抗 (966.0±119.0 Ω)明显高于假手术组(632.0±58.0 Ω)和对照组(636.0±91.0 Ω) (P˂0.05)。
另外,给予SG神经元0 pA至150 pA阶跃式电流刺激,在110 pA、120 pA、130 pA、140 pA和150 pA刺激过程中,PSNL组(n= 34)动作电位频率分别为 21.3±2.5 Hz,22.2±2.6 Hz,23.0±2.8 Hz,23.6±3.0 Hz,24.5±3.2 Hz,假手术组(n= 34)分别为 18.7±1.7 Hz,19.4±1.8 Hz,19.7±2.0 Hz ,20.5±2.0 Hz,21.0±2.2 Hz,对照组(n= 34)分别为18.6±1.7 Hz,19.4±1.8 Hz,19.7±2.0 Hz,20.5±2.1 Hz,21.0±2.2 Hz,PSNL组动作电位频率明显高于假手术组和对照组(P˂0.05,见图4)。
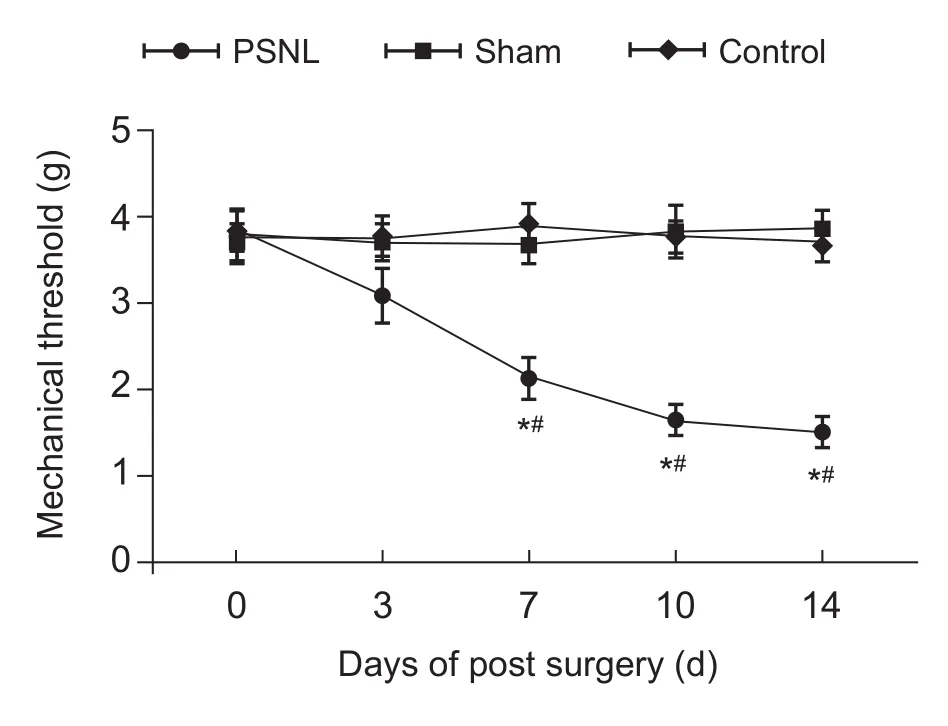
图2 模型组术后3、7、10、14天机械痛阈(EM)Fig.2 Comparison of the mechanical threshold on 3, 7, 10 and 14 days after operation among the model group(EM)
讨 论
当正离子由膜内向膜外转运(如腺苷A1受体激活后引起的钾离子外流[15])或负离子由膜外向膜内转运(如甘氨酸和γ氨基丁酸受体激活后引起的氯离子内流[16])时,这种外向电流可使膜电位增大,发生超极化。去极化反跳是神经元细胞膜在接受超极化刺激后出现的短暂去极化现象,部分神经元在该去极化的基础上可爆发动作电位[17,18]。去极化反跳多见于具有自发性节律发放的神经元,如丘脑皮层神经元[19],此外还见于无自发性节律发放的神经元,如内膝体神经元[20]和脊髓背角深层神经元[10]等。很多区域的神经元在接受超极化刺激后,都可形成去极化反跳,也就是说可将抑制性的信号输入转化为兴奋性的信号输出[21]。
来自Aδ及C纤维传入的外周伤害性信息由SG区神经元初步整合,再经过脊髓丘脑束等上行通路进入中枢神经系统高级部位,另外,SG区还汇聚来自脑干和大脑皮质的下行抑制性投射神经纤维,这些上行与下行系统以及局部的中间神经元共同构成了复杂的神经网络,这是“闸门控制理论”的核心[22]。本研究发现超过1/2的脊髓背角SG神经元可记录到去极化反跳现象。Yasaka等发现SD大鼠具有去极化反跳的SG神经元约占所记录神经元的30%~ 40%[23],而在幼年C57Bl/6小鼠的背角浅层神经元中,该比例不到30%[24],均低于本研究中的比例,表明不同种属或不同部位的神经元,去极化反跳也不完全相同[25]。
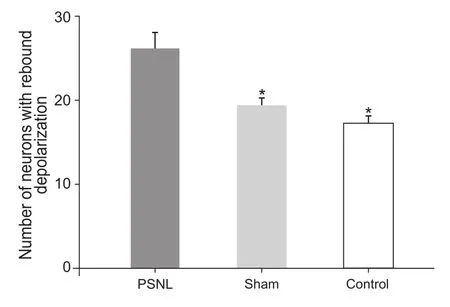
图3 模型组SG神经元去极化反跳出现的概率(EM)Fig.3 Comparison of the probability of SG neurons depolarization rebound among the model group (EM)
表1 模型组、假手术组和对照组SG神经元的基本电生理特性比较(n=34,EM)Table 1 Comparison of basic electrophysiological characteristics of SG neurons in the PSNL group, the sham operation group,and the control group (n=34,EM)
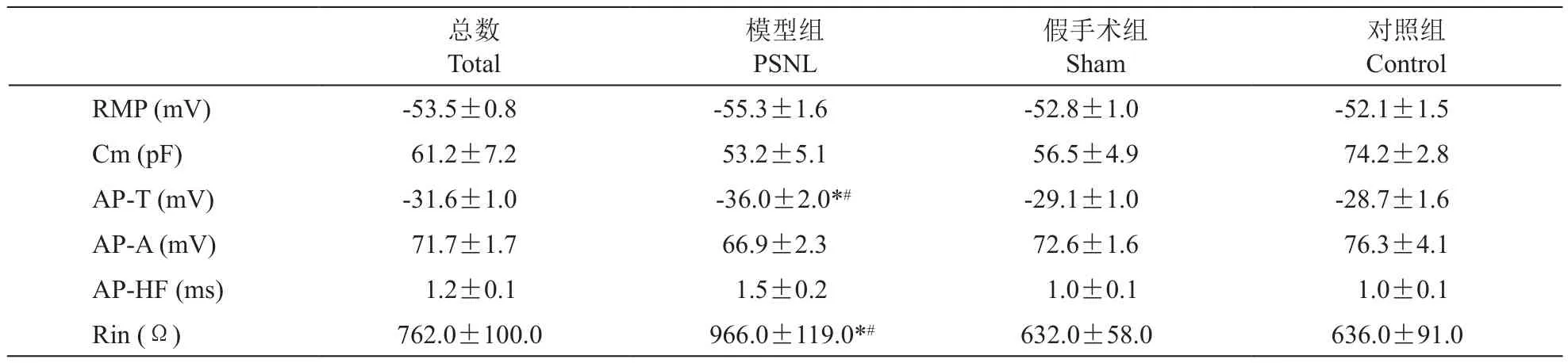
表1 模型组、假手术组和对照组SG神经元的基本电生理特性比较(n=34,EM)Table 1 Comparison of basic electrophysiological characteristics of SG neurons in the PSNL group, the sham operation group,and the control group (n=34,EM)
RMP为静息电位;Cm为膜电容;AP-T为动作电位阈值;AP-A为动作电位振幅;AP-HF为动作电位半宽度;Rin为输入阻抗。 *P˂0.05,模型组和假手术组比较,#P˂0.05,模型组和对照组比较RMP: Resting membrane potential; Cm: Membrane capacitance; AP-T: Threshold of action potential; AP-A: Amplitude of action potential; APHF: Half width of action potential; Rin: Input impedance.*P˂0.05, compared with the sham operation group; #P˂0.05, compared with the control group.
对照组Control RMP (mV) -53.5±0.8 -55.3±1.6 -52.8±1.0 -52.1±1.5 Cm (pF) 61.2±7.2 53.2±5.1 56.5±4.9 74.2±2.8 AP-T (mV) -31.6±1.0 -36.0±2.0*# -29.1±1.0 -28.7±1.6 AP-A (mV) 71.7±1.7 66.9±2.3 72.6±1.6 76.3±4.1 AP-HF (ms) 1.2±0.1 1.5±0.2 1.0±0.1 1.0±0.1 Rin (Ω) 762.0±100.0 966.0±119.0*# 632.0±58.0 636.0±91.0总数Total模型组PSNL假手术组Sham
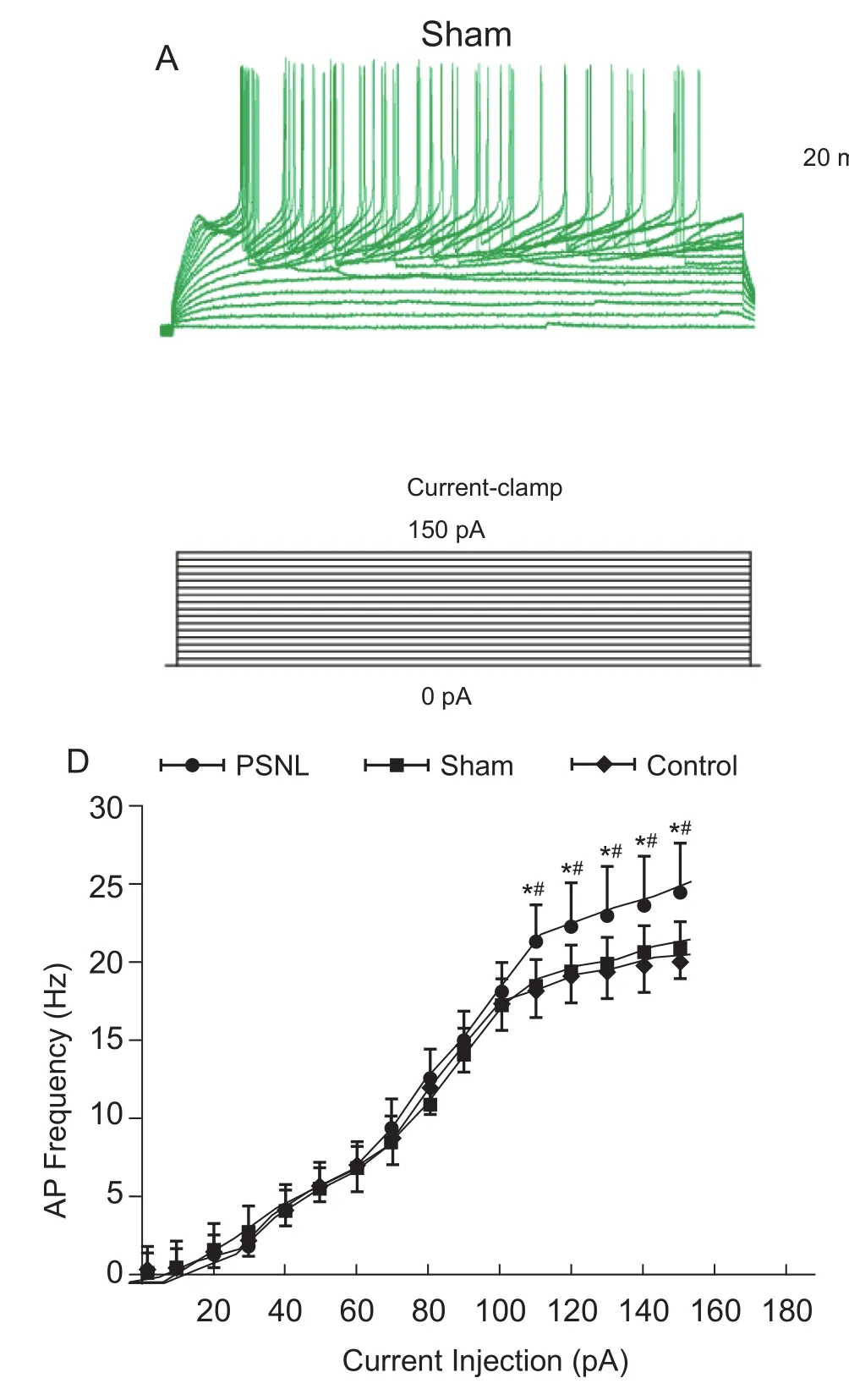

图4 模型组SG神经元动作电位频率(EM)Fig.4 Comparison of the action potential frequency of SG neurons among the model group (EM)
通常情况下,动作电位阈值越低越容易发生去极化,神经元兴奋性就越高。本研究发现,反跳并放电组神经元的动作电位阈值比无反跳组低。PSNL组SG神经元的输入阻抗(Rin)明显高于假手术组,在给予相同的电流刺激时输入阻抗大的神经元会产生更高的电压,会更接近于动作电位阈值,更容易产生动作电位,神经元的兴奋性也就越高。
PSNL模型是经典的神经病理性疼痛模型之一,可导致出现长达7个月的机械痛敏、热痛敏和自发性疼痛。王英伟等人研究发现,6 ~ 8周龄的SD大鼠PSNL模型组术后3~28 d时机械痛阈和热痛阈降低[26],而在本研究中,PNSL术后3天手术侧机械痛阈与假手术组比较,但无统计学意义,可能由于不同周龄的大鼠其行为学特点也有所不同。
本研究通过建立大鼠坐骨神经部分结扎模型,对各组离体脊髓切片的SG神经元进行全细胞膜片钳记录,探讨了慢性疼痛状态下SG神经元的基本电生理特性以及其去极化反跳的表达情况,进一步阐述了调控疼痛的脊髓机理,为临床治疗慢性疼痛的药物研发提供了理论依据。
