裂殖壶菌合成二十二碳六烯酸机理研究进展
2019-08-22金小琬唐嘉淇黄健庭陈天晓杨雪薇黎双飞
杨 浩,金小琬,唐嘉淇,黄健庭,陈天晓,杨雪薇,黎双飞
(深圳大学生命与海洋科学学院,广东省植物表观遗传学重点实验室,广东 深圳 518055)
二十二碳六烯酸(DHA)属于ω-3不饱和脂肪酸家族中的重要成员,含有多个顺式的“戊碳双烯”结构和5个活泼的亚甲基[1]。DHA对人体的生理调节和保健具有重要作用。DHA是大脑细胞膜的重要构成成分,可辅助脑细胞发育,对神经细胞轴突的延伸和新突起的形成有重要作用,能延缓大脑及神经衰老。研究表明,高龄大鼠脑内的DHA水平低于幼龄鼠,随着脑内DHA水平的恢复,高龄大鼠学习与记忆的能力可提高至接近幼龄鼠[2]。此外,DHA还能抑制血小板聚集,使血栓形成受阻、血液黏度下降,改善血液循环,治疗高脂血症、动脉粥样硬化[3]。DHA可以通过抑制类花生酸的生物合成、调控信号传导通路、影响转录因子和基因表达、增强脂质过氧化等方法,抑制细胞内信号传导途径,诱导其分化、凋亡,提高患者的存活率,对多种癌细胞发挥抑制效应[4]。
DHA的主要来源是深海鱼油(金枪鱼油,松鱼油[5])。然而,深海鱼油产品存在一定缺陷:①市售鱼油中的DHA结构属于乙酯型,对于婴儿来说,这种DHA的结构不能被很好吸收与利用[6];②鱼油中DHA与EPA的比例约4∶ 1,该比例能达到最佳的抗动脉粥样硬化效果[7],但不利于婴幼儿的生长发育[6];③产品的鱼腥味让众多消费者难以接受。相比动物来源,从海洋真菌(如破囊壶菌、裂殖壶菌)中获取的DHA具有独特优势:①微藻类与菌类中所获取的DHA均为甘油三酯型,对消化酶的抗性较高,更利于人体吸收利用;②无特殊气味,其安全性较高,其DHA与EPA的比例大于20∶ 1,不会对花生四烯酸产生竞争性抑制,更适合婴幼儿的使用[6]。与微藻相比,通过裂殖壶菌与破囊壶菌高密度发酵既可以提高产量,生长速度也较快,不饱和脂肪酸组成较少,是极具工业前景的DHA来源[8]。
1 裂殖壶菌合成DHA的主要途径研究
1.1 聚酮合成酶(Polyketide synthase,PKS)途径
聚酮合成酶(Polyketide synthase,PKS)途径最早发现于产EPA的海洋细菌ShewanellapneumatophoriSCRC-2378中。随后Mertz等通过同位素标记法,得出DHA和EPA是由一个类似聚酮合成酶的基因簇催化而成的,称为聚酮合成酶(PKS)途径[9]。PKS途径有如下几个阶段:①脂酰-ACP与丙二酸单酰-ACP在3-酮脂酰-ACP合成酶的作用下缩合生成3-酮脂酰-ACP;②3-酮脂酰-ACP在3-酮脂酰-ACP还原酶作用下加氢还原生成3-羟脂酰-ACP;③3-羟脂酰-ACP在烯脂酰-ACP-脱水酶/异构酶的作用下脱去H2O引入双键生成烯脂酰-ACP;④烯脂酰-ACP在烯脂酰-ACP-还原酶(ER)作用下脱氢生成酮脂酰-ACP[10]。裂殖壶菌体内PKS途径合成DHA如图1所示。
目前,部分裂殖壶菌PKS合成途径中的相关基因实现了克隆、重组和外源表达。李清[12]分别对裂殖壶菌OUCl68的pks1和pks2基因进行了克隆,结果表明:pks1基因属于PKS途径8个酶域中的脱水/异构酶(DH);pks2基因整个序列包含两个Ketoacyl-synthase的超家族,一个Acyl transferase超家族,一个TIM_phosphatebinding超家族。周兵兵[13]通过电转化将含有丙二酰转移酶基因的重组质粒转入裂殖壶菌AurantiochytriumlimacinumOUC168,获得了裂殖壶菌pks1基因部分酶域过表达菌株,转化菌株生物量提高14.6%,DHA含量提高37.90%。李志平等[14]对裂殖壶菌Schizochytriumsp.FJU-512酰基载体蛋白(ACP)基因的克隆载体pET-30a/acp,实现了在大肠杆菌中的成功表达。娄菲等[15]研究发现,低温发酵使裂殖壶菌S31的PFA1、PFA2、PFA3基因表达水平增长,促进了PKS途径,提高油脂中不饱和脂肪酸的含量。Huang等[16]对裂殖壶菌的cDNA文库中8 500多个基因进行克隆测序,发现了3个与PKS具有重大相关性的多功能域酶,这些基因以中至高丰度表达。Cheng等[17]克隆了来自Schizochytriumsp.TIO1101的酰基载体蛋白转酰酶(fabD,MCAT,EC2.3.1.39)的cDNA全长,MCAT可以在体外与丙二酰辅酶A结合并催化丙二酰基与ACP结构域结合,生物量和脂肪酸积累分别增长了16.8%和62%。综上所述,通过将裂殖壶菌PKS合成途径中的关键作用酶,如丙二酰转移酶、酰基载体蛋白等基因重组到裂殖壶菌中,可显著提高DHA合成,这为基因工程构建高效合成DHA的优势菌株提供了重要思路。
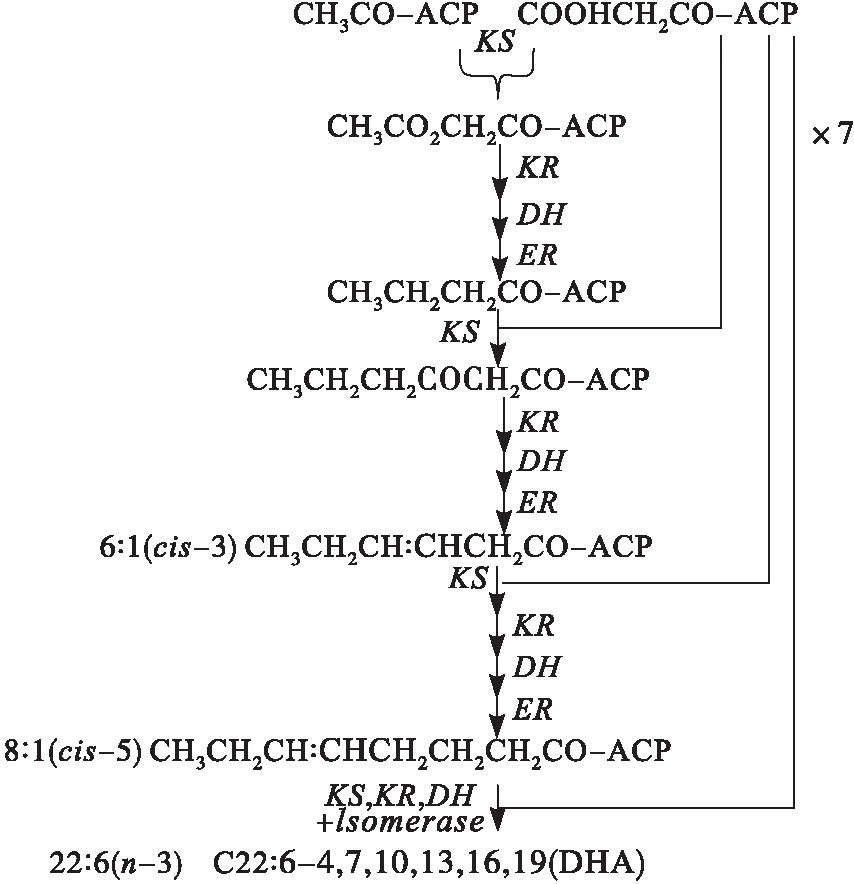
图1 裂殖壶菌体内PKS途径合成DHA示意图[11]
1.2 脂肪酸合成酶(Fatty acid synthase,FAS)途径
脂肪酸合成酶(Fatty acid synthase,FAS)是一个由多种酶构成的多酶复合体,在FAS的作用下,乙酰辅酶A和丙二酸单酰辅酶A经过缩合、还原、脱水、还原的循环,催化合成软脂酸(16∶ 0),以酰基载体蛋白作为延长碳链的共价位点,再经碳链延长酶作用,最终分别形成二十碳四烯酸(ARA)、二十二碳五烯酸(DPA)或二十碳五烯酸(EPA)、DHA等多不饱和脂肪酸[18]。催化脂肪酸生物合成的酶系具有两种类型FASⅠ和FASⅡ,FASⅠ存在于哺乳动物和酵母中,其中全部的酶活性都分别编码在一条多肽链上,每一步脂肪酸合成反应都是由这个大的蛋白的不同功能域催化完成;FASⅡ存在于细菌和植物中,是由一系列小的分离的蛋白组成,每一步脂肪酸合成反应均是由截然不同的单功能酶催化完成的[19]。微生物体内PUFAs的传统脂肪酸合成途径如图2所示。
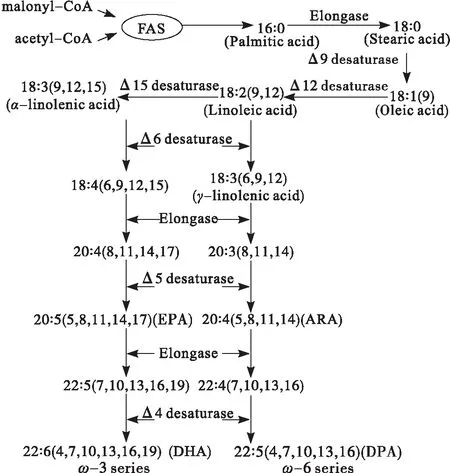
图2 微生物体内PUFAs的传统脂肪酸合成途径(FAS system)示意图[11]
陈伟[20]比较了葡萄糖和甘油两种碳源培养条件下裂殖壶菌S056合成DHA的差异,研究发现甘油为碳源可以使FAS基因过量表达,DHA含量显著提高,增幅达31.75%。程钰蓉等[21]研究发现1 mmol/L的丙酮酸脱氢酶可显著改变Aurantiochytriumsp.SD116的乙酰辅酶A在合成饱和脂肪酸的FAS途径和合成不饱和脂肪酸的PKS途径分配比率,导致不饱和脂肪酸含量下降。Metz等[22]通过对裂殖壶菌的脂肪酸合成酶(FAS)进行基因定点突变,突变株不能合成DHA,只能合成游离的脂肪酸,说明FAS合成酶是裂殖壶菌脂肪酸合成所必需的。综上所述,通过对裂殖壶菌FAS途径中的关键作用酶,如FAS合成酶、乙酰辅酶A、脱饱和酶基因进行外源表达和定点突变,证明了FAS途径是存在于裂殖壶菌中,且能显著影响DHA合成的一种途径。
2 培养条件对裂殖壶菌合成DHA的影响
2.1 营养源对裂殖壶菌合成DHA的影响
2.1.1 碳源
碳源类型与浓度会对裂殖壶菌合成DHA的量产生较大的影响。研究表明,以葡萄糖作为单一碳源时,一定范围内碳源质量浓度的升高(20~80 g/L),促进细胞的生长和总油脂产生,但过高的碳源浓度不利于细胞中总油脂的积累[23]。蒋晓艳[24]研究表明甘油有利于Schizochytriumsp. 20888生物量(4.5 g/L)和总脂(1.5 g/L)增长,葡萄糖则利于DHA(350 mg/L)含量增加。李婧[25]研究表明AurantiochytriumlimacinumSR21以葡萄糖和甘油为混合碳源;混合碳源(初始30 g/L葡萄糖进料,第3天补加40 g/L葡萄糖+10 g/L甘油,第4天补加20 g/L甘油)的DHA发酵效率显著提高,经过5 d发酵,生物量达41.73 g/L,总脂含量63.85%,DHA含量48.51%,DHA 产量达12.93 g/L。裂殖壶菌不能利用多糖和二糖作为碳源;当选择单糖作为碳源时,适当的葡萄糖浓度有利于DHA的积累;甘油也可以作为碳源促进裂殖壶菌的生长和总油脂的积累;采用葡萄糖和甘油作为混合碳源,比单一碳源更有利于DHA的合成。
2.1.2 氮源
氮源类型与浓度会显著影响裂殖壶菌DHA的合成。在培养初期,氮源被大量用于菌体合成,细胞数量迅速增加。当氮源消耗至一定程度时,油脂开始大量积累。过高的初始氮源质量浓度有利于细胞的增殖,生物量会增加,但不利于油脂的合成和DHA的积累[26]。蒋晓艳[24]比较了不同质量浓度的谷氨酸钠对裂殖壶菌Schizochytriumsp. 20888生长及油脂合成的影响,结果表明谷氨酸钠质量浓度为8 g/L时,DHA的累积量最多。康晶等[27]研究发现,当使用玉米糖浆用作Schizochytriumsp.FJU-512的氮源时,DHA含量最高达4.1 g/L,酵母粉或谷氨酸作氮源时,油脂含量最高达15.1 g/L。刘源[23]研究发现,碳氮比过高,不利于脂质和类胡萝卜素的合成;碳氮比过低,有利于生物量和类胡萝卜素含量的提高,但不利于脂质积累,且DHA的比例较低。由此可知,氮源种类对DHA的积累影响显著,以有机氮源如谷氨酸钠、玉米糖浆、酵母粉作为氮源可促进油脂的合成;此外,碳氮比也会显著影响脂质和类胡萝卜素的合成。
2.2 温度
温度对调控裂殖壶菌胞内代谢及DHA合成有显著影响。温度从20℃升高到30℃,裂殖壶菌菌体生长良好;油脂含量在20~30℃之间呈先升高后下降的趋势,但均高于15℃时的水平。37℃下菌迅速衰亡,且油脂含量也较低[28]。王澍等[26]研究发现,采取双阶段控温,菌种在26℃下培养48 h后,再将发酵温度降到22℃培养120 h,DHA含量为43.62%,相对26℃条件下提高7.6%。娄菲等[15]发现,将温度升高至30℃将降低裂殖壶菌S31 DHA含量,FAS基因的转录水平高于PKS基因的转录水平; 将发酵温度降低至20℃将增加其DHA含量,PKS基因的转录水平显著高于FAS基因的转录水平。综上可知,低温能促进微生物合成不饱和脂肪酸,这是因为低温能增加氧的可溶性,产生大量胞内分子氧,同时关键酶活性增强,有利于需氧参与的长链脂肪酸的去饱和作用。由于微生物培养前期主要是其增殖期,菌体快速生长,后期是油脂积累过程,两个阶段可以用不同的温度控制,以达到最佳发酵目的。
2.3 无机盐及微量元素
无机盐作为微生物生长繁殖过程中较为重要的营养物质,在构成酶活性中心组分、维持细胞形态和氧化还原电位等方面具有重要作用。除了对磷、硫、镁、钾等的正常需求以外,裂殖壶菌作为海洋微生物,对氯化钠的需求及含量相对较为敏感。类海水环境的氯化钠质量浓度20 g/L,利于菌体的生长和 DHA 的积累[20]。渗透胁迫对裂殖壶菌发酵产DHA的性能影响较大[29],研究表明20 g/L NaCl最有利于裂殖壶菌HX-308细胞生长和DHA积累。裂殖壶菌产DHA需要比较适中的渗透压环境,过高或过低都不利于裂殖壶菌发酵产DHA。在培养基中适量添加 Mn2+、Zn2+、CO2+对裂殖壶菌的生长速度和 DHA 的累积有显著促进作用[30],通过调节微量元素组合(MnCl2·4H2O 32 mg/L;ZnSO4·7H2O 30 mg/L;CoCl2·6H2O 1.2 mg/L),裂殖壶菌生物量提高了61.38%,DHA含量提高了47.85%。综上所述,渗透胁迫及无机盐的添加能显著影响裂殖壶菌的细胞生长和DHA合成。
2.4 其他前体物质或促进剂
多不饱和脂肪酸合成的前体物质及促进剂对裂殖壶菌DHA合成的促进作用显著。Yokochi等[31]研究发现SchizochytriumlimacinumSR21能够利用油酸和亚麻籽油之类的前体物质进行细胞的生物量及油脂积累。王申强等[32]研究表明,同时添加0.3 mg/L生物素、1 g/L 苹果酸、0.4 mg/L洛伐他汀时,能够显著提高裂殖壶菌发酵产DHA的产量。在适宜的浓度下,细胞分裂素6-苄基腺嘌呤(BA)和糠基腺嘌呤(KT),赤霉素(GA),以及植物生长素吲哚丁酸(IBA)、萘乙酸(NAA)和吲哚乙酸(IAA)对裂殖壶菌生物量和DHA含量都有不同程度的促进作用,其中BA对DHA合成影响最大,而KT促进作用最不明显[33]。维生素的添加对裂殖壶菌发酵产DHA的量有一定的影响,研究发现:VB12对菌体内油脂含量和油脂内DHA含量影响较大,对生物量没有明显影响;VB1对菌体生物量影响较大,对菌体内油脂含量和油脂内DHA含量没有明显影响;VB6和VB3则对这三者都有明显影响[34]。综上所述,通过添加棕榈油、油酸、亚麻籽油等DHA前体物质或者适量的促进剂(BA、KT、GA等),对裂殖壶菌DHA含量有促进作用。
3 裂殖壶菌基因组或转录组研究
3.1 裂殖壶菌基因组测序
基因组测序是对未知基因组序列的物种进行个体的基因组测序,即是分析包括编码序列和非编码序列在内的全部DNA分子的碱基序列,可以确定重组DNA的方向与结构,对突变进行定位、鉴定和比较研究。第一代测序技术从固定的引物组合成DNA,并在特定碱基处终止其随机合成,以获得分别以A、C、T和G结尾的不同长度的一系列核苷酸,但该操作烦琐且昂贵,并且不能满足大规模测序的需要。第二代测序技术以焦磷酸测序为例,有着高通量、低成本的优点。通过在由4种酶(TP硫酸化酶,DNA聚合酶,腺苷三磷酸双磷酸酶和荧光素酶)组成的相同催化反应系统中进行酶联发光反应,对已知的短序列进行测序分析。基于纳米孔水平的单分子阅读平台的第三代测序技术每次可以读取数百万个序列。因此,就测序读取长度而言,第三代测序技术从第一代和第二代测序技术迈出了一大步,但其尚未被广泛使用[35-36]。在基础生物学研究及应用领域(如微生物学、合成生物学、生物系统学),基因组测序已成为不可缺少的手段。
目前进行基因组测序的裂殖壶菌及获得的与脂肪酸合成相关结果如表1所示。
综上所述,通过研究裂殖壶菌全基因组可明晰DHA的生物合成途径及关键酶基因,为研究DHA的形成和调节机制提供重要依据,为高效合成DHA及基因工程改造菌株奠定理论基础。
3.2 裂殖壶菌转录组测序
转录组测序是通过新一代高通量测序技术,得到特定细胞在某一状态下转录出的所有RNA序列信息。转录组研究是基因功能及结构研究的基础和出发点,是研究基因表达的主要手段,同时也是连接基因组遗传信息与生物功能的蛋白质组的重要纽带。转录水平的调控是目前研究最多的,也是生物体最重要的调控方式。目前用于研究转录组的方法主要包括:①基于杂交的方法,如cDNA芯片,寡核苷酸芯片等;②基于测序技术,如Sanger测序的SAGE(Serial analysis of gene expression)和MPSS(Massively parallel signature sequencing),全长cDNA文库和EST(Expressed sequence tag)文库测序分析;③RNA-Seq是第二代测序技术。与其他测序技术相比具有以下优点:高通量,通过转录组测序技术,不仅可以获得数个甚至数十亿个碱基序列,而且可以实现覆盖所有转录组的要求;高分辨率,转录组测序技术可以高精度地区分单碱基,可以有效避免微阵列杂交的荧光模拟信号引起的背景噪声,交叉反应等问题;高灵敏度,这种测序技术可以检测细胞中稀有转录物的稀有拷贝[45]。
目前进行转录组测序的裂殖壶菌及获得的与脂肪酸合成相关结果如表2所示。
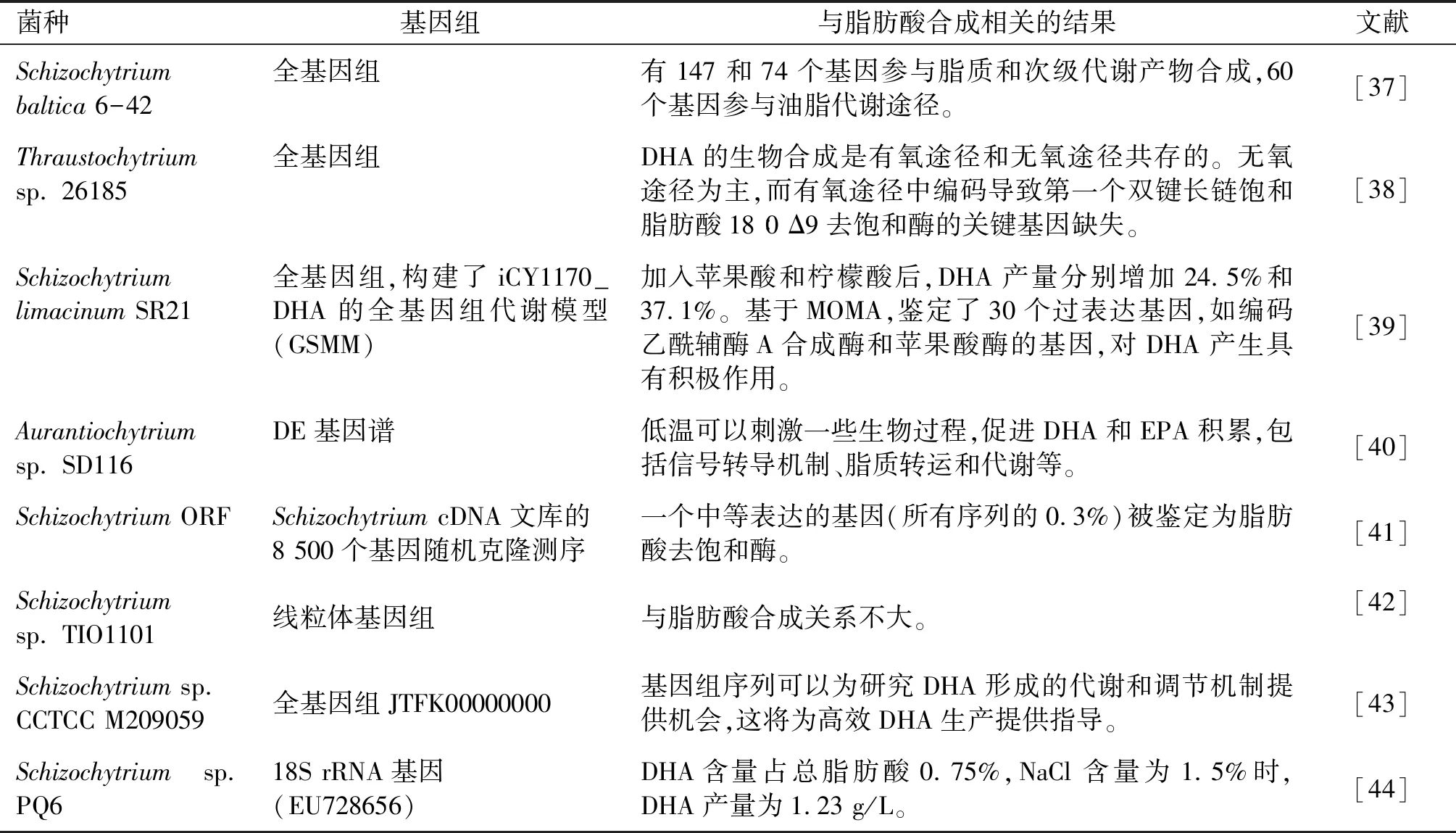
表1 进行基因组测序的裂殖壶菌及获得的与脂肪酸合成相关结果
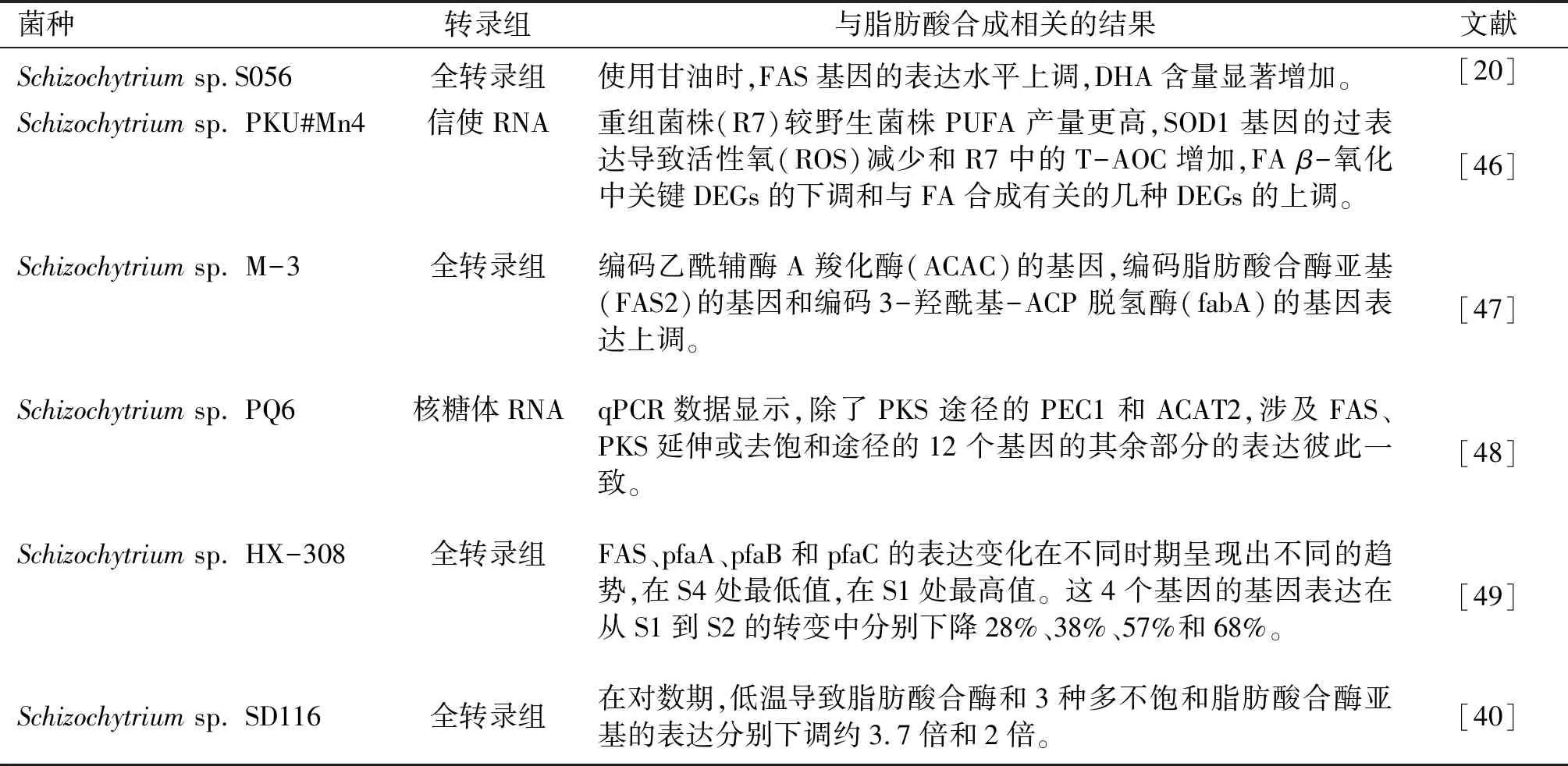
表2 进行转录组测序的裂殖壶菌及获得的与脂肪酸合成相关结果
综上所述,目前对不同限制条件下的菌株进行转录组测序发现,DHA合成关键酶基因的上调(FAS基因,编码乙酰辅酶A羧化酶基因等)或下调(脂肪酸合酶,3种多不饱和脂肪酸合酶亚基等)都会对DHA合成产生显著影响。
4 结束语
裂殖壶菌合成DHA主要有聚酮合成酶(Polyketide synthase,PKS)途径和脂肪酸合成酶(Fatty acid synthase,FAS)途径。通过基因工程技术,使DHA合成途径中的关键酶基因在裂殖壶菌中过表达可促进DHA合成;培养条件的优化,如碳源、氮源、碳氮比、温度、渗透压、微量元素、前体物质及促进剂等对DHA的合成影响显著;利用生物信息学技术如基因组和转录组测序,为明晰裂殖壶菌DHA的生物合成途径及关键作用酶提供了重要的数据支撑,为构建基因工程藻株奠定了理论基础。近年来,DHA的需求逐年增加,DHA相关产品市场潜力巨大。但我国企业存在产能低下,产品纯度不高,国际竞争力较低等瓶颈问题。当下,我们除了优化高密度发酵参数以外,也要关注优良菌种的选育,从源头上解决我国DHA纯度低、难分离、高成本的现象。
