猪源大肠杆菌floR、CTX-M、mcr-1耐药基因多重PCR检测方法的建立
2019-08-22李金磊申水莹杨鹏霞李慧素吴志明
李 孟,李金磊,申水莹,杨鹏霞,彭 丽,李慧素,吴志明∗
(1.河南农业大学牧医工程学院,郑州450002;2.河南省兽药饲料监察所,郑州450008)
猪大肠杆菌病在我国许多地区的猪场都有发生,是严重危害仔猪安全的重要传染病之一[1]。近些年来,猪源大肠杆菌对氟苯尼考的耐药性问题日益严重,有报道指出氟苯尼考的耐药率有增加的趋势[2];其耐药机制的研究主要集中在 floR基因上[3],而且floR基因在革兰氏阴性菌之间广泛传播。产超广谱β内酰胺酶(ESBLs)是细菌对β内酰胺类抗生素产生耐药的主要机制[4],近年来,CTX-M型ESBLs已经取代传统的TEM型和SHV型成为全球流行最广的ESBLs[5]。我国学者刘艺云等[6]首次报道了大肠杆菌对粘杆菌素的耐药基因mcr-1,引起了国内外研究人员的高度关注,报道称mcr-1基因已经在我国畜禽源大肠杆菌中广泛存在,并且有沿食物链传递,从而危害食品安全和人类健康的风险。
氟苯尼考、头孢噻呋、粘杆菌素作为养猪场临床常用的抗菌药物,其耐药性问题不容忽视。目前,国内外报道的大肠杆菌耐药基因检测方法主要以大肠杆菌对同一类药物的不同耐药基因的多重PCR为主,尚无针对大肠杆菌对不同药物的耐药基因建立的多重PCR检测方法。
本研究结合临床常用抗菌药的使用情况,建立大肠杆菌floR、CTX-M、mcr-1耐药基因多重PCR的检测方法,能为大肠杆菌耐药基因的快速检测提供新的检测技术,为耐药基因的分子流行病学调查提供技术手段,为猪源大肠杆菌耐药性的风险评估和临床用药提供科学依据,从而为保障食品安全、公共卫生安全和生态环境安全提供技术支撑。
1 材 料
1.1 菌株 FloR、CTX-M、mcr-1 基因阳性菌株(已测序鉴定),大肠杆菌标准菌株ATCC25922,鼠伤寒沙门氏菌标准菌株、金黄色葡萄球菌标准菌株、单核细胞增生李斯特氏菌标准菌株、志贺氏菌标准菌株、肠炎沙门氏菌标准菌株、粪肠球菌标准菌株均为河南省兽药饲料监察所实验室购买保存。
1.2 培养基与试剂 LB肉汤、菌落计数培养基,购自北京陆桥技术股份有限公司;细菌DNA提取试剂盒,购自天根生化(北京)有限公司;PCR预混酶(2×Flash Hot Start MasterMix,货号:CW3007M,批号:20347),细菌基因组DNA提取试剂盒(货号:CW0552,批号:00021304),购自北京康为世纪生物科技有限公司;50×TAE、溴化乙锭,购自索莱宝生物科技有限公司;琼脂糖,购自西班牙BIOWEST公司。
1.3 主要仪器设备 PCR扩增仪,购自美国Applied Biosystems公司;凝胶电泳仪,购自美国Bio-Rad公司;凝胶电泳成像系统,购自Alphainnotech Corporation公司;电子天平(BS2002S),购自北京赛多利斯仪器公司;生物安全柜,购自美国Thermo公司;离心机,购自德国Sigma公司;水浴锅,购自金坛市医疗仪器厂;电冰箱,购自青岛海尔股份有限公司;超低温冰箱,购自美国Thermo公司;纯水仪,购自Milipore公司;恒温培养箱,购自上海一恒科技有限公司;浊度仪,购自无锡市光明浊度仪厂;立式自动压力蒸汽灭菌锅,购自日本三洋公司。
2 方 法
2.1 引物设计 根据GenBank提供的CTX-M、mcr-1、floR基因及其亚型基因序列,利用DNAStar软件进行同源性分析,确定每个基因同源性高的保守区域作为耐药基因的扩增靶序列,用 Primer Premier 5.0软件进行引物设计,引物交由生工生物工程(上海)股份有限公司进行合成。引物序列及预期扩增片段长度见表1。

表1 引物序列及扩增片段长度Tab 1 Primer sequence and amplified fragment length
2.2 大肠杆菌模板DNA的制备 参照试剂盒说明书提供的步骤,利用细菌基因组DNA提取试剂盒,提取大肠杆菌基因组DNA,-20℃冰箱保存备用。
2.3 单基因PCR的扩增及测序 选用耐药基因阳性对照菌株模板DNA作为扩增模板,参照常规PCR标准添加量,根据引物的TM值、GC含量等参数,初步确定floR、CTX-M、mcr-1单基因PCR扩增体系及条件,将PCR产物送至生工生物工程(上海)股份有限公司进行测序,并将测序结果与Gen-Bank上公布的序列进行同源性比较。
2.4 多重PCR方法条件优化
2.4.1 引物浓度优化 以阳性菌株为模板,各组分浓度和参数均参照常规多重PCR反应的一般原则,在单重PCR基础上,为了取得引物最佳组合浓度,在预实验基础上按三因素五水平L25(53)设计正交实验表,选取扩增效果较好的一组引物浓度组合,初步确立多重PCR扩增体系。正交实验方案见表2。
2.4.2 退火温度优化 在优化引物组合的基础上,进行退火温度优化。将退火温度分别设置为51℃、52℃、53℃、54℃、55℃、56℃、57℃、58℃、59℃、60℃进行PCR扩增,扩增产物用1.5%浓度的琼脂凝胶进行电泳,用凝胶成像系统对扩增结果进行分析。
2.4.3 循环次数优化 在优化好退火温度的基础上,将循环次数分别设置为为30次、31次、32次、33次、34次、35次进行 PCR扩增,扩增产物用1.5%浓度的琼脂凝胶进行电泳,用凝胶成像系统对扩增结果进行分析。
2.5 多重PCR方法的验证
2.5.1 多重PCR特异性实验 分别以阳性对照菌株、大肠杆菌标准菌株、鼠伤寒沙门氏菌标准菌株、金黄色葡萄球菌标准菌株、单核细胞增生李斯特氏菌标准菌株、志贺氏菌标准菌株、肠沙门氏菌标准菌株、粪肠球菌标准菌株,进行多重PCR的扩增,观察PCR结果特异性。
2.5.2 多重PCR敏感性实验 选取10株FloR、CTX-M、mcr-1基因阳性的分离菌株(已经检测证实),进行多重PCR的扩增,扩增产物用1.5%浓度的琼脂凝胶进行电泳,观察多重PCR敏感性。
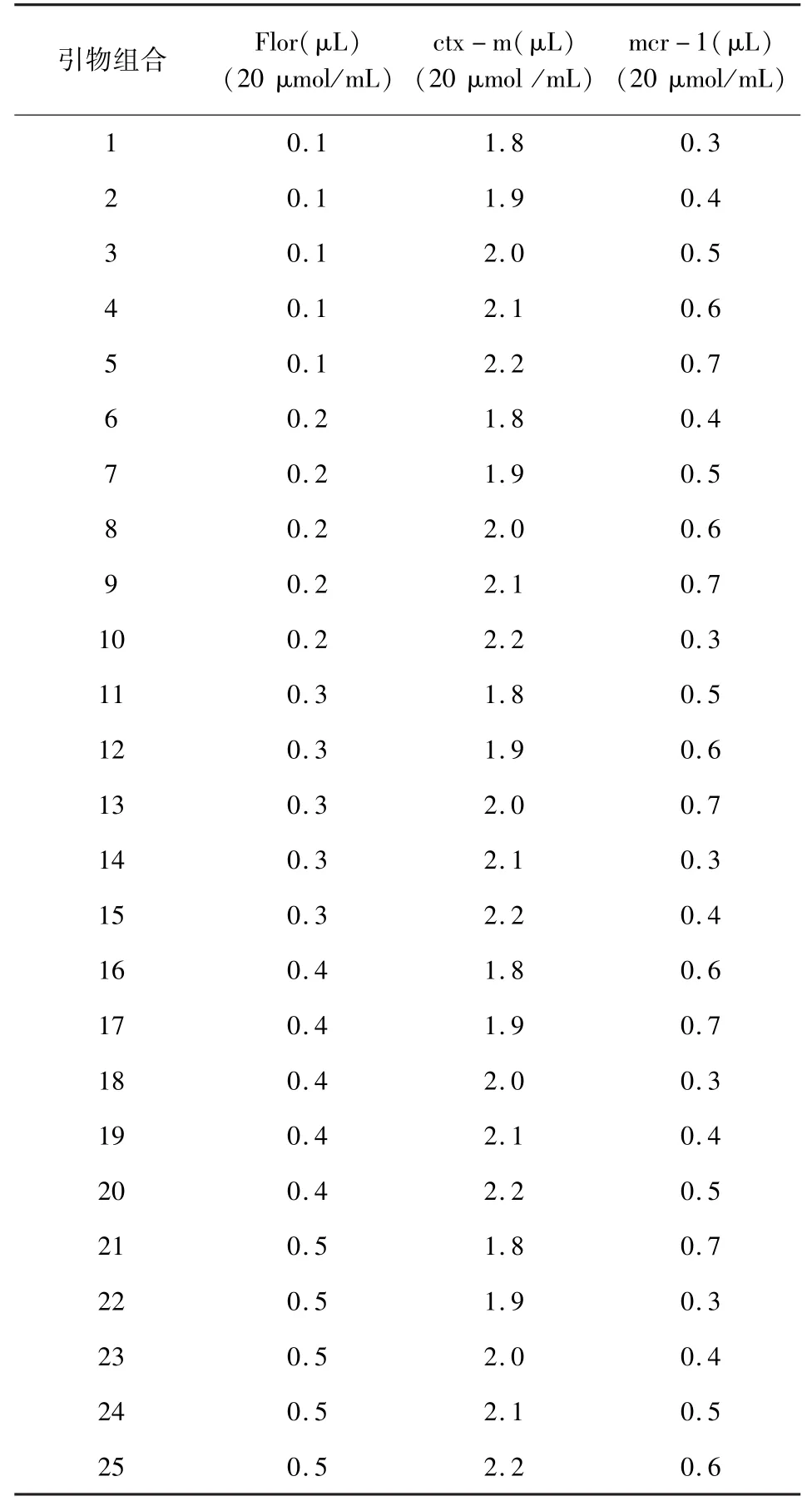
表2 引物正交试验方案Tab 2 Primer orthogonal test protocol
2.5.3 多重PCR灵敏度实验 将阳性对照菌株接种于LB肉汤,37℃过夜培养,调节菌液浓度至0.5 MCF,然后用无菌生理盐水将菌液递增稀释至10-8浓度,分别取1 mL稀释菌液制备扩增模板,用多重PCR方法进行PCR检测。同时,选取10-6~10-8稀释液,取1 mL涂布于菌落计数培养基。根据平板菌落计数结果和多重PCR检测结果,确定多重PCR灵敏度。
2.5.4 多重PCR重复性实验 用同批PCR反应试剂,分别在不同时间(间隔7 d)、不同操作条件(包括PCR仪、操作人员)下对同一批阳性菌株(已测序鉴定)检验批内重复性检测。
分别用3个不同批次的PCR反应试剂,对同一批次阳性菌株(已测序鉴定)进行批间重复性检测。
2.5.5 多重PCR符合性实验 随机选取80株猪源大肠杆菌(已分离鉴定),同时采用已发表的Flor[2]、CTX-M[7]、mcr-1[6]基因 PCR 检测方法与本文建立的多重PCR方法进行耐药基因的检测,对检测结果进行比较分析,检验多重PCR的符合性。
2.6 对临床大肠杆菌样品的检测 用优化好的多重PCR方法对河南部分地区猪源大肠杆菌样品进行检测(为了方便对大量临床样品的检测,进行了试剂盒提取样品DNA模板、煮沸法提取DNA、菌液PCR和菌落PCR等提取方法对检测结果影响的对比试验)。
3 结果与分析
3.1 单基因PCR扩增和测序结果 根据2.3提供的方法进行单基因PCR扩增,最终在预期目的条带附近都能扩增出单一目的条带。其中退火温度的优化结果为:floR基因最佳退火温度为57℃,可变范围为51℃ -60℃;CTX-M基因的最佳退火温度为57℃,可变范围为53℃ -60℃;mcr-1基因的最佳退火温度为56℃,可变范围为53℃ -59℃;对3个目的基因片段进行测序,分别进行序列比对分析,结果证明扩增片段均为目的基因的片段。
3.2 多重PCR方法条件优化
3.2.1 引物浓度优化结果 按照 2.4.1 的方法,将3对引物进行组合后进行PCR扩增,结果如图1。结果显示,组合13的扩增效果最好,即floR、CTX-M、mcr-1 的添加量分别为 0.3、2、0.7 μL时,扩增效果最好。
3.2.2 退火温度优化结果 根据2.4.2 的方法调整退火温度,用凝胶成像系统对扩增结果进行分析,见图2。结果显示,在55℃ ~58℃均能进行高效的扩增,最终,选取57℃为最佳退火温度。
3.2.3 循环次数优化结果 根据 2.4.3 的方法,在退火温度优化完毕的基础上,进行循环次数的优化,循环次数优化结果,见图3。根据结果,在33次、34次、35次循环时均有比较好的扩增结果,结合扩增时间双重条件,选择34次循环为最佳循环次数。
根据全部优化结果最终确定多重PCR反应体系,见表3。
3.3 多重PCR方法验证
3.3.1 多重 PCR 特异性实验结果 按照2.5.1 所述的方法,对上述菌株进行PCR扩增,结果见图4。图中可以看出,只有阳性菌株扩增出了3条特异性目的条带,其他标准菌株的模板均没有扩增出来。说明本方法具有很高的特异性。
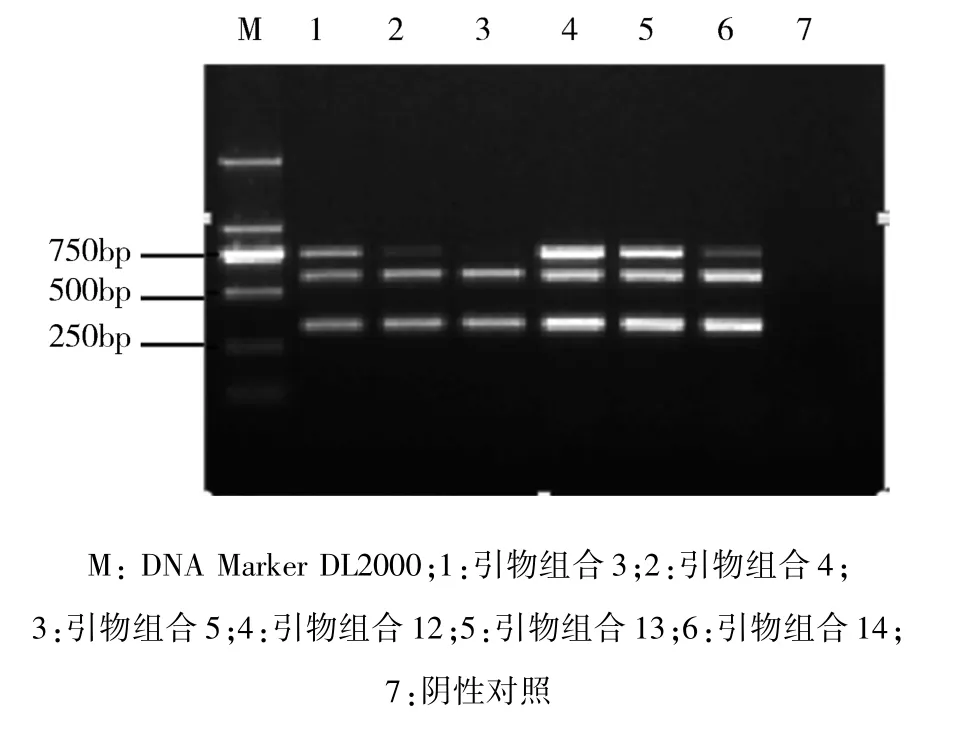
图1 部分引物组合的PCR产物凝胶电泳结果Fig 1 PCR product electrophoresis results of partial primer combinations

图2 不同退火温度的PCR产物凝胶电泳结果Fig 2 Results of gel electrophoresis of PCR products at different annealing temperatures
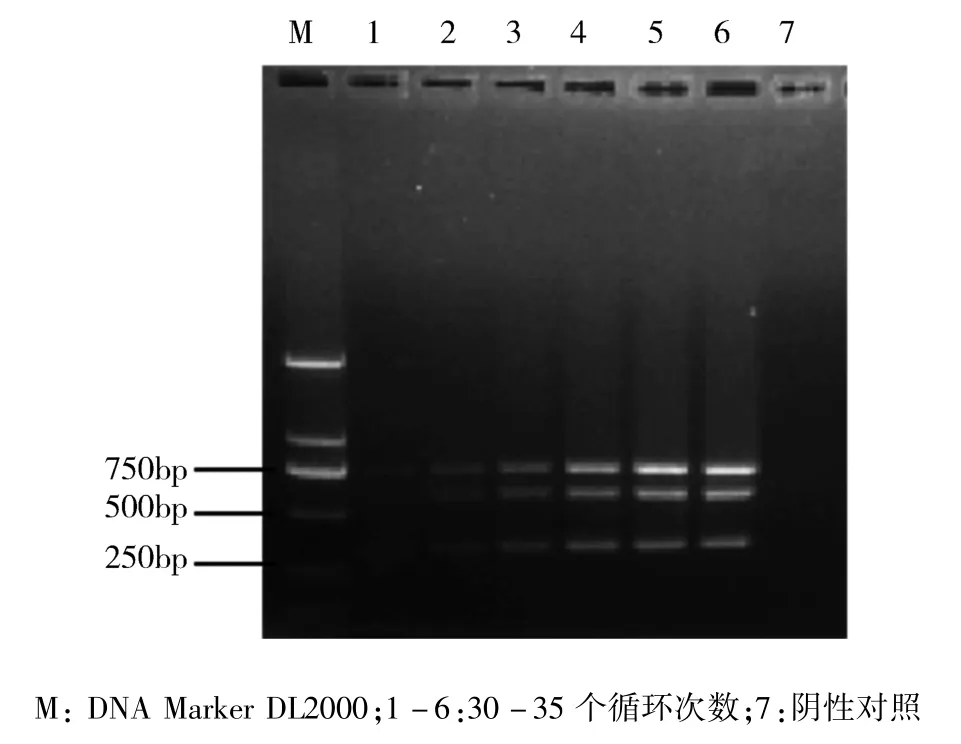
图3 不同循环次数的PCR产物凝胶电泳结果Fig 3 Results of gel electrophoresis of PCR products with different cycle times
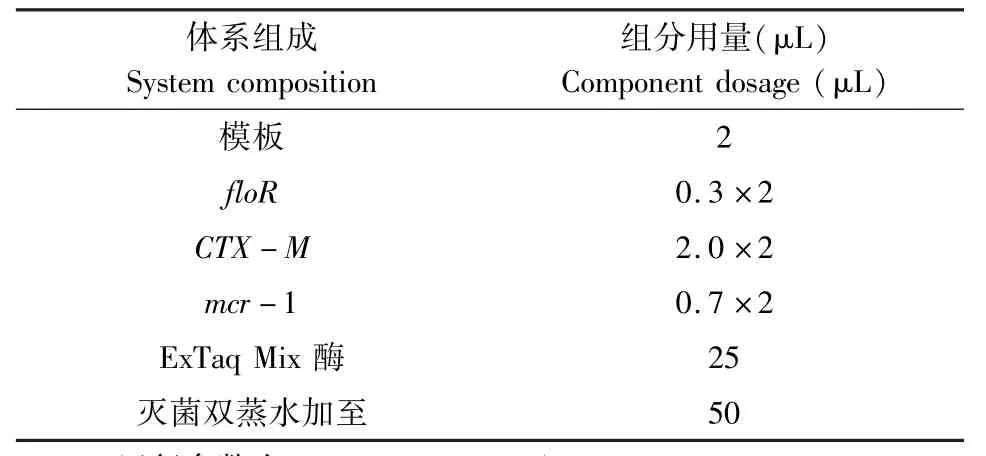
表3 多重PCR扩增体系Tab 3 Multiplex PCR amplification system
3.3.2 多重 PCR 敏感性实验结果 根据2.5.2 所述的方法,对实验菌株进行PCR扩增,结果见图5。结果显示,10株已知floR、CTX-M、mcr-1基因阳性的分离菌株,均能扩增出3条特异性条带。说明本方法具有很高的敏感性。
3.3.3 多重 PCR 灵敏度实验结果 按照2.5.3 所述的方法进行实验,平板菌落计数结果表明,在10-6稀释度时,平板上长有146个菌落,由此可以得出0.5 MCF 的原菌液浓度为1.46 ×108CFU/mL;多重PCR实验结果(见图6)表明,在10-3稀释度时仍能扩增出3条特异性条带,此时的菌液浓度为1.46×105CFU/mL,即平均每毫升PCR反应体系中有1.46×105个细菌存在时,3个耐药基因全部能够被检测出来,说明本方法具有很好的灵敏度。
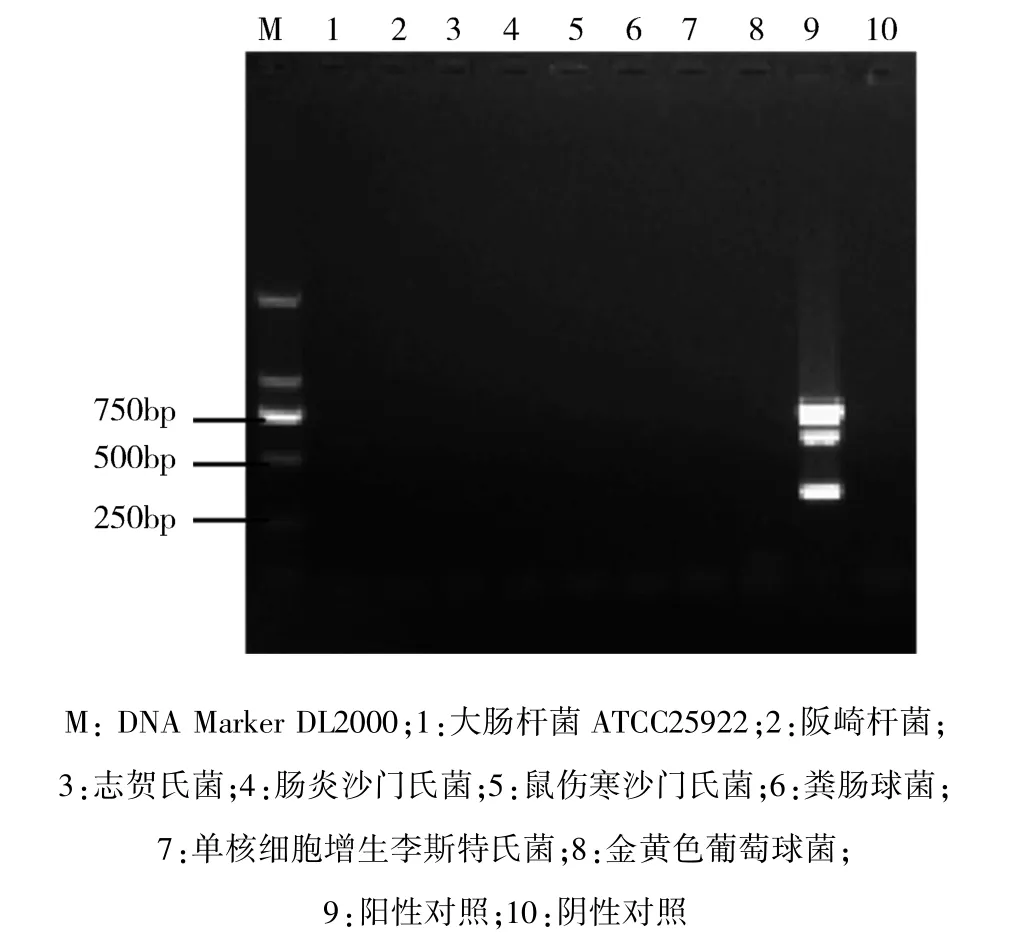
图4 特异性实验电泳图Fig 4 Specific experimental electropherogram
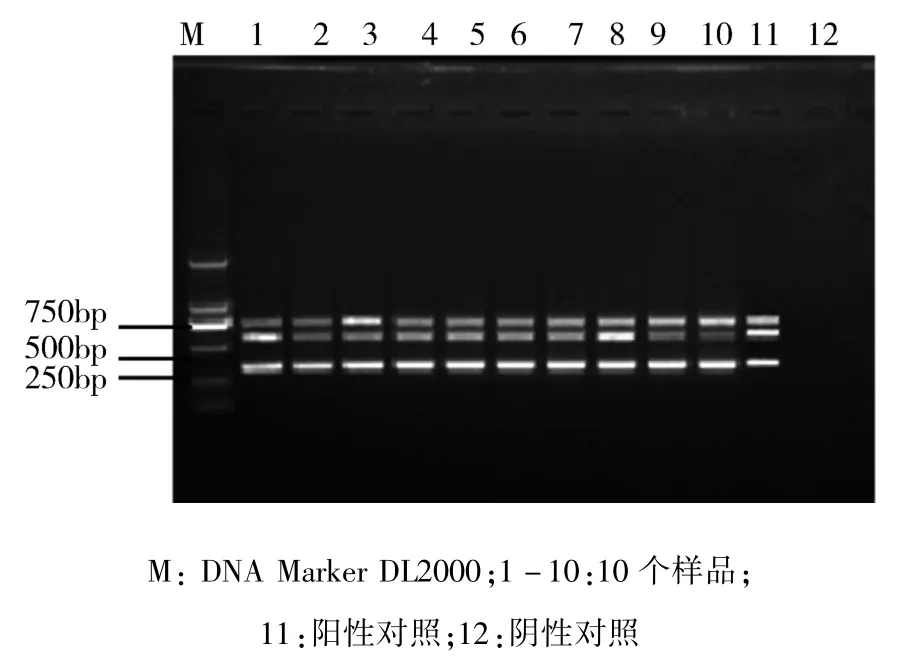
图5 敏感性实验电泳图Fig 5 Sensitivity experiment electropherogram
3.3.4 多重 PCR 重复性实验结果 根据2.5.4 的方法,进行批间和批内重复性实验,结果分别见表4和表5,结果显示,批间和批内重复性结果均一致,说明本方法具有良好的重复性。
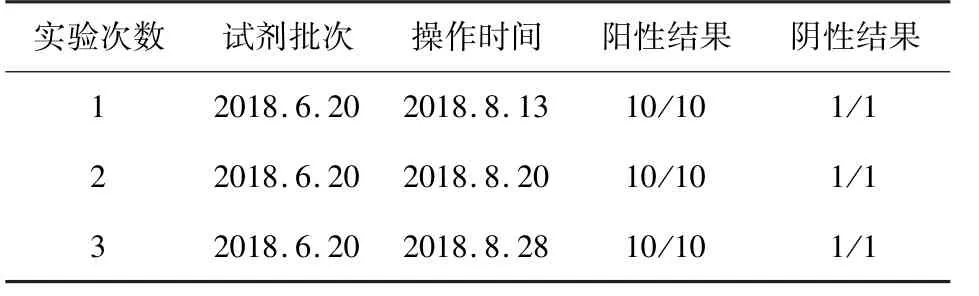
表4 批内重复性试验结果Tab 4 Repetition test result of within the batch

图6 灵敏度实验电泳图Fig 6 Sensitivity experimental electropherogram

表5 批间重复性试验结果Tab 5 Repetition test result of in batches
3.3.5 多重 PCR 符合性实验结果 根据2.5.5 的方法对80株分离菌进行PCR的扩增,比较单重PCR和本文建立的多重PCR结果,得出如下结果:floR基因有2个样品结果不一致(符合率为97.5%);CTX-M有2个样品的结果不一致(符合率为97.5%);mcr-1有1个样品的结果不一致(符合率为98.8%)。符合率均为98%左右。
3.4 对临床大肠杆菌样品的检测 用优化好的多重PCR方法对河南部分地区的猪源大肠杆菌进行检测(经过不同提取方法对检测结果影响的对比发现,菌液PCR和菌落PCR均有良好的检测结果,鉴于菌液PCR和菌液PCR更方便快捷,本文在检测临床样品时选取菌液PCR的方法),调查了该地区100株猪源大肠杆菌分离株的floR、CTX-M、mcr-1基因的携带情况,进一步验证了该方法的实用性。检测结果表明,floR基因检出率为75.0%,CTX-M检出率为18.0%,未检出mcr-1基因。
4 讨论与结论
目前在耐药基因的检测方面,主要还是以单重PCR检测为主,单重PCR每次只能检测一种耐药基因,耗时费力,而目前建立的多重PCR方法,也多以同一类药物耐药基因的检测为主,如田国宝等[8]建立的三重PCR检测方法,针对的是大肠杆菌β-内酰胺酶的耐药基因blaTEM、blaSHV、blaCTX-M。本研究更好的结合临床药物使用情况,选取临床常用抗生素的主要耐药基因,建立了多重PCR检测方法,为临床上筛选大肠杆菌的敏感抗生素提供技术支撑。
本研究中对临床样品的检测结果显示,floR基因检出率为75.0%,这一结果与包义斐[9]2017年的研究结果相吻合,说明河南地区对氟苯尼考的耐药性严重;本研究中CTX-M的检出率为18.0%,与杨守深等[10]在福建地区的18.0%的检出率结果一致;随着农业农村部2016年公布的2428号公告的实施,禁止硫酸粘杆菌素作为饲料添加剂用于促进动物生长使用,本研究中并未检出大肠杆菌对粘杆菌素的耐药基因mcr-1。
需要指出的是,本研究建立的多重PCR检测方法是基于我国目前兽医临床用药习惯以及各耐药基因流行特点设计的,随着抗生素的继续使用,可以预见我国的动物源大肠杆菌耐药基因也会随之发生改变。因此,研究人员有必要持续跟踪耐药基因的分子流行病学变化,以及临床用药习惯的改变,适时调整PCR检测方法的靶基因和各反应体系参数,使之能更准确有效的服务于临床。
通过对PCR条件的优化,建立了猪源大肠杆菌中对临床常用药物氟苯尼考、头孢噻呋、粘杆菌素的主要耐药基因floR、CTX-M、mcr-1的多重PCR检测方法,经验证,该方法灵敏度为1.46×105CFU/mL,并且具有较高的特异性、稳定性。
