实时剪切波弹性成像联合超声评分在原发性干燥综合征腮腺受损诊断中的价值
2019-08-22王娇娇刘升云齐清华
王娇娇,张 磊,刘升云,马 笑,齐清华,董 刚
(郑州大学第一附属医院,河南 郑州 450052)
原发性干燥综合征 (primary Sjogren’s syndrome,pSS) 是第二常见的慢性自身免疫性疾病,主要累及外分泌腺, 并以细胞和体液自身免疫反应为特征, 主要临床症状和体征是口干症和干燥性角膜结膜炎[1]。 好发于中年女性,本病我国患病率为0.29%~0.77%[2],该病起病隐匿,症状缺乏特异性,因而经常出现漏诊、误诊现象,严重时危及患者生命,早期诊断极为关键。目前公认的诊断标准是2002 年欧美国际联盟(AECG)诊断标准[3],包括口腔及眼部症状、眼部体征、组织学检查、自身抗体检查及唾液腺受损, 目前常用评估唾液腺受损的方法包括唾液腺流率、 涎腺核素显像、 唇腺活检等, 这些检查对于pSS 的诊断灵敏度及特异度较低, 且大多为有创性检查,单独使用评估唾液腺受累准确性低[4]。 超声作为一种重要的无创性影像工具,在SS 诊断和病情评估中发挥着越来越重要的作用。 本研究旨在对腮腺进行超声检查及实时剪切波弹性成像(RT-SWE)评估腮腺的回声及硬度情况, 观察并比较pSS 与非pSS 患者腮腺回声均匀程度及腮腺硬度的差异,探讨腮腺超声半定量评分方法联合RT-SWE 诊断pSS的价值。
1 资料与方法
1.1 研究对象
选择 2017 年 1 月 1 日—2018 年 9 月 1 日郑州大学第一附属医院风湿免疫科门诊或住院的有口干、眼干症状疑诊干燥综合征患者140 例入组,所有患者均为女性, 均无自身免疫性疾病病史。 根据2002 年国际诊断标准[3],将患者分为 pSS 组 76 例,年龄 23~78 岁,平均(49.8±12.2)岁,非 pSS 组 64例,年龄 25~71 岁,平均(49.2±11.8)岁。 排除标准:①任意一侧腮腺肿瘤病史或手术史; ②腮腺急性或慢性炎症;③涎石症病史;④头颈部放疗史;⑤活动性丙型肝炎病毒感染(由PCR 确认);⑥艾滋病;⑦结节病;⑧淀粉样变性;⑨移植物抗宿主病;⑩IgG4相关性疾病;⑾抗乙酰胆碱药的应用。所有受检者在检测前均签署知情同意书。
1.2 仪器与方法
采用 Supersonic Imagine Aix-Plorer 型 Shear Wave TM 诊断仪,SL15-4 线阵探头,频率 4~15 MHz,配备在线RT-SWE 软件,自带Thyroid 条件。检查时嘱患者仰卧,充分暴露颈部,脸偏向对侧,平静呼吸,获得腮腺长轴和短轴切面观察内部图像。 之后于长轴切面时转换为SWE 模式,探头轻放且垂直于皮肤表面,嘱患者放松颈部肌肉、屏住呼吸,待SWE 取样框(取样框置于腺体中央,大小约为1 cm×1 cm)内颜色完全充填并稳定3 s 后定帧, 并进行测量。 将Q-Box 置于取样框的中心,避开明显的血管,设置取样直径约为3 mm,分别测量两侧腮腺中部的杨氏模量值,测量5 次,取平均值。
1.3 主观评分
由两名有经验的超声医师分别对腮腺脱机图像独立分析,涎腺声像图表现评分标准[5-6]:0 分:正常腺体, 回声均匀, 回声强度与甲状腺相当或更高;1分: 回声轻度不均匀, 小低回声区, 无高回声线;2分: 回声中度不均匀, 弥漫分布的低回声结节,直径<2 mm,伴少量高回声线;3 分:明显不均匀,多发低回声增大融合,直径2~6 mm,伴高回声线;4 分:低回声结节直径>6 mm,或腺体萎缩,多发高回声带呈网络状,可伴有末梢导管囊状扩张。双侧腺体评分为0~4 分,两名医师评分不一致时,由上级医师会诊获得统一意见后做出最后评分。 两侧腮腺的评分分值范围为0~4 分。 左右侧腺体评分不一致时,以高分侧评分为最终评分。
1.4 超声评分联合RT-SWE 诊断pSS 标准
超声评分与RT-SWE 诊断pSS 不一致时,当超声评分低于诊断界值,杨氏模量值大于界值时,超声评分+1;当超声评分高于诊断界值,杨氏模量值小于诊断界值时,超声评分不变。
1.5 统计学分析
采用SPSS 21.0 统计学软件, 计数资料年龄比较采用独立样本t 检验; 杨氏模量值计量资料服从正态分布且方差齐,计量资料以表示,组间均数比较采用t 检验,绘制超声评分、RT-SWE 以及二者联合诊断pSS 患者腮腺受损的ROC 曲线, 应用MedCalc 软件计算三种评估方法曲线下面积(AUC)的差异,以 P<0.05 为差异有统计学意义。
2 结果
2.1 pSS 组与非pSS 组在年龄差异无统计学意义
pSS 组与非pSS 组在年龄差异无统计学意义,t为 1.454,P 为 0.151>0.05。
2.2 腮腺常规超声表现及超声评分比较
非pSS 组患者腮腺回声均表现为中等回声,分布均匀,其内偶尔可见单个淋巴结回声。而在pSS 组患者腮腺内出现不同程度的回声不均匀, 表现为腺体内呈小片状或融合片状回声减低区, 多发低回声结节呈蜂窝状,多伴有条索状高回声(图1~10)。
非 pSS 组中腮腺超声 51 例(51/64,79.7%)表现为正常,评为 0 分;而 pSS 组 61 例(61/76,80.3%)腮腺超声评分≥1 分。 双侧腮腺 pSS 组(n=76)超声评分(2.34±0.152)分,非 pSS 组(n=64)超声评分(0.35±0.131)分,t 值为 9.901,P 值<0.001。 pSS 组腮腺评分高于非pSS 组,两组间分值差异具有统计学意义。
2.3 腮腺杨氏模量值比较
同组内左、 右侧腮腺杨氏模量值差异无统计学意义(P>0.05),见表 1;不同组间同侧腮腺杨氏模量值差异有统计学意义(P<0.05),见表 2。

表1 同组内左右两侧腮腺杨氏模量值比较(kPa)

表2 不同组间同侧腮腺间杨氏模量值比较(kPa)
2.4 腮腺超声评分值及杨氏模量值诊断pSS 的ROC 曲线
腮腺超声评分诊断 pSS 的 ROC AUC 为 0.906(95%置信区间为 0.845,0.948),以 2 分为最佳截断值诊断 pSS 灵敏性为 81.6%,特异性为 93.7%,准确率为 81.8%。
RT-SWE 诊断 pSS 的 ROC AUC 为 0.876(95%置信区间为 0.809,0.925),以 9.9 kPa 为最佳截断值诊断 pSS 灵敏性为 75.0%,特异性为 95.3%,准确率为 77.3%,见图 11。
2.5 腮腺超声评分、RT-SWE 二者联合对 pSS 的诊断效能
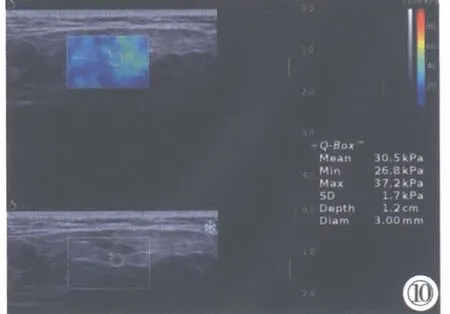
图1~10 分值依次为0~4 的超声二维声像图及相应的RT-SWE 图。LP:左侧腮腺。 图1:腺体大小正常,回声均匀(0 分)。图 2:超声评分为 0 分,杨氏模量值为 7.6 kPa。图 3:腺体大小正常,回声轻度不均匀(1 分)。图4:超声评分为1 分,杨氏模量值为9.7 kPa。图5:腺体大小正常,回声中度不均匀,伴高回声线(2 分)。图6:超声评分为2 分,杨氏模量值为13.1 kPa。图7:腺体形态饱满,回声明显不均,弥漫分布低回声区,直径2~6 mm(3 分)。图8:超声评分为3 分,杨氏模量值为15.9 kPa。图9:腺体回声饱满,回声极不均匀,弥漫分布低回声区,直径>6 mm,伴末梢导管囊状扩张(4 分)。 图 10:超声评分为 4 分,杨氏模量值为 30.5 kPa。Figure 1~10. Ultrasonic two-dimensional sonogram with scores of 0~4 and corresponding RT-SWE map. LP: Left parotid gland. Figure 1: The parotid gland is in normal size with even echo (0 point). Figure 2: Sonographic score is 0 point, the Young’s modulus is 7.6 kPa. Figure 3: The parotid gland is in normal size with a mild uneven echo (1 point). Figure 4: Sonographic score is 1 point, the Young’s modulus is 9.7 kPa. Figure 5: The parotid gland is in normal size with moderate uneven echo, and the proofing hyperechogenic is visible (2 point). Figure 6: Sonographic score is 2 point, the Young’s modulus is 13.1 kPa. Figure 7: The parotid gland is enlarged with uneven echoes, diffuse distribution of small hypoechoic areas, 2~6 mm in diameter (3 point). Figure 8: Sonographic score is 3 point, the Young’s modulus is 15.9 kPa. Figure 9: The parotid gland is enlarged with very uneven echoes, diffuse distribution of small hypoechoic areas, diameter greater than 6mm, cystic dilatation of peripheral duct(4 point). Figure 10: Sonographic score is 4 point, the Young’s modulus is 30.5 kPa.
腮腺超声评分联合RT-SWE 诊断pSS 的ROC AUC 为 0.950 (95%置信区间为 0.899,0.979),pSS的敏感性、 特异性、 准确率分别为 88.2%、90.6%、86.8%,见图 11。

图11 腮腺超声评分、杨氏模量和联合评估的ROC 曲线。Figure 11. The ROC curve of parotid ultrasonography, Young’s modulus and the combined.
超声评分与RT-SWE 的AUC 比较, 差异无统计学意义:Z 值为 1.594,P 值为 0.111; 联合评分诊断pSS 的AUC 明显高于腮腺超声评分及RT-SWE,差异有统计学意义:联合评分与超声评分的AUC 比较:Z 值为 2.131,P 值为 0.033; 联合评分与 RTSWE 的 AUC 比较:Z 值为 3.119,P 值为 0.001。
3 讨论
干燥综合征是一种系统性自身免疫性疾病,因本病好发于中年女性,我国患者男女比为 1∶20~1∶9[2],因而本研究中未纳入男患者,均为女患者。干燥综合征的诊断相当复杂,其临床表现不特异,目前该病的诊断仍以某些特征性临床表现的综合判断为基础,尚无公认的金标准[3]。 眼干、口干这些主要临床症状还可见于其他多种情况及疾病,如糖尿病、呼吸系统及肾脏疾病、病毒感染、佩戴隐形眼镜、吸烟及用药影响等。 pSS 因临床表现非特异性以及尚无敏感性及特异性均高的辅助检查,常被漏诊误诊[5]。 目前已有多种影像学检查方法用于诊断pSS, 但尚无单项检查能达到满意效果。 约有1/3 的pSS 患者伴有腮腺肿大、质硬。因此评估干燥综合征涎腺病变的方法一直是研究焦点, 超声检查以其安全无创、 简便快捷、价格低廉优势而成为研究热点[6]。 弹性成像作为一项迅猛发展的超声检查新技术, 已在多种器官组织中广泛应用, 其中包含浅表器官弥漫性病变的研究,例如甲状腺弥漫性病变等[7-8]。
涎腺实质二维声像图改变, 例如腮腺腺体回声不均匀, 低回声区等是超声诊断pSS 腮腺病变的最主要依据,但在评价超声图像时,对于病理性改变评价不客观是影响准确性的一个因素, 既往研究提示涎腺超声检查存在多种评分系统[4,9],并证实涎腺超声检查可作为pSS 诊断的有效手段, 可取代美国欧洲共识标准中的唾液分析和核素扫描,以及ACR 指南中的3 项中的任意一项(唇腺活检、角膜染色、血清学检查)[10-11]。 然而, 关于涎腺超声检查诊断pSS仍存在许多尚未解决的问题, 例如评分系统多为半定量,结果依赖于操作者的主观性,如何客观评估涎腺超声特征, 评分系统的客观性以及最佳界值尚未达成共识。
pSS 超声特征性的表现为明显的不均匀性、多个低回声区,以及囊性变。根据这些特征制定的0~4评分系统[10],pSS 组的超声评分显著高于非pSS 组。超声评分为腮腺回声的均匀程度提供了半定量指标,作为一种非侵入性方法,对pSS 的诊断具有较高的敏感性和特异性[11]。 许多非免疫的因素如细菌或病毒感染、脓肿以及肿瘤,也会引起涎腺薄壁组织的不均匀性和低回声区, 但是这些结构的变化一般是单侧的、局限性的,而pSS 患者所有的涎腺一般均受累,病变弥漫分布,而且累及程度左右两侧一般无明显差异的。腮腺良性肿瘤的超声特征是边界锐利、分叶状、均匀低回声,高度恶性肿瘤和较大的病变多表现为边界不规则,典型的异质回声模式。因而应从临床和组织学特征两方面来综合鉴别诊断[12]。
本研究中, 双侧腮腺的杨氏模量值组间差异无统计学意义, 提示pSS 患者同时累及双侧腺体且程度基本相同,与既往研究一致[13-14]。
pSS 组患者腮腺的杨氏模量值明显高于非pSS组,提示pSS 组患者腮腺腺体变硬,这与pSS 的病理特征伴有纤维化的慢性炎症有关, 其特征表现是局灶性淋巴细胞浸润。淋巴细胞富集的单核细胞增多,形成聚集体,取代正常的腺体组织,通过增加黏度和体积缺失的腺体结构以致腺泡导管上皮破坏, 功能丧失[14]。 既往研究,pSS 患者受累的腮腺及颌下腺硬度随病情进展而变硬, 早期的pSS 病理表现主要为腺体实质淋巴细胞灶性浸润, 此时涎腺小叶结构存在,腺泡未见明显破坏,腺体质地变硬程度较轻,弹性值可轻度升高。 中晚期pSS 患者腺体内淋巴细胞严重聚积,部分腺泡萎缩、破坏,腺叶结构畸变,纤维化程度加重,腺体质地变硬较为明显,临床上常能触及肿大变硬的腺体。中晚期,涎腺的弹性成像有助于确定病情的进展并分期,可降低行唇腺活检有创检查的必要性,节省患者的看病费用及节约医疗资源[15-16]。
本研究中Emean诊断的最佳截断值是9.9 kPa,与陈娟等[14]研究的7.75 kPa 相近。 将腮腺的超声表现按照严重程度分级并进行评分, 客观反应腮腺实质回声改变程度, 结合通过不同色彩反映组织硬度差异的弹性成像的Emean,评价腮腺受累情况[17],具有较高的诊断效力,评估能更为准确。弹性成像更适用于对有临床症状者进行早期pSS 的筛查, 当患者症状明显,但是超声评分不足以诊断时,需要借助弹性成像,根据杨氏模量值来进一步调整超声评分,两者联合可以使敏感性(88.2%)和准确率(86.8%)均明显提高,特异性又无明显下降(90.6%)。 可以在pSS 累及腮腺病变非常早期时, 二维超声特征不是特别典型时,其杨氏模量已轻度增高,可能此时病理改变已然开始,在腮腺组织硬度上已有体现,这样可以使仅依靠二维超声评分不足诊断的患者,早期疑诊pSS,结合免疫学抗体检查, 以及必要时唇腺活检等明确诊断,减少漏诊,值得在临床上推广应用。
在弹性成像的应用中,感兴趣区域的大小,放置位置及深度,增益等参数均存在一定的主观性,本文采用两名医师以及上级医师会诊等、 多次测量取平均值等的措施将主观误差尽可能降至最低。 但本研究中入组患者均为女性,且样本量偏小,更为准确的杨氏模量诊断界值有待于以后大样本多中心前瞻性研究。
