5-苯基-2-(4-甲氧基)-2H-1,2,3-三氮唑-4-羧酸乙酯的光谱性质及其罗丹明衍生物对Hg2+的显色机理和细胞成像
2019-08-21李建玲丁国华刘艳萍冯华杰牛燕燕何猛雄史载锋何文英
李建玲,丁国华,刘艳萍,冯华杰,牛燕燕,何猛雄,史载锋,何文英*
(1.海南师范大学 化学与化工学院,海南 海口 571158;2.热带药用资源化学教育部重点实验室,海南 海口 571158;3.海南省水环境污染治理与资源化重点实验室,海南 海口 571158)
1 引言
1,2,3-三氮唑类化合物以其独特的物理化学性质及良好的生物活性和低毒性,已在材料化学、药物化学、有机化学和有机金属化学等许多领域有诸多应用,并愈发引起了研究者的兴趣及对其进行开发利用[1-2]。其中,利用其结构中含氮五元杂环的特征,将其设计合成目标产物来作为金属离子探针就是一个非常有实际意义的应用,尤其在医药学的测定药理活性方面已显示出其独特的作用[3]。众所周知,生物体中的金属离子若不足或过量均可导致正常的生理功能紊乱,比如汞元素作为一种剧毒性的金属污染物,沉入水中后可通过水生食物链快速累积,对生命体及环境水体造成威胁;进入人体可引起消化道、肾脏、大脑或神经系统等的多种疾病。近些年来,在众多对汞离子的检测方法中,较早的有冷蒸气原子吸收光谱法[4],现在利用新型荧光或显色探针检测汞离子已经成为一种主要的研究方法[5-7],通过修饰电极测定汞离子也有诸多报道[8-9],最新的报道表明,具有生物活性的纳米颗粒[10-11]和量子点材料[12-13]也可高效灵敏地检测汞及其化合物。尤其是新开发合成1,2,3-三氮唑类化合物衍生物对某些金属离子的特异识别,或充分利用其与金属离子可结合的药理活性,对深入研究新三氮唑类化合物具有重要的理论及实际意义。
由于罗丹明及其衍生物具有多种优越的光谱特点,如良好的光稳定性、宽广的波长范围、较高的量子产率及摩尔消光系数大、对pH不敏感等优点,及基于闭环到开环机理可表现出明显荧光增强及颜色变化等,已在金属离子的显色识别方面有众多应用[14-15]。而基于三氮唑-罗丹明荧光探针的研究报道也揭示了这些探针均对Hg2+有相似的特异性响应,主要表现为呈现粉红色的显色响应、在中性pH值左右的水溶液中形成1∶1或1∶2的络合物等[16-19]。结合本实验的研究也发现,目标化合物对Hg2+有高选择性显色响应,而本文设计的探针的优势尤其表现在pH=7.4的条件下,这可为进一步开发其作为定性检测生理条件下的金属离子探针提供科学合理的指导。
根据1,2,3-三氮唑类化合物的5-苯基-结构特点,本文对2-(4-甲氧基)-2H-1,2,3-三氮唑-4-羧酸乙酯(EMPC)[20]进行了量子化学参数及光活性的理论计算;并有针对性地设计合成路线,筛选其罗丹明合成产物REMPC对金属离子的识别性能及键合机理;通过细胞成像测定显示REMPC可实现对人宫颈癌细胞株HeLa细胞的标记,借此发现这种新化合物的性质及用途。
2 实验
2.1 仪器与试剂
测试仪器有:400MHz AV400型超导核磁共振波谱仪(德国Bruker公司);U3900/3900H紫外可见光分光光度计(日本日立公司);F-5301PC荧光分光光度计(日本岛津公司);Nikon TS100-F倒置荧光显微镜(日本尼康);MCO-15A型CO2细胞培养箱(日本SANYO);SW-CJ-1F净化工作台(苏洁净化);6孔细胞培养板(Costar公司);Agilent 1100-Bruker Esquire HCT质谱仪(美国Agilent公司-德国Bruker公司离子质量分析器)。
5-苯基-2-(4-甲氧基)-2H-1,2,3-三氮唑-4-羧酸乙酯 (EMPC)由海南师范大学有机合成实验室提供;罗丹明B(AR)购自西亚试剂,水合肼(80%,AR)购自阿拉丁试剂,金属离子(1 000 μg/mL)购自Inorganic Ventures公司;人宫颈癌细胞株HeLa细胞由海南师范大学热带药用植物化学教育部重点实验室提供;实验所用其余试剂、溶剂均为市售分析纯。实验用水为超纯水。
2.2 合成路线及方法
2.2.1 罗丹明酰肼1的合成
参考文献[21],将罗丹明B(1.0 g,2.1 mmol)和20 mL无水乙醇加入50 mL圆底烧瓶中,混匀后缓慢滴加水合肼(2 mL,80%),回流加热3 h。冷却至室温后,用50 mL乙酸乙酯和50 mL水萃取,将有机相倒入锥形瓶中,用无水硫酸钠干燥后,旋转蒸发除去溶剂,得到粉红色固体1 (0.52 g,54.74%)。m.p.166~168 ℃[8]。1H NMR (400 MHz,CDCl3):δ(10-6)=1.16(t,J=6.8 Hz,12H),3.34(q,J=7.2 Hz,8H),3.61(s,2H),6.30(m,2H),6.45(m,4H),7.1(m,J=2.64 Hz,1H),7.44(m,2H),7.94(m,1H);13CNMR(100 MHz,CDCl3)δ(10-6)=166.0,153.8,151.4,148,8,132.4,129.9,128.0,127.9,123.7,122.8,107.9,104.5,97.9,77.3,77.0,76.7,65.8,44.2,12.5。
2.2.2 化合物REMPC的合成
在25 mL圆底烧瓶中加入 EMPC(68 mg,0.21 mmol),加入5 mL乙醇和5 mL水,再加入KOH固体(60 mg,1.07 mmol),室温下搅拌4 h,再加热回流2 h。冷却至室温后,用浓盐酸将反应液的pH值调到1以下。然后用乙酸乙酯和水萃取,有机相用无水硫酸钠干燥,在旋转蒸发仪上除去有机溶剂,得到白色固体2。再将3 mL二氯亚砜加入装有固体2的圆底烧瓶中,90 ℃回流3 h,之后将回流装置改为蒸馏装置,蒸出多余的二氯亚砜,得到化合物3。继续向上述圆底烧瓶中加入10 mL二氯甲烷,待溶解后,加入罗丹明酰肼1(93 mg,0.20 mmol),再加入1 mL乙二胺,混合溶液在室温下搅拌12 h后,加入乙酸乙酯和水萃取,有机相中加入无水硫酸钠干燥,旋干除去溶剂,得到粗产物,利用柱层析分离提纯粗产物,洗脱剂为石油醚:乙酸乙酯(4∶1,V∶V),最后得到产物REMPC(78.8 mg,52.09%)。1H NMR(400 MHz,CDCl3)δ8.08(s,1H),8.00(d,J=7.0 Hz,1H),7.91(d,J=9.0 Hz,2H),7.85(d,J=3.7 Hz,2H),7.57~7.50(m,2H),7.32(d,J=5.5 Hz,3H),7.19(d,J=7.2 Hz,1H),6.94(s,1H),6.92(s,1H),6.76(d,J=9.4 Hz,2H),6.36(m,4H),3.82(s,3H),3.32(dd,J=13.3,6.4 Hz,8H),1.14(t,J=6.9 Hz,12H);13C NMR(100 MHz,CDCl3)δ165.0,159.6,158.4,153.8,151.3,149.2,148.9,136.9,133.1,132.8,129.5,129.4,129.0,128.9,128.3,128.0,124.2,123.5,120.7,114.3,108.0,104.6,97.7,77.3,77.0,76.7,66.3,55.5,44.3,29.6,12.5.HRMS(ESI)(m/z):[M+H]+calcd for C44H44N7O4,734.345 5;found,734.345 4。
2.3 EMPC的结构计算
采用GaussView5.0量化程序及密度泛函理论DFT的两种方法(CIS/6-31G(d)和B3LYP/6-31G(d))在6-311G(d)基组下对EMPC进行基态全优化;并用含时密度泛函 TD-DFT对EMPC的最低激发态的构型进行全优化及计算EMPC的吸收光谱;再将B3LYP/6-311G(d)计算所得的数据进行基态轨道分析,在此基础上进行TD-DFT计算荧光光谱。再用B3LYP/6-311G(d),B3LYP/6-311G+(d)方法计算EMPC的各种电离势及电子亲和势[22-23]。最后利用Gaussian 09量化程序的B3LYP方法分别在 6-311G(d)基组下对REMPC中H、C、N、O 和F及在LANL2TZ 基组下对 Hg进行了结构优化和能量计算[24]。
2.4 光谱测定
准确称取0.018 4 g化合物REMPC,用乙腈溶解并定容至50 mL容量瓶中,配制成5×10-4mol·L-1的储备液,用超纯水将15种金属离子(Pb2+、Mn2+、K+、Na+、Ag+、Ca2+、Cd2+、Co2+、Cu2+、Fe3+、Zn2+、Ni2+、Hg2+、Li+和 Mg2+)配制成5×10-3mol·L-1的储备液。测定荧光光谱时,固定激发波长为 563 nm,在比色管中加入一定体积的REMPC储备液,用DMF-水(V∶V=1∶1,Tris-HCl,pH=7.4)定容,使其浓度为1×10-5mol·L-1,再分别滴加不同的金属离子,扫描每次滴加后体系的光谱曲线,测定波长范围为565~750 nm,激发光谱狭缝及发射光谱狭缝均为5 nm,发射光谱的扫描速度设置为“Fast”模式。
测定紫外光谱时,比色管中固定化合物REMPC的浓度为5×10-5mol·L-1,向体系中连续滴加金属离子,测定波长范围为400~750 nm。
2.5 质谱测定
质谱制定在Agilent 1100-Bruker Esquire HCT质谱仪进行,参数设置:Capilary:46 nA,Nebulizer:12.0 psi,Dry Gas:10.0 L/min,Dry Temp:300 ℃,Ion Source Type:ESI,Scan Begin:50m/z,Scan End:1 500m/z。
2.6 HeLa细胞的培养及成像测试
在37 ℃的CO2细胞培养箱中培养HeLa细胞12 h;移去6孔板中的细胞培养液,用PBS溶液冲洗3遍;分别加入2 000 μL乙醇及40 μL REMPC,再孵育30 min,在倒置型激光共聚焦显微镜下进行成像;继续加入8 μL Hg2+培养30 min,观察其细胞显色状况,并成像,分别采集亮场和荧光。
3 结果与讨论
3.1 EMPC的结构及光谱分析


图1 (a)优化的EMPC结构;(b)EMPC基态的LUMO前线分子轨道;(c)EMPC基态的HOMO前线分子轨道。Fig.1 (a)Optimized structure of EMPC.(b)Frontier molecular orbital of ground state on LUMO.(C)Frontier molecular orbital of ground state on HOMO.


图2 (a)EMPC的荧光发射光谱(曲线a为发射光谱、b为激发光谱);(b)EMPC的吸收光谱。图中的插图为EMPC在甲醇中相应的实验测定结果。Fig.2 Fluorescence emission spectra of EMPC(a)and absorption spectra of EMPC(b).The illustrations are the corresponding spectra of EMPC measured in methanol.
基于以上结果,理论计算与实验所得的光谱性质在较大程度上是相吻合的,均证明了溶剂效应及EMPC具有良好的光谱特征,通过制作标准曲线(未列出),获得EMPC在甲醇中的吸光系数为5.262×104L·mol-1·cm-1,可为进一步研发EMPC作为新型发光材料及分析测定其含量或者设计成新型药物奠定一定的科学基础。
3.2 REMPC与罗丹明B的合成、表征及结构计算
理论上,含酯基的有机化合物能与罗丹明酰肼合成相应的衍生物[32],由于5-苯基-2-(4-甲氧基)-2H-1,2,3-三氮唑-4-羧酸乙酯(EMPC)的结构中含有酯基,通过设计合成路线及优化实验条件,成功地合成了REMPC的目标产物,并通过1H NMR、13C NMR和 HRESI-MS方法对产物进行了表征。结果表明其分子离子峰位于734.345 4,与REMPC(C44H44N7O4)的理论分子量734.345 5非常接近,这可为具有相似1,2,3-三氮唑结构的化合物进行罗丹明衍生物的合成提供合理的实例指导。

3.3 REMPC与金属离子作用的荧光光谱
选择15种金属离子(Pb2+、Mn2+、K+、Na+、Ag+、Ca2+、Cd2+、Co2+、Cu2+、Fe3+、Zn2+、Ni2+、Hg2+、Li+和Mg2+),在激发波长为563 nm,分别测定REMPC与各金属离子作用的荧光发射光谱(图3(a))。图3(a)显示,无色的REMPC未出现明显的发射峰;在加金属离子时,只有Hg2+使得REMPC-Hg2+体系在584 nm处的荧光发射强度显著增大,但对其他金属离子与Hg2+体系却没有明显的荧光强度变化。图3(b)为不同金属离子在584 nm处相对荧光发射强度的对比,可看出在该浓度下,Hg2+的加入使得REMPC的荧光强度增大60倍,说明REMPC对Hg2+有很好的响应。

图3 REMPC-Hg2+ 体系的荧光光谱。(a)在DMF-H2O中(V∶V=1∶1,Tris-HCl,pH=7.4),λex=563 nm,其他各金属离子(50 μmol·L-1)存在下REMPC(10 μmol·L-1)的荧光光谱;(b)对应的不同体系的584 nm处的荧光强度,其中插图为不同体系溶液的照片。Fig.3 Fluorescence spectra of REMPC(a)and the fluorescence intensities of different systems(b).(a)REMPC(10 μmol·L-1)in DMF-H2O (V∶V=1∶1,Tris-HCl,pH=7.4)in the presence of various cations (4.67×10-5 mol·L-1)(λex=563 nm).(b)Fluorescence intensities of different systems at 584 nm,the illustration is photographs of the REMPC in the presence of Hg2+ and other metal ions.
图3(b)中的插图为在同一实验条件下,分别测定其他各离子存在时的显色照片,可见仅加入Hg2+时溶液显肉眼可观察到的粉红色,其他金属离子的加入均不使REMPC溶液显色。这些结果表明,Hg2+的加入使得REMPC中罗丹明B结构的螺环打开,发生粉红色的显色反应,并且这种显色仅对Hg2+有高选择性[34]。为确定REMPC对Hg2+响应的灵敏度,进行了固定REMPC浓度(1×10-5mol·L-1)逐渐滴加Hg2+的荧光滴定实验(未列出)。结果表明在最大发射波长为584 nm处,Hg2+的浓度在2.67~4.67×10-5mol·L-1范围,体系的荧光强度逐渐增大,并与Hg2+浓度呈Boltzmannd的线性关系(R2=0.993 1);但当Hg2+浓度超过4.67×10-5mol·L-1时,体系荧光强度达到最大且渐有降低趋势。利用公式3σ/k得到REMPC对Hg2+的检测限为9.665×10-8mol·L-1。
3.4 REMPC与金属离子作用的紫外光谱分析
为辅助说明REMPC对Hg2+有高选择性的荧光光谱结果,进行了紫外光谱分析[32]。在DMF-水(V∶V=1∶1,Tris-HCl,pH=7.4)溶液中,分别测定了REMPC (5×10-5mol·L-1)与不同金属离子(浓度均为5×10-5mol·L-1的Pb2+、Mn2+、K+、Na+、Ag+、Ca2+、Cd2+、Co2+、Cu2+、Fe3+、Zn2+、Ni2+、Hg2+、Li+和Mg2+)作用的紫外光谱(未列出),无色的REMPC未出现明显的吸收峰;在加金属离子时,只有Hg2+使得REMPC- Hg2+体系在565 nm处出现最大吸收峰,并伴随粉红色的溶液出现,但对其他金属离子与Hg2+体系却没有明显的吸收强度和颜色的变化。这表明,仅Hg2+的存在会使得REMPC螺环中罗丹明B结构的螺环从闭环到开环状态[25],与荧光分析的结果相吻合[32]。
Hg2+对REMPC的紫外滴定结果(未列出)表明,在最大吸收峰565 nm处,Hg2+浓度在2.00×10-5~4.67×10-5mol·L-1内,与体系吸光度及Hg2+浓度呈Boltzmannd的线性关系(R2=0.999 9,未列出),但当Hg2+浓度大于4.67×10-5mol·L-1时,体系的吸光度随Hg2+浓度升高而呈现稳定趋势,表明Hg2+与REMPC的相互作用可能达到了饱和状态。
3.5 干扰离子实验
在DMF-H2O (V∶V=1∶1,Tris-HCl,pH=7.4)溶液中,荧光发射波长为584 nm,有其他金属离子共存时对REMPC测定了Hg2+的干扰结果(未列出)。结果表明,REMPC-Hg2+体系的荧光强度并没有受到其他离子共同存在的干扰,说明REMPC对Hg2+的显色响应比其他离子更为灵敏,具有特异性的结合作用。
3.6 REMPC对Hg2+的响应时间
通过优化实验条件,测定了0~60 min时间范围内REMPC与Hg2+作用时的荧光强度(未列出),REMPC与Hg2+体系在3 min内可达到稳定,并在60 min内维持稳定,说明利用REMPC的显色反应可在生理条件下(pH=7.4)快速、灵敏、定性地测定Hg2+。
3.7 确定REMPC与Hg2+的络合比
通过等摩尔连续变化法测定REMPC与Hg2+的络合比[31-32]。固定REMPC和Hg2+的总浓度为5×10-5mol·L-1,变化REMPC与Hg2+离子的浓度比,获得不同比值下体系的荧光强度并制作工作曲线(图4(a)所示),可得出REMPC与Hg2+以1∶2的形式进行络合反应。同时,为佐证该结果,利用Gaussian 09量化程序的相关基组对REMPC进行了结构优化(图4(b))和能量计算(未列出)。图4(b)显示,REMPC的结构空间可包容2个Hg2+,且能与不同基团中的O或N生成2个稳定的五元环。计算结果也表明,REMPC与Hg2+的络合比为1∶2时,其能量变化值(ΔE(a.u.)及ΔE(eV)分别为-0.57和-15.62)比形成1∶1的要小(对应值为-0.45和-12.32)。以上实验及理论计算结果均说明,REMPC与2个Hg2+的络合更稳定。

图4 (a)REMPC与Hg2+的工作曲线;(b)优化的REMPC与2个Hg2+ 键合的结构。Fig.4 (a)Job plot of REMPC with Hg2+ ion.(b)Optimized structure of REMPC binding to two of Hg2+ ions.
3.8 REMPC与Hg2+显色机制
一般情况下,金属离子引起罗丹明衍生物的响应机制有配位型荧光探针、反应型荧光探针及配位开环再进一步催化酰胺键的水解3种方式。特别是反应型荧光探针,通过罗丹明衍生物和金属离子发生不可逆化学反应,作用于内酰胺螺环发生水解反应或催化环化等,引发罗丹明螺环开环,从而恢复其荧光,表现为体系荧光增强,多用于设计off-on型荧光探针[35-36]。
为确定REMPC对Hg2+的显色机理,测定了正离子模式下REMPC-Hg2+体系的电喷雾质谱(图5(a)),图5(b)为理论计算的结果。可看出,在m/z900~1 400范围内,出现位于m/z1 135.9的最强离子峰,可归属于[REMPC+2Hg+2H],即REMPC与2个Hg2+的络合形式。图5(b)的理论模拟效果图显示了最高峰值为1 135.9及相应的同位素模式,也明显可见模拟图与实测图的吻合度较高,以上结果均证明REMPC可与Hg2+形成1∶2的稳定络合物,并进一步补充佐证了用等摩尔连续变化法得到的光谱实验及结构计算测定络合比结果的合理性。

图5 在有少量Cl-存在时REMPC的ESI-MS 图。(a)和(b)分别为实验和理论计算的结果,其中的两个插图分别对应[REMPC+2Hg+H]的同位素模式图。Fig.5 (a)ESI-MS of REMPC in the presence of Hg2+and trace amounts of Cl-.Inset:enlarged patterns for the [REMPC+2Hg+H].(b)Calculated ESI-MS of REMPC in the presence of Hg2+and Cl-.Inset:calculated isotopic patterns for the [REMPC+2Hg+H].
结合本文中的所有光谱及计算结果可以确定,新化合物REMPC属罗丹明类反应型荧光探针。图6为REMPC与Hg2+可能的显色作用机制,EMPC的三氮唑基团诱导罗丹明B的螺环结构发生闭环,导致合成产物REMPC没有荧光强度显示;当设置激发波长为563 nm,Hg2+存在时,1个分子的REMPC可与2个分子的Hg2+相互作用,使得罗丹明B的螺环开环,体系在584 nm处有最大荧光发射强度,EMPC单体三氮唑的N与其羧基的C及O原子与一个Hg2+形成五元环;罗丹明B结构的酰胺上的2个N及邻近的羰基O原子与另一个Hg2+形成五元环,并伴随体系的荧光强度增大,同时肉眼可观察到溶液从无色变为粉红色。结合本研究的光谱测定条件(pH=7.4)及高选择性的实验结果,说明REMPC是一种可以在生理条件下定性测定Hg2+的理想探针。
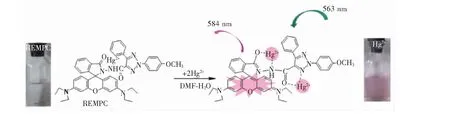
图6 REMPC对Hg2+的响应机制推测Fig.6 Proposed recognition mechanism of REMPC towards Hg2+
3.9 REMPC在HeLa细胞中的成像研究
为进一步确定探针分子在生物体内的应用潜质,测试了REMPC在人宫颈癌细胞株HeLa细胞中的成像(图7)。实验结果表明,仅有FBS培养液及REMPC存在时,细胞内无荧光(分别对应图7(1b)及7(2b)),而当REMPC和Hg2+共同孵育细胞时,细胞内有明显的荧光出现(图7(3b)),不仅表明在细胞中REMPC对Hg2+有选择性响应,也显示REMPC有可能被开发用于生物细胞内的Hg2+的检测。

图7 REMPC在HeLa细胞中对Hg2+的成像。(1a~3a)亮场成像;(1b)在FBS培养液下HeLa细胞的荧光成像;(2b)L4探针在HeLa细胞的荧光成像;(3b)L4探针在HeLa细胞对Hg2+的荧光成像。
Fig.7 Fluorescence imaging of Hg2+in HeLa cell with REMPC.(1a)-(3a)Brightfield transmission images.(1b)Images of cells incubated with the FBS culture solution as the sample blank.(2b)Images of cells incubated with REMPC(10 μmol·L-1).(3b)Images of cells incubated with REMPC(10 μmol·L-1)and Hg2+(20 μmol·L-1).
5 结论
本文首先利用量子化学计算了一种含酯基1,2,3-三氮唑化合物EMPC的结构特征及光活性参数,理论计算与光谱实验的结果相一致;并将其设计与罗丹明B合成了一种新型衍生物REMPC,荧光光谱及紫外光谱实验结果均表明在pH=7.4的水溶液条件下REMPC对Hg2+有高选择性响应,溶液颜色由无色变为粉红色,反应速率很快,生成1∶2的稳定络合物,不受其他共存金属离子的干扰。推测可能的反应机制为:EMPC介入生成的REMPC可调节罗丹明B从闭环到开环过程,表明REMPC具有构建off-on型荧光探针的潜能,并可以在生理条件下快速、灵敏、定性地测定Hg2+,这为深入研究1,2,3-三氮唑及其衍生物的理化性质或应用提供了一定的有价值信息。
