三种何首乌单体成分对大鼠肝损伤作用的研究△
2019-08-21颜玉静文海若淡墨吕建军王超苗玉发黄芝瑛汪祺
颜玉静,文海若,淡墨,吕建军,王超,苗玉发,黄芝瑛,汪祺
1.中山大学 药学院,广东 广州 510006;2.中国食品药品检定研究院 国家药物安全评价监测中心/药物非临床安全评价研究北京市重点实验室,北京 100176;3.中国食品药品检定研究院 中药民族药检定所,北京 100050
蓼科植物何首乌PolygonummultiflorumThunb.的药理学作用广泛,包括抗肿瘤、抗菌抗炎、抗氧化、保护神经、延缓动脉粥样硬化等[1-2]。然而近年来,国内外关于何首乌及其制剂的临床不良反应,尤其是肝损伤的报道逐渐增多[3-4]。临床数据提示,何首乌可导致肝细胞损伤型、胆汁淤积型及混合型的肝损伤,常见临床症状为胆汁淤积、黄疸、肝区疼痛、肝脾肿大等[5]。目前何首乌中导致肝损伤的具体成分及其机制仍不明确。有研究提示其致肝损伤的机制可能与抑制胆红素代谢过程中的UDP-葡萄糖醛酸转移酶1A1(UGT1A1酶)有关,如汪祺等[6-7]发现大黄素型蒽醌类成分、二蒽酮及蒽酮糖苷类成分可选择性抑制UGT1A1酶的活性,使胆红素代谢出现障碍,在肝细胞和血液内蓄积,引发毒性。另有研究提示[8],何首乌中的鞣质与二苯乙烯苷类成分混合后可对肝实质细胞造成不可逆的损伤。因此,有必要开展体内研究,对何首乌单体成分的肝损伤作用及可能机制进行进一步的探究。
蒽醌类和蒽酮类是何首乌中的主要单体成分。蒽醌类成分包括大黄素、大黄酸、大黄素-8-O-β-D-葡萄糖苷、大黄素甲醚等[9]。目前有关大黄素和大黄酸的致肝毒性作用研究较为充分[10],针对大黄素-8-O-β-D-葡萄糖苷及大黄素甲醚的肝毒性研究,尤其是体内研究则较少。此外,二蒽酮类化合物大黄素型单蒽酮在新鲜何首乌中含量较高,也有文献报道其在体外的致肝毒性作用[7]。本研究拟连续14 d经口灌胃给予SD大鼠大黄素-8-O-β-D-葡萄糖苷、大黄素甲醚和单蒽酮,观察动物临床症状,分析体质量、肝脏质量、细胞因子水平、血清生化指标及病理学指标,探究3种单体成分体内的肝毒性作用及可能的机制,为研究何首乌致肝毒性提供体内数据支持。
1 材料
1.1 实验动物
SPF级雄性SD大鼠50只(给药时约6周龄,体质量约200 g),购买自北京维通利华实验动物技术有限公司,实验动物许可证号:SCXK(京)2016-0006[11]。大鼠在屏障系统内PC聚碳酸酯鼠盒饲养,饲养环境保持温度20~26 ℃,湿度40%~70%,提供钴60放射灭菌鼠全价颗粒饲料,自由摄取。
1.2 仪器与试剂
H500FR台式高速冷冻离心机(日本Kokusan 公司);7180型全自动生化分析仪(日本日立公司);PB203-N型电子天平(瑞士Mettler Toledo公司);显微镜(日本Olympus公司);樱花TEC5EMJ-2型自动包埋机和DRS-2000自动染色机及封片机(日本Sakura公司);MERCK LIMTTED Luminex 200(德国Merck Millipore 公司)。
大黄素甲醚(中国食品药品检定研究院,批号:110758-201616,纯度:99.0%);大黄素-8-O-葡萄糖苷(源叶生物科技有限公司,纯度≥98.0%);大黄素型单蒽酮(中国医学科学院药物研究所杨建波博士赠送,纯度≥95%);羧甲基纤维素钠(美国Sigma Aldrich公司);Milliplex Map Mouse Cytokine/Chemokine Magnetic Bead Panel Kit(德国Merck Millipore 公司)。
2 方法
2.1 动物分组及给药方式
动物在给药前检疫适应6 d。检疫期第6天按体质量随机分组法分为10组,每组5只动物。分组时动物体质量约200 g,个体体质量差异小于平均体质量的±20%。给药方式为经口灌胃,连续给药14 d,给药剂量为15 mL·kg-1。
2.2 给药剂量
何首乌的临床每日最大用量约为每人100 g生药,按体质量60 kg计算,即1.7 g·kg-1。其中大黄素-8-O-β-D-葡萄糖苷在生药中含量以2.63 mg·g-1计,为4.5 mg·kg-1;单蒽酮和大黄素甲醚在生药中含量以0.62 mg·g-1计,为1.05 mg·kg-1。根据大鼠与人体表面积系数(6.17)折算,大黄素-8-O-β-D-葡萄糖苷相当于28 mg·kg-1,以该剂量为最低剂量,分别设置28、280、1120 mg·kg-1剂量组,约为人最大拟用剂量的1倍、10倍和40倍;单蒽酮和大黄素甲醚相当于6.5 mg·kg-1,以该剂量为最低剂量,分别设置6.5、65、650 mg·kg-1剂量组,约为人最大拟用剂量的1倍、10倍和100倍[11]。
2.3 检测指标
研究期间每天观察动物临床症状。给药第1、4、8、11天及第15天解剖日麻醉前各测定1次动物体质量。动物经异氟烷麻醉后经眼眶后静脉丛采血。剖检前一天动物禁食过夜,第15天麻醉动物后采集腹腔后大静脉血。给药第2、4、8、11天和第15天采血用于进行血清生化检测,采血量约1 mL/只。血液样本在室温放置1~2 h后,以4 ℃ 3500 r·min-1离心15 min,吸取血清,使用Hitachi 7180型全自动生化仪测定以下血清生化指标:天门冬氨酸氨基转换酶(AST)、丙氨酸氨基转换酶(ALT)、乳酸脱氢酶(LDH)、肌酸磷酸激酶(CK)、碱性磷酸酶(ALP)、总胆红素(TBIL)。给药第2、第8天和第15天采血用于细胞因子测定,采血量约1 mL/只。血液样本在室温放置1~2 h后,以4 ℃ 3500 r·min-1离心15 min,取上清液,使用Luminex 200测定以下细胞因子水平:白细胞介素-6(IL-6)、白细胞介素-10(IL-10)、干扰素-γ(IFN-γ)、肿瘤坏死因子-α(TNF-α)。
给药结束后所有动物以CO2吸入法麻醉,腹腔后大静脉取血完毕后,完全放血处死解剖,记录大体病理学发现。将动物肝脏分离后称质量,并使用10%甲醛固定。固定后的组织经修块取材后逐级75%乙醇脱水,再经石蜡包埋,采用滑动切片机切片(厚约3 μm)。切片经苏木精-伊红(HE)染色后,在光镜下进行组织病理学检查[11]。
2.4 统计学方法
3 结果
3.1 整体毒性
实验期间,各组动物临床症状未见与给予3种单体相关的明显异常改变。此外,与对照组相比,大黄素-8-O-β-D-葡萄糖苷、单蒽酮、大黄素甲醚各剂量组动物在不同时期的平均体质量(见图1)及肝脏质量(见表1)差异不具有统计学意义(P> 0.05),提示按照当前的给药方式和给药剂量,3种单体均不会对动物整体产生严重的毒性作用。
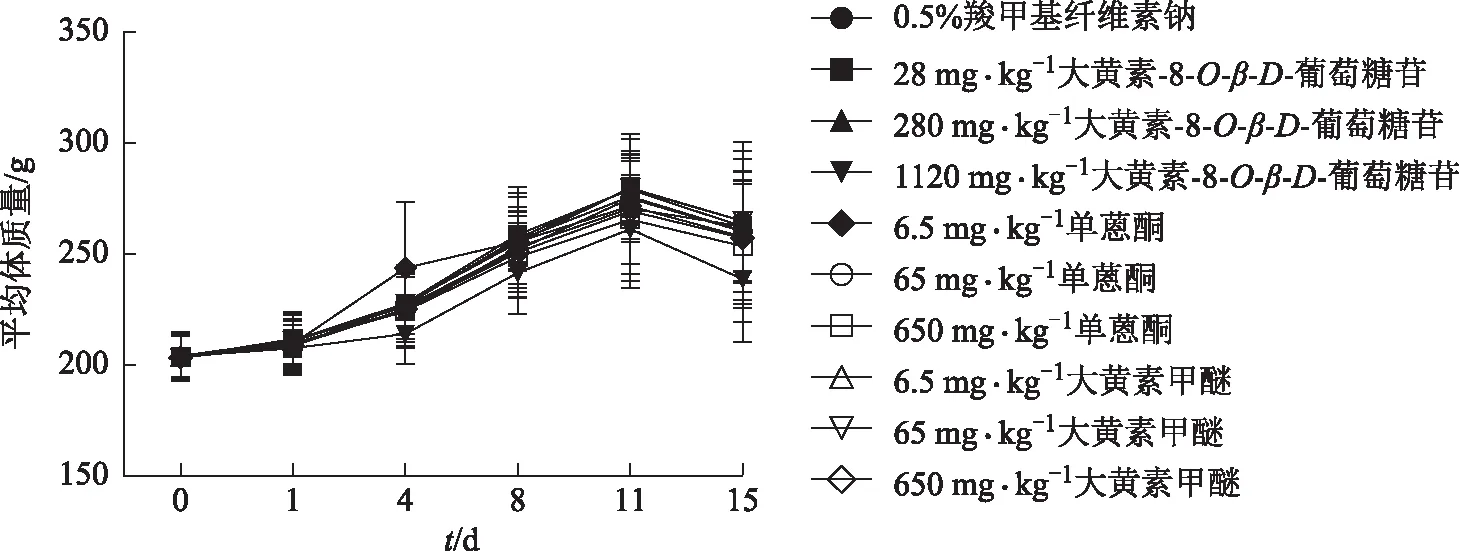
图1 受试物对SD大鼠体质量的影响
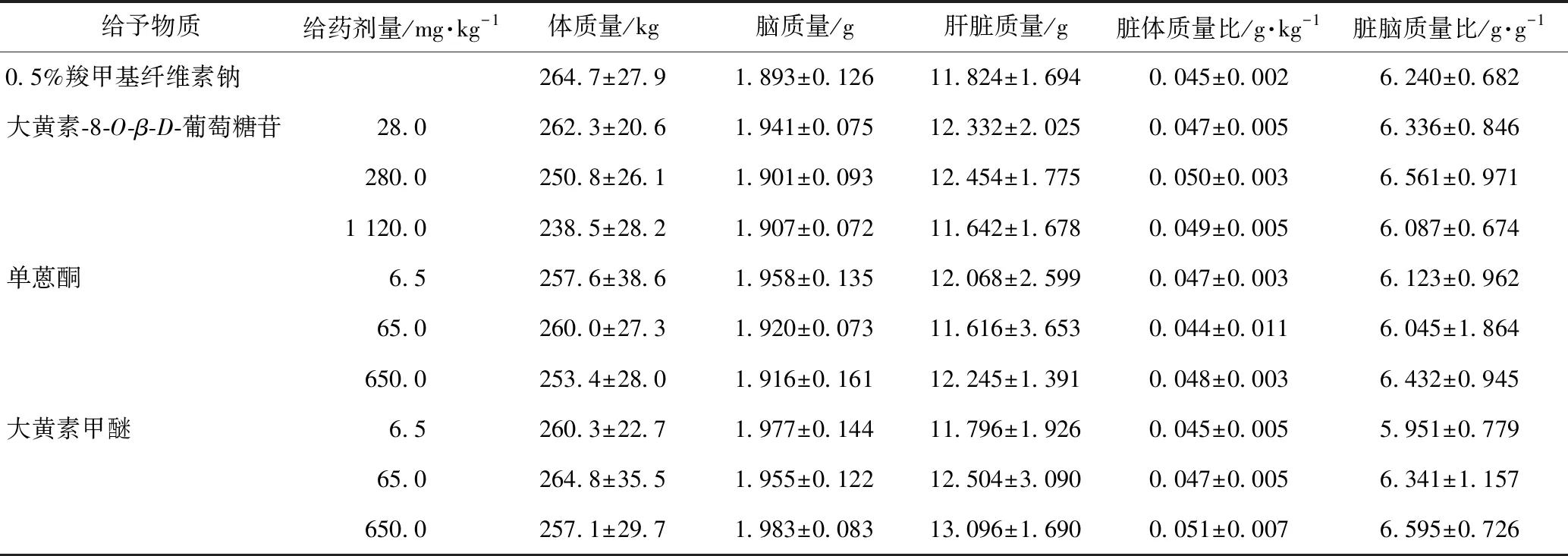
给予物质给药剂量/mg·kg-1体质量/kg脑质量/g肝脏质量/g脏体质量比/g·kg-1脏脑质量比/g·g-10.5%羧甲基纤维素钠264.7±27.91.893±0.12611.824±1.6940.045±0.0026.240±0.682大黄素-8-O-β-D-葡萄糖苷28.0262.3±20.61.941±0.07512.332±2.0250.047±0.0056.336±0.846280.0250.8±26.11.901±0.09312.454±1.7750.050±0.0036.561±0.9711 120.0238.5±28.21.907±0.07211.642±1.6780.049±0.0056.087±0.674单蒽酮6.5257.6±38.61.958±0.13512.068±2.5990.047±0.0036.123±0.96265.0260.0±27.31.920±0.07311.616±3.6530.044±0.0116.045±1.864650.0253.4±28.01.916±0.16112.245±1.3910.048±0.0036.432±0.945大黄素甲醚6.5260.3±22.71.977±0.14411.796±1.9260.045±0.0055.951±0.77965.0264.8±35.51.955±0.12212.504±3.0900.047±0.0056.341±1.157650.0257.1±29.71.983±0.08313.096±1.6900.051±0.0076.595±0.726
3.2 血清生化检测
实验期间分别在给药第2、4、8、11天和第15天采外周血5次,以动态监测受试物对动物与肝脏功能相关的血清生化指标的改变,详见表2~6。大黄素-8-O-β-D-葡萄糖苷和单蒽酮各剂量组的血清生化指标数值在各时间点与对照组相比均未见统计学差异(P> 0.05),提示在当前给药方式和给药剂量下,大黄素-8-O-β-D-葡萄糖苷和单蒽酮未产生明显的肝损伤作用。给药后第4天,大黄素甲醚65 mg·kg-1剂量组动物TBIL的平均值与对照组相比,出现了统计学意义上的升高(P<0.05),提示给予大黄素甲醚可一定程度诱导TBIL升高。

表2 给予受试物后第2天SD大鼠与肝脏功能有关的血清生化指标数值
注:与对照组相比,*P<0.05,**P<0.01;下同。

表3 给予受试物后第4天SD大鼠与肝脏功能有关的血清生化指标数值

表4 给予受试物后第8天SD大鼠与肝脏功能有关的血清生化指标数值

表5 给予受试物后第11天SD大鼠与肝脏功能有关的血清生化指标数值

表6 给予受试物后第15天SD大鼠与肝脏功能有关的血清生化指标数值
3.3 组织病理学检查
肝脏组织病理学观察结果详见表7。动物肝脏镜检大黄素甲醚650 mg·kg-1剂量组中1/5可见中度肝细胞变性坏死,其他组织病理学改变包括汇管区炎细胞浸润(见图2),但均缺乏剂量效应关系,考虑与药物作用无关。
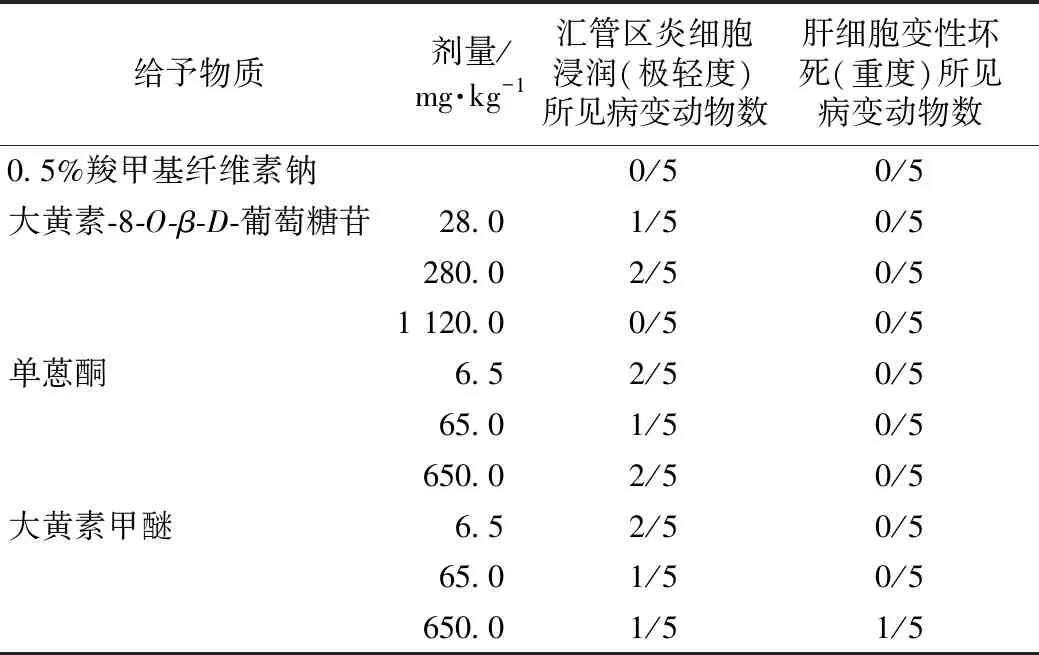
表7 肝脏组织病理学检查结果
3.4 细胞因子水平
细胞因子是由免疫细胞和某些非免疫细胞产生的多功能肽,具有调节血管生成、细胞生长及修复损伤细胞、组织等多种功能,主要包括:白细胞介素、干扰素、肿瘤坏死家族、趋化因子、生长因子等。IL-6是促炎介质,可刺激肝内炎症反应[12];IL-10是抗炎性细胞因子,可抑制肝内炎症介质的合成和表达,减轻肝细胞损伤和炎症反应[13];TNF-α是前炎症细胞因子,可诱导肝细胞大量表达细胞间黏附分子-1,使其易受细胞毒性T细胞的攻击而大量坏死[14];IFN-γ是炎性细胞因子,可引起肝细胞的细胞周期阻滞和细胞凋亡[15]。4种细胞因子均在肝脏疾病的发生发展过程中发挥着重要作用。
实验期间分别在给药第2、8天和第15天采血3次动态监测受试物对细胞因子水平的影响,详见表8~10。给药后第2天,与同时期对照组平均数值比较,大黄素甲醚6.5 mg·kg-1剂量组动物IL-6和TNF-α的水平出现统计学意义上的显著升高(P<0.05);给药后第8天,大黄素-8-O-β-D-葡萄糖苷28、280、1120 mg·kg-1及单蒽酮650 mg·kg-1剂量组动物IL-10的水平降低(P<0.05),大黄素甲醚650 mg·kg-1剂量组动物TNF-α水平升高(P<0.05);给药后第15天,单蒽酮65、650 mg·kg-1和大黄素甲醚6.5、65、650 mg·kg-1剂量组动物IL-10水平降低(P<0.05),单蒽酮650 mg·kg-1剂量组动物IFN-γ的水平也显著下降(P<0.05)。

图2 各组大鼠肝脏镜检结果(HE,×200)
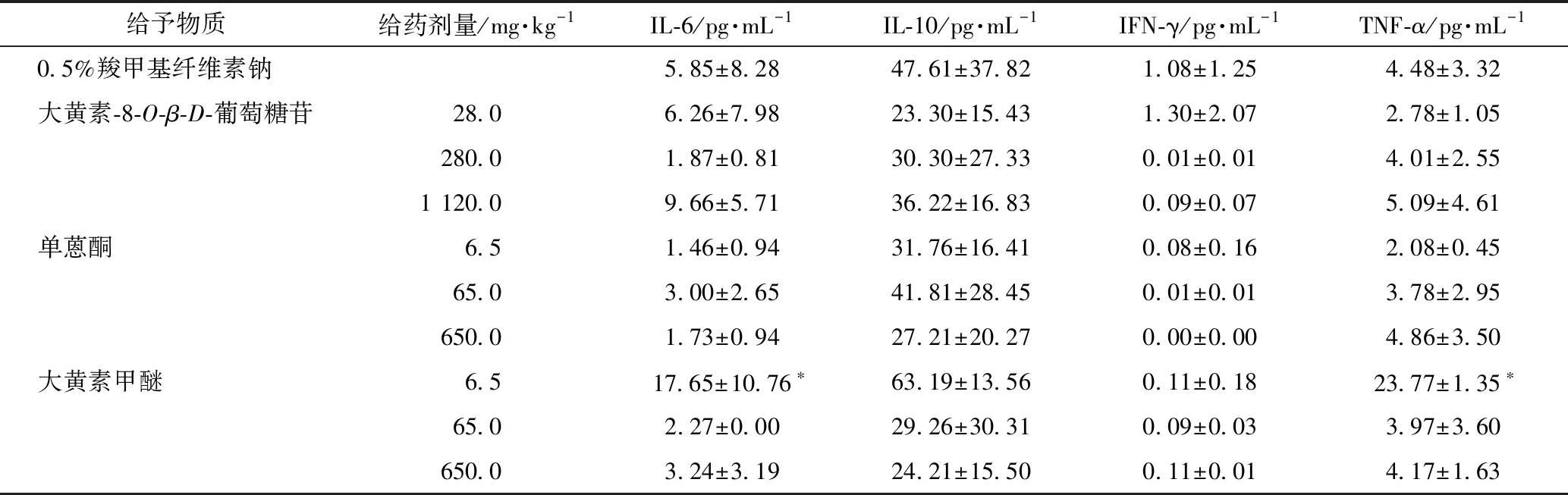
给予物质给药剂量/mg·kg-1IL-6/pg·mL-1IL-10/pg·mL-1IFN-γ/pg·mL-1TNF-α/pg·mL-10.5%羧甲基纤维素钠5.85±8.2847.61±37.821.08±1.254.48±3.32大黄素-8-O-β-D-葡萄糖苷28.06.26±7.9823.30±15.431.30±2.072.78±1.05280.01.87±0.8130.30±27.330.01±0.014.01±2.551 120.09.66±5.7136.22±16.830.09±0.075.09±4.61单蒽酮6.51.46±0.9431.76±16.410.08±0.162.08±0.4565.03.00±2.6541.81±28.450.01±0.013.78±2.95650.01.73±0.9427.21±20.270.00±0.004.86±3.50大黄素甲醚6.5 17.65±10.76∗63.19±13.560.11±0.1823.77±1.35∗65.02.27±0.0029.26±30.310.09±0.033.97±3.60650.03.24±3.1924.21±15.500.11±0.014.17±1.63
注:与对照组相比,*P<0.05;下同。
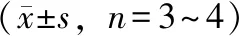
表9 给予受试物后第8天SD大鼠体内细胞因子平均含量
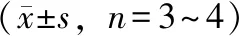
表10 给予受试物后第15天SD大鼠体内细胞因子平均含量
4 讨论
本研究连续14 d经口灌胃给予SD大鼠28、280、1120 mg·kg-1的大黄素-8-O-β-D-葡萄糖苷,6.5、65、650 mg·kg-1的单蒽酮和大黄素甲醚,未见异常临床症状及动物体质量和肝脏质量的明显变化,提示当前给药剂量下3种何首乌中重要单体成分对大鼠无明显整体毒性作用。但血清生化指标检测结果提示大黄素甲醚可一定程度诱导TBIL升高,大黄素甲醚650 mg·kg-1剂量组动物肝脏镜检可见中度肝细胞变性坏死,提示大黄素甲醚可能具有一定的肝毒性作用。
此外,实验期间各给药组细胞因子水平的变化也可见一些趋势。SD大鼠连续14天给予3种单体后,抗炎性细胞因子IL-10水平均有所降低。给药后第2天,大黄素甲醚6.5 mg·kg-1剂量组动物IL-6和TNF-α水平即显著升高。给药后第8天,大黄素甲醚650 mg·kg-1剂量组动物TNF-α水平升高。TNF-α是与肝脏损伤密切相关的炎症因子,其水平升高提示肝损伤的发生。IL-6是促炎介质,可刺激肝内炎症反应。另外,杨博[16]用胆总管结扎术模拟胆汁淤积性肝硬化,用实时定量聚合酶链反应和蛋白印迹检测的方法检测出IL-6在该疾病模型中的表达量明显上升,提示IL-6的升高与胆汁淤积有关。王涛等[17]研究发现,何首乌在体内能够影响胆汁代谢转运,并引起肝损伤。本研究的结果则进一步提示,大黄素甲醚可能具有一定的肝毒性作用。给药后第15天,单蒽酮650 mg·kg-1剂量组动物IFN-γ的水平显著下降。IFN-γ可以通过对G1期的阻滞来抑制细胞周期进程,从而抑制肝细胞的增殖,也可以通过激活肝细胞中的信号传导及转录激活因子1通路[18]或增加细胞活性氧的产生和内质网应激[19]来诱导肝细胞凋亡。此外,IFN-γ可以抑制血管内皮生长因子及成纤维细胞生长因子的基因转录,从而抑制血管形成[20]。基质金属蛋白酶是一类水解酶,可降解细胞外基质,破坏阻止肿瘤细胞侵袭的组织学屏障,促进肿瘤血管生长。IFN-γ可以抑制该类酶的表达,从而抑制肿瘤血管的形成[21]。单蒽酮引起的IFN-γ水平下降,可能导致肝细胞过度增殖,刺激肿瘤血管的生成,在病理上有发展为肝癌的可能[22]。
本研究发现何首乌重要单体成分大黄素甲醚具有潜在肝损伤作用,结论与本课题组前期的体外研究[23-24]相符,其作用机制可能与抑制胆红素代谢酶的活性相关。大黄素甲醚和大黄素-8-O-β-D-葡萄糖苷均为蒽醌类化合物,与大黄素、大黄酸含有相同的蒽醌母核结构[9](见图3)。目前已有较为充分的研究证实了大黄素和大黄酸的致肝毒性作用[10],本研究进一步发现大黄素甲醚具有肝毒性作用,提示具有大黄素型蒽醌母核结构的单体成分具有潜在的肝毒性风险。
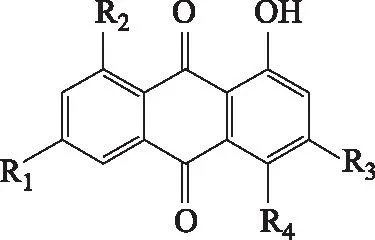
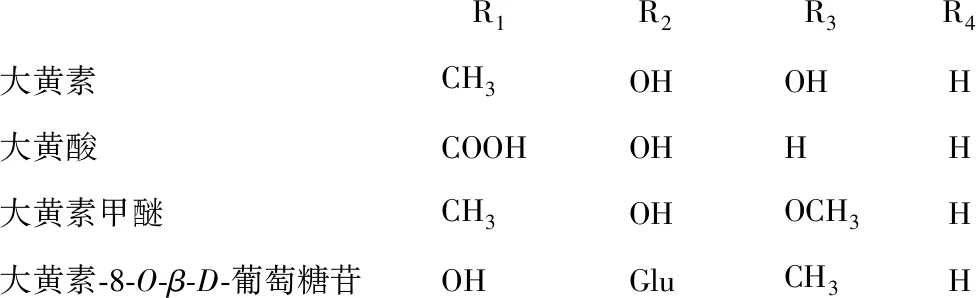
R1R2R3R4大黄素CH3OHOHH大黄酸COOHOHHH大黄素甲醚CH3OHOCH3H大黄素-8-O-β-D-葡萄糖苷OHGluCH3H
图3 蒽醌类成分结构图
本研究的给药周期较短,受试物造成的肝损伤作用并不明显。今后将开展更长给药周期(如28 d连续给药)的研究,并增加每组动物数,以明确其肝损伤作用特点。同时也可以使用代谢组学的方法,分析3种单体干预后的血浆、尿液等生物样本,从分子水平探讨其致肝损伤的作用机制,为临床上何首乌的增效减毒提供依据[25]。除传统的血清生化指标检测外,本研究亦分析细胞因子水平来评价受试物的肝损伤作用。给药后第2天,大黄素甲醚给药组动物IL-6和TNF-α水平即升高,而血清生化检测结果却未见肝损伤的发生。大黄素甲醚中、高剂量组AST、CK和LDH水平降低,单蒽酮中、高剂量组CK和LDH水平降低,结果具有统计学意义,但不具有临床意义,考虑是由于动物个体差异引起的。可见与血清生化指标检测相比,细胞因子水平检测可能更为灵敏,可以及早预测药物的肝毒性作用。
