MyD88在绵羊肺炎支原体感染过程中的作用
2019-08-20张俊波印双红易萌陆安法
张俊波 印双红 易萌 陆安法


摘要:为分析MyD88在绵羊肺炎支原体(MO)感染肺泡上皮细胞中的分子机制。用不同浓度的抑制剂ST2825与细胞孵育24 h,用MTT法检测细胞活性;MO感染细胞后,于4、8、12、24 h收集细胞,利用实时定量PCR检测MyD88 mRNA的表达水平。采用不同浓度的MyD88抑制剂ST2825与细胞孵育1 h,然后用MO感染细胞,于24 h收集细胞,利用实时定量PCR检测白细胞介素-8(IL-8)和肿瘤坏死因子α(TNF-α)mRNA的表达水平,用试剂盒检测caspase-3活性、caspase-8活性、H2O2浓度、NO浓度和LDH浓度变化。结果显示,MO于4、8、12、24 h显著提高细胞MyD88 mRNA表达水平;MO显著提高细胞IL-8 mRNA水平、TNF-α mRNA水平、caspase-3活性、caspase-8活性、H2O2浓度、NO浓度和LDH浓度(P<0.01),而ST2825(浓度为10 μmol/L和20 μmol/L)能够显著降低MO介导的以上指标(P<0.05),表明MyD88在MO感染肺泡上皮细胞过程中发挥重要作用。
关键词:绵羊肺炎支原体;MyD88;致病机制
中图分类号:S858.26 文献标志码: A
文章编号:1002-1302(2019)09-0197-04
山羊传染性胸膜肺炎是山羊的一种急性或慢性呼吸道传染病,主要症状为纤维素性胸膜肺炎,此病可感染各种年龄的公母羊群,有很高的发病率和死亡率,被世界动物卫生组织列入通报疫病名录,我国将此病列为二类传染病[l-4]。此病的临床特征为:高热、卡他性鼻液、眼结膜炎、纤维素性胸膜炎、母羊流产、消瘦等等。該病在世界范围内普遍流行,严重危害养羊业发展,给养羊业带来巨大的经济损失。山羊传染性胸膜肺炎在我国流行时间较长,最早在甘肃发现有此病发生,随后,在多个省份报道此病发生,例如在内蒙古、四川、云南、江苏等地[5]。在贵州的流行情况,2001年首次获得丝状支原体山羊亚种分离株[6],2011年首次获得绵羊肺炎支原体分离株[7]。贵州白山羊的原产地和主产区位于铜仁市沿河县,在山羊疾病中传染性胸膜肺炎发病率和死亡率高,年龄在2岁内的山羊较易感染,发病率为37.7%,病死率为36.4%[8]。此病已严重危害贵州养羊业的健康发展。
TLRs是一类天然免疫受体,是高度保守的I型跨膜蛋白,为模式识别受体,是关键的天然免疫分子[9],主要在免疫细胞和上皮细胞上表达。它通过识别病原微生物的保守结构发挥着重要作用,激活天然免疫细胞,导致一系列的机体炎症反应,在机体抵御病原微生物侵袭上发挥重要作用。TLR样受体信号通路介导多种生物学效应,如诱导炎症因子释放,诱导杀菌活性,促凋亡与抗凋亡作用等。MyD88是TLR信号通路中的关键接头蛋白,在传递上游信息和感染疾病发生中至关重要。MyD88与心血管疾病、炎症性肠病、肿瘤等疾病密切相关。
目前,由于MO对山羊肺泡上皮细胞的作用机制尚不是很清楚,本试验以探讨MyD88在MO感染山羊肺泡上皮细胞中作用机制为目的,发现MyD88在MO对山羊肺泡上皮细胞损伤中发挥重要作用,该研究为MO的致病机制研究提供理论基础和参考意见。
1 材料与方法
1.1 材料
1.1.1 支原体与细胞
绵羊肺炎支原体与山羊肺泡上皮细胞于2015年10月在铜仁市沿河县康源白山羊生态养殖农民专业合作社采集,然后将其保存于梵净山特色动植物资源重点实验室。
1.1.2 试剂
胎牛血清和DMEM细胞培养液,购自GIBCO公司;酵母提取物、蛋白胨,购自上海生工公司;Triton X-100细胞裂解液、MTT试剂盒和DMSO,购自北京索莱宝科技有限公司;caspase-3活性检测试剂盒和ST2825抑制剂,购自Apexbio公司;LDH试剂盒,购自南京建成生物工程研宄所;SYBR染料,购于罗氏公司。
1.2 方法
1.2.1 MTT实验
收集对数期的山羊肺泡上皮细胞,用 0.25% 胰蛋白酶消化细胞,用含10%胎牛血清的DMEM培养液配成单个细胞悬液,以每孔103~104个细胞接种于96孔培养板中,每孔总体积为200 μL,边缘孔用无菌的PBS填充。弃去上清,每孔加入150 μL DMSO溶液,置摇床上低速振荡10 min,使结晶充分溶解,在酶联免疫检测仪490 nm处测量各孔的吸光度,具体操作见说明书。
1.2.2 细胞处理
(1)MyD88 mRNA检测组:将细胞传代于六孔板中培养,当单层细胞生长至80%覆盖度时,更换无双抗的细胞培养液,支原体 ∶细胞按10 ∶1的比例感染细胞,在5% CO2、37 ℃环境中孵育。于4、8、12、24 h 4个时间点收集细胞;(2)TNF-α mRNA、IL-8 mRNA、Caspase-3活性、Caspase-8活性、H2O2浓度、NO浓度及LDH浓度检测组:将细胞传代于六孔板中培养,当单层细胞生长至80%覆盖度时,更换无双抗的细胞培养液,将抑制剂不同浓度的ST2825与细胞提前孵育1 h,然后,支原体 ∶细胞按 10 ∶1 的比例感染细胞,在5% CO2、37 ℃环境中孵育,于 24 h 收集细胞。
1.2.3 实时定量PCR检测MyD88、TNF-α、IL-8 mRNA
MyD88 mRNA实时定量PCR检测细胞样品包括4、8、12、 24 h 4个时间点支原体感染组细胞及PBS对照组细胞。
TNF-α、IL-8 mRNA实时定量PCR检测细胞样品包括24 h一个时间点支原体感染组细胞、支原体-抑制剂ST2825(5 μmol/L)组细胞、支原体-抑制剂ST2825(10 μmol/L)组细胞、支原体-抑制剂ST2825(20 μmol/L)组细胞及PBS对照组细胞。
从NCBI网站GenBank查找MyD88、TNF-α、IL-8和 β-actin公布的基因序列,采用Primer 5.0软件设计对特异性引物(表1),引物由上海生工生物技术有限公司合成。
用Trizol一步法提取细胞总RNA,反转录合成cDNA。内参β-actin为对照,在罗氏LightCycler 480荧光定量PCR仪上进行相对定量的PCR反应,反应体系为:2×SYBR Green Master Mix 10 μL,cDNA模板2 μL,上、下游引物各1 μL,双蒸水6 μL。PCR反应条件:95 ℃ 5 min预变性;95 ℃ 15 s,60 ℃ (MyD88、IL-8)或61 ℃(TNF-α、β-actin) 30 s,72 ℃ 30 s,40个循环。每组细胞每个时间点的细胞做3个重复,样本基因MyD88、TNF-α、IL-8的表达强度用其对应的β-actin的量进行校正,即ΔCt=Ct(MyD88、TNF-α、IL-8)-CT(β-actin),相对表达量用2-ΔΔCT法对试验数据进行分析。
1.2.4 Caspase-3与Caspase-8活性检测
取细胞上清液,4 ℃,12 000 r/min离心8 min,按照试剂盒说明书检测 Caspase-3和Caspase-8活性。
1.2.5 H2O2浓度的测定
把H2O2检测试剂在冰上融解,在检测孔加入50 μL样品或标准品。在每个孔内加入 100 μL H2O2检测试剂。轻轻振荡混匀,室温放置30 min,然后立即测定D560 nm。计算出样品中H2O2的浓度,具体操作按照试剂盒说明书进行。
1.2.6 NO浓度的测定
取细胞上清液,4 ℃,12 000 r/min离心7 min,按照说明书检测NO浓度。
1.2.7 LDH实验
取50 μL细胞上清液测LDH的D450 nm,按照说明书进行操作。
1.2.8 统计学分析
采用SPSS 17.0统计软件进行分析,数据用均数±标准差(x[TX-*5]±s)描述,多组样本间均数用方差分析,2组间比较采用2个样本均数的t参数检验或q检验。
2 结果与分析
2.1 抑制剂ST2825对肺泡上皮细胞活性的影响
不同浓度(0、5、10、20 μmol/L)抑制剂ST2825与细胞作用24 h后,收集细胞,利用MTT方法检测细胞活性,结果表明,当抑制剂ST2825浓度为5、10、20 μmol/L不影响细胞活性(图1),可进行后续研究。
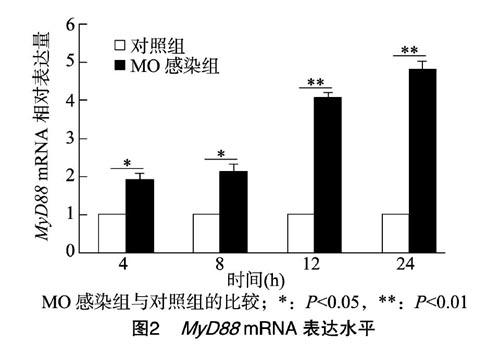
2.2 对不同时间下MO感染肺泡上皮细胞的分析
MO感染肺泡上皮细胞(MOI为10)后,提取细胞的总RNA,用实时定量PCR检测MyD88的mRNA水平。感染时间为4、8、12、24 h,结果发现,在所观察的时间点可以显著提高MyD88 mRNA表达水平(图2)。
2.3 抑制剂ST2825对MO介导的H2O2分泌影响
将不同浓度的ST2825与细胞提前孵育1 h,用MO感染细胞,在24 h检测胞内MO对细胞引起的损伤情况,结果(图3)显示,MO可显著提高H2O2分泌(P<0.01),抑制剂ST2825在 10 μmol/L 和20 μmol/L浓度下可以显著降低MO介导的H2O2分泌(P<0.05),表明ST2825可以降低MO引起的细胞损伤。
2.4 ST2825对MO介导的caspase-3和caspase-8活性的影响
进一步检测ST2825对MO介导的caspase-3和 caspase-8活性的影响,将不同浓度ST2825与细胞提前孵育1 h,再用MO感染细胞24 h,检测caspase-3和caspase-8的活性。结果显示,MO可极显著提高caspase-3(图4-A)和caspase-8(图4-B)的活性(P<0.01),而ST2825在浓度 10 μmol/L 和20 μmol/L时能够显著降低MO介导的 caspase-3(图4-A)和caspase-8(图4-B)的活性(P<0.05)。
2.5 ST2825对MO介导的TNF-α与IL-8 mRNA表达的影响
由图5可知,将不同浓度的ST2825与细胞提前孵育1 h,用MO感染细胞,在24 h检测胞内MO对细胞TNF-α与 IL-8 mRNA的影响发现,MO感染细胞组TNF-α(图5-A)与IL-8(图5-B)mRNA表达水平极显著高于对照组(P<0.01),ST2825在10 μmol/L和20 μmol/L浓度下可显著降低MO介导的TNF-α(图5-A)与IL-8 mRNA(图5-B)表达水平(P<0.05),表明ST2825可以降低MO引起的炎症因子 TNF-α与IL-8 mRNA的表达。
2.6 ST2825对MO介导的NO的影响
将不同浓度的ST2825与细胞提前孵育1 h,然后,用MO感染细胞,在24 h检测胞内MO对细胞引起的损伤情况显示,MO感染细胞组NO水平极显著高于对照组(P<0.01),而抑制剂ST2825在10 μmol/L和20 μmol/L浓度下可以显著降低MO介导的NO分泌(P<0.05),NO是一个非常关键的信号分子,在细胞凋亡过程中起重要作用,结果表明抑制剂ST2825可以降低MO引起的凋亡相关基因NO的表达(图6)。
2.7 ST2825对MO介导的LDH的影响
由图7可知,将不同浓度的ST2825與细胞提前孵育1 h,用MO感染细胞,在24 h检测培养液上清液中LDH水平,结果显示,MO感染细胞组LDH水平极显著高于对照组(P<0.01),而抑制剂ST2825在10 μmol/L和20 μmol/L浓度下可以显著降低MO介导的LDH(P<0.05)。结果表明,MO可引起肺上皮细胞崩解,ST2825可以降低MO引起的细胞崩解度。
3 讨论
TLRs属于一种模式识别受体,可识别病原体的相关分子
模式,识别的范围很广,主要包括脂质类、碳水化合物和脂蛋白等结构,是连接非特异性免疫和特异性免疫应答的一个桥梁[10]。TLR4是TLRs其中的成员,它是通过活化前炎症事件的一系列信号对病原生物所进行的应答,而脂多糖是TLR4配体有效的激动剂[11]。当被感染肺炎支原体后,就会激起宿主体内的免疫应答[12],而天然免疫系统又是宿主抵御病原入侵的第一道防线,其中TLR在其中发挥着主要作用。支原体可激活宿主細胞Toll样受体(TLR)信号通路,致使细胞释放大量的TNF-α和IL-1等因子的释放[13]。本研究表明,在抑制剂ST2825的作用下,可以抑制支原体介导的TNF-α mRNA表达水平。
MyD88依赖性途径是所有的TLR配体所介导的一个关键通路,而MyD88非依赖性途径是TLR3和TLR4专有的信号传导途径的通路。MyD88与TLRs相互作用后,募集IRAK家族蛋白。但在外源刺激下由配体激活后,IRAK-4发挥致IRAK-1磷酸化的激酶作用,磷酸化的IRAK-1继而与MyD88作用。此时,MyD88的TIR结构域与受体发生结合,N端的DD结构域与TRAF6、IRAK-1和IRAK-4复合体共同结合至受体上。而IRAK-1和TRAF-6发生磷酸化反应活化后与MyD88发生解离反应。
caspases家族存在于绝大多数哺乳类细胞中,其中caspase-3与caspase-8在caspase级联反应中作用至关重要,是导致细胞凋亡的关键途径和所有凋亡信号传导的共同通路[14-15]。caspase-8是细胞凋亡步骤中的起始因子,可以直接活化下游效应分子caspase-3。而caspase-3位于细胞凋亡级联反应的下游,也是细胞程序性死亡的关键因子[16]。本试验结果显示,MO可显著提高caspase-3的活性,而ST2825能够显著降低caspase-3的活性,消弱MO对 caspase-3活性的促进作用。
不同浓度下的NO存在促进细胞凋亡和抑制细胞凋亡双重作用。己有研究发现支原体不仅介导宿主发生免疫反应,同时也可引起单核细胞和巨噬细胞坏死或凋亡发生[17]。细胞凋亡是通过级联反应与细胞因子变化致细胞死亡的过程。NO作为参与宿主各种生理和病理过程的多功能因子,低浓度的NO,可保护细胞免受凋亡,但NO的分泌过多可导致多种类型细胞发生凋亡。此外,多种支原体能够通过分泌过量NO来诱导细胞凋亡[18-19]。而NO的表达是由低剂量抑制因子一氧化氮合酶(NOS)所控制的[20],过量的NO与超氧阴离子自由基形成过氧亚硝酸盐,从而活化细胞凋亡的级联反应[21]。
参考文献:
[1]Kusiluka L J,Ojeniyi B,Friis N F,et al. Mycoplasmas isolated from the respiratory tract of cattle and goats in Tanzania[J]. Acta Veterinaria Scandinavica,2000,41(3):299-309.
[2]倪 莉,徐 强,赵 俊,等. 山羊传染性胸膜肺炎病原的分离鉴定和生物学特性[J]. 中国兽医杂志,2011,47(3):26-27.
[3]曹玉璞,叶元康. 支原体与支原体病[M]. 北京:人民卫生出版社,2000:151-162.
[4]Hernandez L,Lopez J,St-Jacques M,et al. Mycoplasma mycoides subsp. Capri associated with goat respiratory disease and high flock mortality[J]. Canadian Veterinary Journal-Revue Veterinaire Canadienne,2006,47(4):366-369.
[5]汪代华,徐刚毅. 山羊传染性胸膜肺炎的流行现状和防制技术[J]. 四川畜牧兽医,2005,32(10):48-49.
[6]万一元,龙 鳌,万晴姣,等. 贵州山羊传染性胸膜肺炎病原的分离鉴定[J]. 中国草食动物,2001,3(4):44-46.
[7]张双翔,周碧君,姜汉雯,等. 山羊传染性胸膜肺炎继发大肠埃希氏菌感染的诊断[J]. 贵州农业科学,2011,39(6):144-146,149.
[8]杨 光,李忠全,崔玉林,等. 贵州白山羊传染性胸膜肺炎流行病学调查报告[J]. 中国畜牧兽医文摘,2012,204(7):119-120.
[9]ONeill L A. Golenbock D,Bowie A G. The history of toll-like receptors-redefining innate immunity[J]. Nature Reviews Immunology,2013,13(6):453-460.
[10]徐恩君,刘亚婷,李 涛. Toll样受体信号转导与原发性肝癌发生发展关系的研究进展[J]. 免疫学杂志,2015,31(8):727-732.
[11]王振辉,马 科,朱晓波,等. TLR4抑制剂TAK-242对高脂饮食诱导的小鼠胰岛素抵抗的干预作用[J]. 免疫学杂志,2016(11):928-934.
[12]Hilliard B,Samoilova E B,Liu T S,et al. Experimental autoimmune encephalomyelitis in NF-κB-deficient mice:roles of NF-κB in the activation and differentiation of autoreactive T cells[J]. Journal of Immunology,1999,163(5):2937-2943.
[13]黃亦彤,钟志勇,吕永慧,等. 肠炎清对免疫复合溃疡型结肠炎模型大鼠结肠组织NF-κB蛋白表达和TLR4、MyD88基因表达的影响[J]. 中国中西医结合消化杂志,2016(12):906-910,915.[LM]
[14]Marani M,Tenev T,Hancock D,et al. Identification of novel isoforms of the BH3 domain protein Bim which directly activate Bax to trigger apoptosis[J]. Molecular and Cellular Biology,2002,22(11):3577-3589.
[15]毛德文,陈月桥,王 丽,等. Caspase-8及Caspase-3与细胞凋亡[J]. 辽宁中医药大学学报,2008,10(10):148-150.
[16]曾 明,丁媛媛,王金萍,等. 可舒胶囊对酒精性肝损伤小鼠肝组织Caspase-3与Caspase-8活性的影响[J]. 中国医药导报,2013,10(27):22-24.
[17]Weldearegay Y B,Pich A,Schieck E,et al. Proteomic characterization of pleural effusion,a specific host niche of Mycoplasma mycoides subsp. mycoides from cattle with contagious bovine pleuropneumonia (CBPP)[J]. Journal of Proteomics,2016,131:93-103.
[18]Li B,Du L P,Sun B,et al. Transcription analysis of the porcine alveolar macrophage response to Mycoplasma hyopneumoniae[J]. PLoS One,2014,9(8):e101968.
[19]Xu X,Zhang H,Song Y L,et al. Strain-dependent induction of neutrophil histamine production and cell death by Pseudomonas aeruginosa[J]. Journal of Leukocyte Biology,2012,91(2):275-284.
[20]Mitsunari M,Yoshida S,Shoji T,et al. Macrophage-activating lipopeptide-2 induces cyclooxygenase-2 and prostaglandin E(2) via toll-like receptor 2 in human placental trophoblast cells[J]. Journal of Reproductive Immunology,2006,72(1/2):46-59.
[21]Bai Fangfang,Ni Bo,Liu Maojun,et al. Mycoplasma hyopneumoniae-derived lipid-associated membrane proteins induce inflammation and apoptosis in porcine peripheral blood mononuclear cells in vitro[J]. Veterinary Microbiology,2015,175(1):58-67.
