人参内生菌B69菌株抑菌物质特性的研究
2019-08-20林星辰田义新王泽牛林飞
林星辰 田义新 王泽 牛林飞

摘要:研究人參内生细菌B69菌株对人参根腐病病原菌的作用机制,通过硫酸铵沉淀、低温乙醇沉淀等方法获得菌株发酵液中活性成分,对其抑菌物质粗提液进行稳定性测定,并对其抑菌成分进行分离,采用平板扩散法测定提取成分的抑菌活性。结果表明,从B69菌株发酵液得到的提取液具有抑菌活性;对抑菌物质粗提物进行高温、酸碱度、紫外线、反复冻融和蛋白酶K处理,抑菌活性均未见明显变化。从B69发酵液中初步分离出具有抑制根腐菌活性的活性肽和胞外多糖。表明B69菌株能产生多种抑菌活性成分,抑菌成分对胁迫条件不敏感,值得进一步开发利用。
关键词:人参;内生细菌;B69菌株;人参根腐病;抑菌物质
中图分类号: S182文献标志码: A
文章编号:1002-1302(2019)09-0167-04
人参(Panax ginseng C. A. Meyer)属五加科多年生草本植物,是传统的名贵中药材。在我国东北地区已经形成规模化种植[1]。人参病害一直是影响人参质量最主要的因素之一,其中人参根腐病是常见的人参土传病害,人参根腐病主要侵染人参的根部,造成根部软化腐烂,危害严重且防治相当困难[2]。在人参栽培中根腐病发病率最高可达50%,可造成巨大的经济损失[3]。
内生细菌在宿主植物中具有丰富的多样性,在与宿主植物长期协同进化的过程中形成了特殊的共生关系[4-5]。因此人参内生菌资源的开发用于人参病害的生物防治,对环境保护和人参质量的提高都有巨大意义。目前人参内生菌的报道多集中在内生菌分离和次生代谢产物的研究上,对植物病害的防治报道较少,人参内生菌这一重要的资源有待于开发。姜云等分离得到的人参内生菌对人参根腐病病菌(Fusarium solani)等多种人参病原真菌具有明显的抑制作用[6]。本试验通过对人参内生细菌B69菌株分泌液中代谢产物进行分离提取,以期明确B69菌株合成的抑菌活性成分组成情况及其抑菌活性的稳定性,为人参的病害防治奠定理论基础。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株 供试菌株B69由笔者所在课题组从人参根中分离得到,经刘学周等鉴定为死谷芽孢杆菌(Bacillus vallismortis)[7]。活性指示菌根腐病病菌,由吉林农业大学农学院植物病理教研室提供。
1.1.2 供试培养基 供试细菌的保存和培养使用营养琼脂(NA)培养基;供试细菌液体发酵培养使用营养肉汤(NB)培养基;病原真菌分离培养使用马铃薯葡萄糖(PDA)培养基。
1.1.3 试验时间地点 菌株抑菌物质特性试验于2017年4—7月在吉林农业大学药用植物实验室进行。
1.2 抑菌物质粗提物的制备及抑菌活性测定
B69菌株的发酵液在4 ℃、10 000 r/min条件下离心 20 min,取上清液,用0.22 μm微孔滤膜过滤,得到抑菌物质粗提液,备用。抑菌活性用平板扩散法测定。
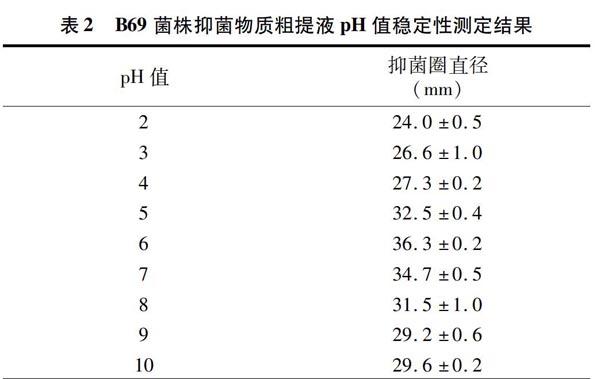
1.3 抑菌物质粗提物稳定性的测定
温度、pH值、蛋白酶、紫外线、反复冻融等稳定性试验参考文献[8]。
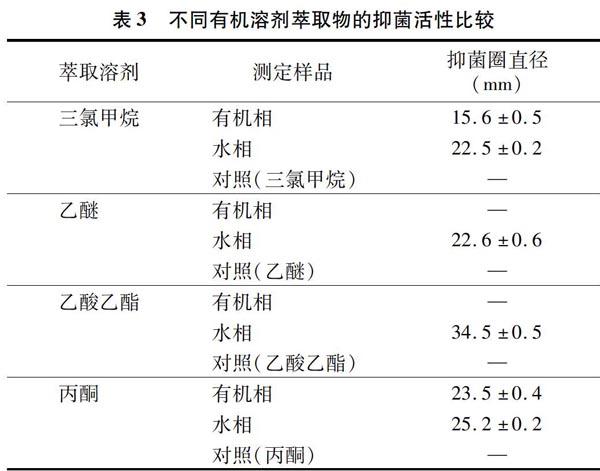
1.4 有机溶剂萃取物制备及其抑菌活性
取4支试管加抑菌物质粗提液,向其中分别加入等体积的有机溶剂(三氯甲烷、乙醚、乙酸乙醚、丙酮)进行萃取。待萃取液分层后,将水相与有机相进行分离,水相部分经 0.22 μm 微孔滤膜过滤。分别测定水相和有机相提取液的抑菌活性,以有机溶剂为空白对照,试验重复3次。72 h后测定其对根腐病病菌的抑菌圈大小。
1.5 抑菌蛋白成分的提取及其抑菌活性检验
1.5.1 硫酸铵沉淀法 在抑菌物质粗提液中加入硫酸铵,使其最终饱和浓度分别达到30%、40%、50%、60%、70%、80%,混匀,于4 ℃静置24 h。以饱和浓度为80%的培养液作为对照。在4 ℃、10 000 r/min条件下离心20 min,分别收集上清液和沉淀,沉淀溶于缓冲液中,测定沉淀和上清液的抑菌活性。
1.5.2 低温乙醇沉淀法 将无水乙醇提前放入冰箱进行预冷处理。在0 ℃冰浴中向抑菌物质粗提液中缓慢加入乙醇使其在溶液中的终浓度分别为50%、60%、70%、80%。于 4 ℃ 静置6 h以上,在4 ℃、10 000 r/min条件下离心20 min,分别收集沉淀和上清液,将沉淀溶于磷酸盐(PBS)缓冲液中,所得沉淀即为蛋白粗提液。测定上清液和沉淀的抑菌活性,以浓度为80%的乙醇培养液作同样的处理为对照。取乙醇上清液和沉淀溶解液各1.5 mL,在4 ℃水浴中加热20 min后,测定抑菌活性。
1.6 脂肽粗提取物的制备及其抑菌活性检验
取10 mL NA发酵上清液,用6 mol/L HCl调节pH值至2.0,4 ℃静置12 h,10 000 r/min离心20 min。所得上清液用NaOH调节pH值为中性后4 ℃保存备用。将沉淀用甲醇溶解,抽滤3次,合并滤液,旋转蒸发浓缩后冷冻干燥,所得干燥样品用PBS缓冲液(0.02 mol/L,pH值为7.2)定容至10 mL,经0. 22 μm滤膜除菌,即得脂肽粗提物。检测脂肽粗提液和上清液的抑菌活性,以发酵上清液为阳性对照,以无菌PBS缓冲液为空白对照,试验重复3次。
1.7 胞外多糖的提取及测定
1.7.1 提取过程 将B69菌株发酵液稀释3倍,在 10 000 r/min 条件下离心10 min,弃菌体,收集离心液。以Sevag法去除蛋白质[9],处理过程如下:由正丁醇和三氯甲烷以1 ∶4的体积比配制Sevag液,将其按4 ∶1的体积比加入离心液中,振荡25 min,6 000 r/min离心10 min,弃沉淀,反复处理3次,得到去除蛋白的离心液。向离心液中加乙醇来沉淀多糖,以空白培养液作同样处理为对照。用BaCl2溶液检测是否将SO42-彻底去除,用碘-碘化钾反应检测是否将培养基中的淀粉彻底去除。
本试验对人参内生菌B69菌株抑菌物质的特性进行了研究。稳定性试验结果表明,人参内生菌B69菌株产生的抑菌物质粗提液耐强酸强碱、对蛋白酶不敏感,紫外线照射和反复冻融对其活性没有明显影响。该菌株分泌的胞外抑菌物质可以被乙醇部分沉淀,但不能被硫酸铵沉淀。抑菌物质提取液经100 ℃处理后,部分失活,乙醇处理后的上清液耐高温。沉淀经100 ℃处理20 min后失活。从B69菌株中得到的粗脂肽提取物具有抑菌活性并且其胞外多糖也具有抑制根腐病病菌的作用,因此目前可知该植株可以至少产生2种抑菌物质。
本试验中得到的多肽具有抑菌活性,近年来,微生物来源的多肽被用于抗真菌病害方面的研究也有很大的进展,它与化学农药相比污染少、对环境友好,在农业生物防治领域具有广阔的应用前景。
近年来,在植物保护领域,多糖被用来诱导植物的抗性防卫反应,如诱导过氧化物酶和几丁质酶的积累,提高植物的抗病能力,或者直接抑制植物病原菌[15],多糖研究正越来越多地引起人们关注[16]。本试验从B69菌株中提取出的胞外多糖能够抑制根腐病病菌的生长,极具研究价值。
本试验在对B69菌株开展抑菌活性研究的基础上,就其次生代谢产物中的抑菌活性成分也开展了初步研究,基本明确了抑菌活性物质的活性部位,这为菌株抑菌活性物质的分离纯化、结构鉴定及抑菌机制研究奠定了良好基础;另外,上述试验结果的获得也将有助于推动人参病害的生物防治。
参考文献:
[1]田义新. 药用植物栽培学[M]. 3版.北京:中国农业出版社,2011.
[2]傅俊范. 药用植物病理学[M]. 北京:中国农业出版社,2007:138.
[3]王 燕,王春伟,高 洁,等. 24种杀菌剂及其相关配比对人参根腐病菌的毒力测定及田间防效[J]. 农药,2014,53(1):61-65.
[4]石晶盈,陈维信,刘爱媛. 植物内生菌及其防治植物病害的研究进展[J]. 生态学报,2006,26(7):2395-2401.
[5]何玲敏,叶建仁. 植物内生细菌及其生防作用研究进展[J]. 南京林业大学学报(自然科学版),2014,38(6):153-159.
[6]姜 云,尹 望,陈长卿,等. 人参内生菌的分离及拮抗菌株的筛选[J]. 吉林农业大学学报,2012,34(5):517-521.
[7]刘学周,李绍宾,赵智灵,等. 西洋参内生菌株的分离及拮抗活性菌株的筛选和鉴定[J]. 中草药,2014,45(22):3332-3336.
[8]谌晓曦,陈卫良,马志超,等. 抗水稻纹枯病菌拮抗蛋白质的理化性质研究[J]. 浙江大学学报(农业与生命科学版),1999,25(5):42-45.
[9]叶凯贞,黎碧娜,王奎兰,等. 多糖的提取、分离与纯化[J]. 广州食品工业科技,2004,20(3):144-145.
[10]陈吴海,马 帆,陈 钢,等. 一株藏红花内生真菌多糖的提取及其抗氧活性研究[J]. 广东化工,2016,22(3):10-11.
[11]Roberts M S,Nakamura L K,Cohan F M. Bacillus vallismortis sp. nov. a close relative of Bacillus subtilis,isolated from soil in Death Valley,California[J]. International Journal of Systematic Bacteriology,1996,46(2):470-475.
[12]張 慧,杨兴明,冉 炜,等. 土传棉花黄萎病拮抗菌的筛选及其生物效应[J]. 土壤学报,2008,45(6):1095-1101.
[13]林 英,司春灿,赵青松,等. 一株死谷芽孢杆菌的分离、鉴定及抗病促生效果初探[J]. 北方园艺,2014(13):88-92.
[14]郝 捷,李 杨,陈 飞,等. 死谷芽孢杆菌对香菇栽培料中木霉菌的抑制研究[J]. 微生物学通报,2013,40(2):228-235.
[15]徐 澜,郭晨晨,赵 慧. 超声波辅助提取藜麦多糖及其抑菌性与抗氧化性[J]. 江苏农业科学,2017,45(11):143-146.
[16]胡月芳. 淮山多糖超声辅助提取及清除超氧阴离子自由基的作用[J]. 江苏农业科学,2017,45(4):144-146.
