自制超薄型琼脂糖凝胶板电泳分离检测血清LDH同工酶及成年人参考范围的建立*
2019-08-20申春艳陆桂琴于嘉屏
申春艳,陆桂琴,于嘉屏
(上海迪安医学检验所中心实验室,上海 200433)
血清中的乳酸脱氢酶(lactate dehydrogenase,LDH)是以同工酶形式存在的,包括LDH1~5的5种同工酶[1]。由于其具有器官特异性的特点,已为临床诊治提供了很多有价值的信息[2-4]。鉴于目前检测LDH同工酶基本采用电泳的方法,商品化的试剂盒还很少,本研究在制备了超薄型琼脂糖凝胶板的基础上[5],建立琼脂糖凝胶电泳的方法来分离和检测血清中的LDH同工酶,也为排除血清中影响LDH总活性及同工酶结果的干扰因素提供了鉴定方法。
1材料与方法
1.1 研究对象 方法学建立采用检验实验室所检测用的新鲜患者血清。参考区间的建立采用133例体检正常的成年人新鲜血清。
1.2 试剂和仪器
1.2.1 试剂
1.2.1.1 电泳缓冲液:称取巴比妥钠15.4 g,巴比妥2.76 g,乙二胺四乙酸0.29 g,加超纯水约800 ml,加热溶解后用l mol/L盐酸校正pH至8.6,最后定容至1 000 ml。
1.2.1.2 琼脂糖凝胶板:用本室前期建立的方法制作超薄型琼脂糖凝胶板[5]。每个密封盒放3块独立包装的凝胶板,用胶带封口,在盒盖上标明相关信息,放4℃冰箱保存。
1.2.1.3 呈色试剂:最终浓度为632.75 mmol/L乳酸锂,0.565 mmol/L NAD,0.4 mmol/L吩嗪二甲酯硫酸盐(PMS),2.67 mmol/L氯化硝基四氮唑蓝(NBT)。分别称取一定量的乳酸锂,NAD,NBT,PMS,混合研磨,分装4℃避光保存。临用时取出一份加0.2 mmol/L Tris-HCl缓冲液(pH9.5)2.5 ml,去离子水7.5 ml使之溶解。
1.2.1.4 庆大霉素溶液:无菌水配制12.8 μl/ml(512U/ml)庆大霉素溶液。
1.2.2 仪器:法国Sebia公司的Hydrasys2全自动电泳仪及LDH同工酶电泳试剂盒;北京市六一仪器厂的DYY-6D型电泳仪电源和DYCP-38C型电泳仪;上海培清科技有限公司的JS-680D全自动凝胶成像分析仪。
1.3 方法
1.3.1 酶反应原理:LDH是糖酵解的一个重要酶,能可逆地催化下述反应:乳酸+NAD+←→丙酮酸+NADH+H+。根据LDH五种同工酶的电泳迁移性的不同可加以识别。迁移最快(最靠近阳极)的为LDH1,其次依次为LDH2,LDH3,LDH4和LDH5。利用酶的催化反应进行显色:以乳酸锂作为底物,LDH催化乳酸脱氢生成丙酮酸,同时使烟酰胺腺嘌呤二核苷酸磷酸(NAD+)还原为NADH,吩嗪二甲酯硫酸盐(PMS)将NADH的氢传递给硝基四氮唑蓝(NBT),使其还原为紫蓝色的甲瓒化合物。其颜色的深浅与LDH酶活性呈正比,利用光密度仪或扫描仪即可得出各同工酶的相对百分含量。
1.3.2 琼脂糖凝胶电泳及酶带染色:①取琼脂糖胶板1块,在胶板阴极侧约1.5 cm处覆盖一张滤纸条,吸去部分水分,然后将加样孔模条置于其上,轻按模条加样孔四周,使其紧贴在胶板上,避免气泡。然后将2 μl样品加入孔内。注意必须使样品全部均匀地充满孔内。加样后静置5~10 min,待样品扩散进入胶内,然后除去膜条。将胶板放入电泳槽上,两端用8层纱布搭桥,电泳槽旁放一冰袋降温,在恒压50V条件下电泳20 min。②电泳完毕将呈色底物均匀布加于胶板上,上面覆盖一张比胶板略大一点的PE薄膜,注意避免气泡,置37℃恒温水浴槽内温育30 min,并注意避光。温育完毕即可见紫蓝色酶带,用5 ml/dl乙酸漂洗至背景干净。③启动凝胶图像分析仪拍摄软件拍照,通过凝胶图像分析软件分析检测结果。
1.3.3 方法学确认
1.3.3.1 精密度:批内精密度实验:将6份不同血清样本进行电泳分析,在同一张10人份的凝胶板上加样,每份样本加样5个泳道,电泳图谱采用光密度扫描计算。批间精密度实验:将10份不同血清样本进行电泳分析,分6批在10人份的凝胶板上加样,每份样本加样1个泳道,电泳图谱采用光密度扫描计算。不同胶片间的精密度实验:分别用6张胶板对4份血清样本进行电泳分析,每份样本加样5个泳道,电泳图谱采用光密度扫描计算。
1.3.3.2 正确度及相关:采用自建LDH同工酶琼脂糖凝胶电泳方法和Sebia电泳仪配套的LDH同工酶电泳试剂盒测定方法分别对31份血清样本进行比较分析。以自建方法为Y,Sebia方法为X,计算相关系数(r)和回归方程(Y=bX-a)。
1.3.3.3 线性范围:选择高、低LDH活性的血清样品各一份。高值活性为1 910U/L,低值活性为73 U/L。将高值(H)和低值(L)样品按5L,4L+1H,3L+2H,2L+3H,1L+4H,5H的体积比混合成6个系列浓度的实验样品。用所建立的电泳方法检测高、混合、低浓度样品,各做5次重复检测,取均值。以预期浓度为X,测定均值为Y,计算回归方程:Y=bX+a。以相关系数r≥0.975,b趋近于1为判断标准。
1.3.3.4 参考区间:取133例体检健康成年人新鲜血清样本进行检测,并统计检测结果,建立本方法的LDH同工酶参考区间。
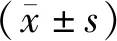
2结果
2.1 琼脂糖凝胶电泳图谱 采用本实验的琼脂糖凝胶电泳方法能成功地分离出LDH同工酶的5条酶带,各条带分离清晰,带型整齐。根据电泳迁移率的快慢,从阴极(下端)到阳极(上端)的5条带依次为LDH5,LDH4,LDH3,LDH2和LDH1。见图1。
2.2 精密度
2.2.1 批内精密度:6份血清样本LDH1的批内CV值为1.07%~8.77%,LDH2的批内CV值为1.13%~3.93%,LDH3的批内CV值为1.01%~4.39%,LDH4的批内CV值为0.46%~6.23%,LDH5的批内CV值为2.30%~6.84%。批内CV值均小于8.77%。
2.2.2 批间精密度:10份血清样本LDH1的批间CV值为1.93%~9.04%,LDH2的批间CV值为2.07%~5.85%,LDH3的批间CV值为2.03%~4.51%,LDH4的批间CV值为3.15%~12.08%,LDH5的批间CV值为4.41%~13.12%。批间CV值均小于13.12%。
2.2.3 不同胶板间精密度:4份血清样本在不同凝胶板之间板间CV值,LDH1为1.04%~2.67%,LDH2为1.20%~3.05%,LDH3为1.33%~4.52%,LDH4为1.74%~7.32%,LDH5为2.97%~7.89%。胶板间CV值均小于7.89%。
2.3 正确度及相关分析 31例新鲜血清样本的结果见表1,自建方法与Sebia方法的5种LDH同工酶结果间的差异均无统计学意义(t=0.0281~0.5674,均P>0.05),且两方法间5种同工酶均显著相关,斜率趋近于1。

表1 两种方法LDH同工酶结果(%)的比较及相关分析

图1 血清LDH同工酶琼脂糖凝胶电泳图谱
2.4 线性范围 LDH1~LDH5的线性范围及回归方程参数、相关系数见表2。5种同工酶的线性相关系数(r)均≥0.975,b趋近于1。表明5个同工酶谱在本方法范围内显示出良好的线性。

表2 LDH同工酶线性范围及回归方程参数和相关系数

表3 LDH同工酶参考区间(%)
3讨论LDH同工酶检测在临床上有着重要的临床意义,肝脏疾病时以LDH5升高为主[6-7],心肌损伤时以LDH1升高为主[8-9],二者同时受损则LDH1和LDH5同时升高[10],对心肌梗死伴有缺氧状况及患者的危险程度具有良好的鉴别价值。
经典的琼脂糖凝胶板厚度常达到3 mm,染料不易渗透进去,同工酶带常会出现空泡,对扫描定量产生干扰。本研究采用自制的超薄型琼脂糖凝胶板,厚度只有0.8 mm,用此凝胶板来分离检测LDH同工酶,酶染色时间缩短至30 min,同工酶图谱呈色清晰,分离效果良好。以往的加样方式是通过齿状加样槽在琼脂糖板上留出凹槽,将样品加入其中,这往往会使胶板破裂。本实验采用有孔的加样膜条直接铺在琼脂糖凝胶板上加样,操作方便,且在琼脂糖胶板上不留痕迹,易于干燥保存。本研究配制的凝胶板中含有抗生素,因此不容易长菌,密封放置4~8℃可长达3个月以上。
本法建立的成人血清LDH同工酶参考区间符合LDH2>LDH1>LDH3>LDH4>LDH5的规律,与Sebia的LDH同工酶电泳试剂盒中的说明书所推荐的参考范围(LDH1为16.1%~31.5%,LDH2为29.2%~41.6%,LDH3为17.0%~26.2%,LDH4为5.9%~12.3%,LDH5为3.2%~17.3%)相比较,有一定差异。这与琼脂糖的纯度、胶板厚度、染色深浅以及人种的差异等因素都有关系。
血清中的LDH总活性及同工酶结果会受到其它酶分子的干扰,严重影响结果的准确性。①巨分子LDH酶[11-12]:大多是LDH的其中一种同工酶与其自身抗体免疫球蛋白结合形成的巨分子酶,在电泳条带上可形成一条宽带,光密度扫描不易分开。巨LDH酶的形成有三种形式:一是某一同工酶与免疫球蛋白(IgA占60%,IgG或 IgM)的复合物;二是与脂蛋白结合;三是同工酶亚基自身异常聚合。聚合物酶带导致电泳图谱发生异样改变,如LDH2至LDH3融合形成一条宽带,或LDH2后有一弥散区,LDH3几乎消失,一般为LDH与抗体结合的免疫复合物。巨分子LDH的出现是否与自身免疫性疾病有关目前尚无定论[13]。②醇脱氢酶(alcohol dehydrogenase,AD)[14]:肝脏中的AD浓度相当高,当肝细胞大量损伤时,AD即从肝脏内释放入血,使血清内AD显著升高,而AD能利用琼脂糖上的羟基等基团参与与LDH同样的反应,导致在LDH染色时在LDH5的阴极侧显示“LDH6”条带。而此“LDH6”条带的出现直接反映了肝脏的损害程度,这类患者死亡率很高[15]。因此,正确鉴定血清中的LDH干扰物质对疾病的正确诊断具有重要意义,这些干扰物质往往会影响LDH酶活性结果的准确性,以及LDH同工酶谱的紊乱,严重时会造成误诊,直接对患者的健康造成难以预料的后果。而本研究建立的琼脂糖凝胶板电泳法就能鉴别这些干扰物质,以确保检验结果的准确无误。
因此,LDH同工酶琼脂糖凝胶板电泳分离方法的建立,不仅向临床提供了LDH同工酶的检测结果,也有助于检验科对LDH异常升高的患者作进一步的鉴别诊断,防止发出错误的检验报告,其应用前景十分广阔。
