人白介素10荧光定量PCR检测方法的建立及其在糖尿病肾病中的表达研究*
2019-08-20岳芳芳倪文娟冷小敏师晶晶曹东东郭明好马东红
岳芳芳,倪文娟,冷小敏,刘 云,师晶晶,曹东东,郭明好,马东红
(新乡医学院第一附属医院a.肾脏病医院肾脏免疫研究所;b.生命科学研究中心,河南卫辉 453100)
白介素10(interleukin-10,IL-10)是目前公认的抗炎与免疫抑制因子,它主要由Th2细胞、调节性T细胞和单核/巨噬细胞产生,在炎症疾病、自身免疫性疾病、器官移植、血液疾病及癌症中具有重要价值,参与炎性反应和免疫反应[1]。研究表明IL-10参与糖尿病肾病(diabetic nephropathy,DN)的发生,其可能成为DN治疗的新靶点之一。而既往关于IL-10在2型糖尿病(type 2 diabetes mellitus,T2DM)或DN中表达水平的研究得出了相矛盾的结论[2-5],为进一步明确IL-10在DN患者中的表达水平,我们有必要建立一种稳定、灵敏的检测方法。本研究主要从模板浓度、引物筛选两方面优化IL-10 RNA荧光定量技术,并进一步对IL-10在DN组及对照组中的表达水平进行批量对比,为DN发病机制的进一步研究奠定基础。
1材料与方法
1.1 研究对象 DN组:选取2017年8月~2018年5月于新乡医学院第一附属医院肾病科及内分泌科住院的33例DN患者,其中DNⅢ期患者11例,平均年龄58.91±10.50岁;DNⅣ期患者22例,平均年龄57.55±10.43岁。对照组:健康体检人员35例,平均年龄53.66±5.80岁。其中,DN组T2DM的诊断符合中国2型糖尿病防治指南(2017年版)[6]中T2DM的诊断标准;根据Mogensen分期,达到DNⅢ期、Ⅳ期标准。所有入组研究对象均知情同意并签署知情同意书。由新乡医学院第一附属医院伦理委员会批准。

1.3 方法
1.3.1 引物的设计与合成:根据Genbank中人IL-10,β-actin的基因序列信息,使用Primer 5.0软件设计3对引物(分别简称P1,P2,P3)。由北京六合华大基因科技有限公司合成。IL-10的荧光定量PCR扩增引物信息见表1。

表1 IL-10的荧光定量PCR扩增引物
1.3.2 血液样本处理:抽取外周静脉血3 ml置于抗凝管中,4℃保存,24 h内进行处理。
分离淋巴细胞:3ml人外周血淋巴细胞分离液加3ml的全血离心,600 g 20 min。吸取环状乳白色淋巴细胞层到另一离心管中;加入同体积的生理盐水清洗淋巴细胞,250 g离心10 min后弃上清;重复清洗2次;弃上清后得细胞,加入500 μl的RNAiso Plus裂解细胞。
1.3.3 RNA的提取及cDNA的合成:提取RNA:向上述匀浆裂解液中加入三氯甲烷(RNAiso Plus的1/5体积量),混匀,室温静置5 min。4℃ 12 000 g离心15 min,吸取上清液至另一离心管中。向上清中加入0.5倍RNAiso Plus体积的异丙醇,混匀,室温静置10 min。4℃ 12 000 g离心10 min,弃上清,加入与RNAiso Plus等量的75%(v/v)乙醇,上下颠倒洗涤离心管管壁;4℃ 7 500 g离心5 min后弃上清。室温沉淀干燥5 min,沉淀干燥后,加入20 μl的RNase-free水溶解沉淀。经超微量分光光度计测定其浓度,并取2 μl进行琼脂糖凝胶电泳检测RNA质量。
PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)进行基因组DNA的去除并进行反转录反应。
1.3.4 荧光定量PCR反应条件的优化:20 μl反应体系:TB GreenTMPremix Ex TaqTMⅡ(Tli RNaseH Plus)10 μl,ROX Reference Dye Ⅱ 0.4 μl,PCR Forward Primer(10 μmol/L)0.8 μl,PCR Reverse Primer(10 μmol/L)0.8 μl,cDNA模板1 μl(在原液的基础上稀释不同的倍数:100,101,102,103,104),灭菌水7 μl。程序设置:预变性95℃ 30s,变性95℃ 5s,延伸60℃ 34s,共40个循环;熔解曲线阶段95℃ 15s,60℃ 60s,95℃ 15s。在反应体系基础上,使用3对不同的引物(P1,P2,P3)进行PCR扩增。
1.3.5 特异性检测:荧光定量PCR结果熔解曲线分析查看是否有特异型单峰,并进一步将荧光定量PCR产物进行琼脂糖凝胶电泳分析,验证扩增产物的特异性。
2结果
2.1 标准曲线 P1的相关系数为0.976 7,斜率为-2.474 6;P2的相关系数为0.782 2,斜率为-1.902 3;P3的相关系数为0.999 6,斜率为-3.272 2。在P3扩增体系下可以得到最优的标准曲线,使起始模板浓度与循环数有良好的线性关系。
2.2 扩增曲线、熔解曲线 P3的扩增曲线符合标准的“S”形荧光扩增曲线,曲线拐点清楚,基线平而无明显上扬趋势;熔解曲线呈单一的主峰,说明扩增产物特异,没有非特异性产物出现,见图1。
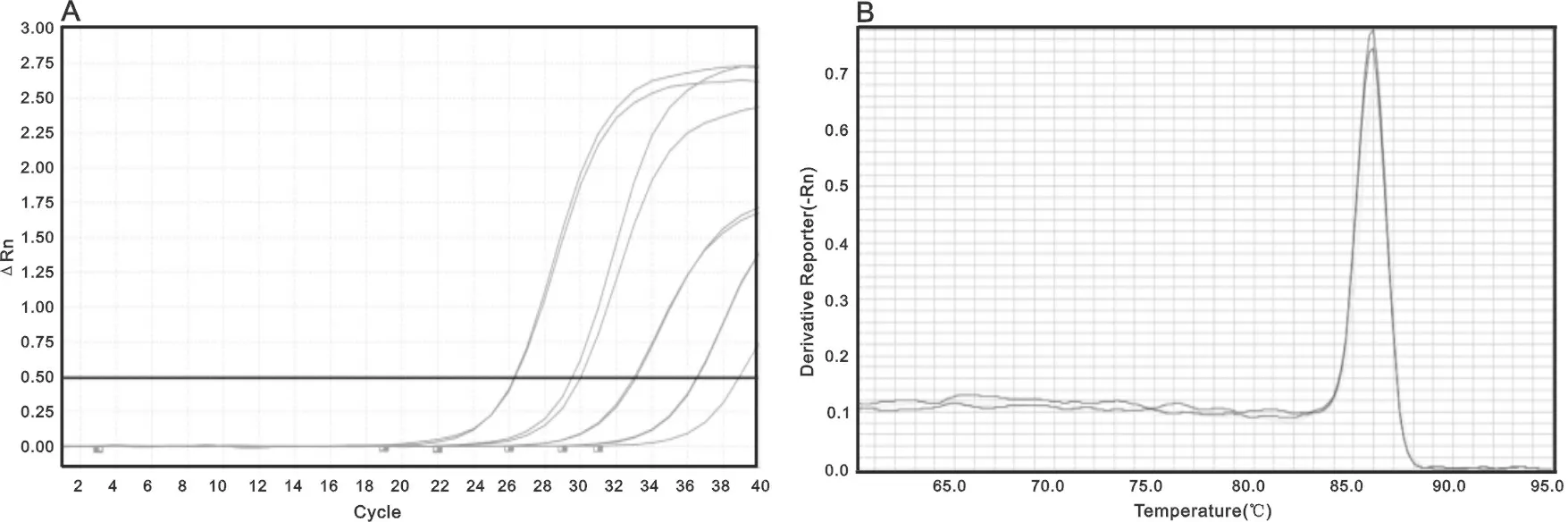
A:cDNA模板在100,101,102,103稀释倍数下,引物为P3时获得的扩增曲线;B:引物为P3时获得的熔解曲线。
2.3 琼脂糖凝胶电泳 应用P1,P3扩增的产物基本稳定,在cDNA模板稀释倍数为100时,条带清晰、稳定,分辨率高;电泳仅观察到一个预测大小的单条带,说明特异性扩增无明显的副产物;当cDNA模板稀释倍数为103,104时,在P1,P3未见扩增产物,见图2。

M:分子量标准 DL2000;1~5:荧光定量cDNA模板稀释倍数依次为:100,101,102,103,104;A,B,C分别为P1,P2,P3在不同cDNA模板稀释倍数下扩增的电泳成像结果。
图2 PCR产物凝胶电泳图像
2.4 DN组与对照组IL-10 RNA表达水平 将建立的实验条件用于检测两组IL-10RNA的表达,结果显示:与对照组(14.39±1.14)相比,DN组(16.21±1.84)的RNA表达水平明显降低,差异有统计学意义(t=7.049,P<0.01)。考虑到DNⅢ期、DNⅣ期的临床表现不同,其IL-10RNA表达可能存在差异。因此,我们又进行了组间对比,结果显示:DNⅣ期患者的RNA水平较DNⅢ期患者稍有升高,差异无统计学意义(t=1.537,P=0.129);但与对照组相比,DNⅢ期(16.69±1.06)与DNⅣ期(15.96±2.09)患者IL-10RNA的表达水平明显降低,差异均有统计学意义(t=8.452,5.248,均P<0.01)。
3讨论以往研究表明,炎症在DN的进展中起着重要作用[7]。IL-10作为目前公认的抗炎与免疫抑制因子,在DN的发生发展过程中具有重要价值。关于在T2DM或DN中IL-10表达水平的检测,目前的研究大部分都采用ELISA法,但得出了相矛盾的研究结果[2-5]。ELISA的检测方法需要特异的抗体和一定量的蛋白,在进行抗原或抗体检测时可能会出现假阳性或假阴性,灵敏度不高[8];对分析低水平表达的细胞因子不够敏感,且只能从单个样本中分析有限的细胞因子。而实时荧光定量PCR(real-time quantitative PCR,qPCR)技术具有操作方法简单、灵敏度高、特异度强的优点,即使是对低水平的细胞因子基因表达,也是一种有效的定量方法。近年来,qPCR被广泛用于定量细胞、体液、组织或组织活检中RNA的表达水平。该技术不仅在分子生物学的各个领域得到了充分利用,在许多疾病的诊断方面,特别是肿瘤的早期诊断、疗效观察以及癌基因与肿瘤的关系方面也有涉及[9-10]。但qPCR 对反应条件的变化相当敏感,一旦条件不合适便得不到理想的结果,所以优化反应条件是qPCR获得可靠结果的前提[11]。
本研究利用qPCR来检测IL-10RNA表达,从模板浓度、引物筛选两方面进行探索,当20 μl反应体系475 ng RNA逆转录成cDNA后取1 μl,引物为F:5’-GTGATGCCCCAAGCTGAGA-3’,R:5’-CACGGCCTTGCTCTTGTTTT-3’时,能够得到较为稳定灵敏的扩增效果。我们前期通过ELISA法对比两组IL-10表达水平,结果显示DN组IL-10表达水平明显低于对照组(P<0.01)。该结果与本实验研究结果是一致的,进一步证实IL-10是参与DN发病机制的一个重要环节,其在DN患者中表达下调。
在关于IL-10在T2DM或DN中表达水平的研究中,本研究结果与YUAN等[4-5]一致,但与AL-SHUKAILI等[2-3]相反,考虑有以下原因:与以往研究不同,在关于DN患者的研究中我们首次参考了Mogensen分期,本研究中病例组主要以DNⅢ期、Ⅳ期为研究对象。WONG等[3]的研究未对入组标本进行分期;AL-SHUKAILI等[2]的研究中其研究对象为T2DM患者,尚未发展至DN阶段。因此研究结果不一致可能与入组标准不一致、入组患者结构、年龄及病程存在差异有关。另外,本研究中DNⅢ期、Ⅳ期患者的IL-10RNA表达无统计学意义,考虑可能受样本量小的影响。综上,本研究优化的实验条件操作简单、结果稳定,利于临床推广应用;该检测方法可为DN抗炎机制的研究提供技术支持。
