PK-15 细胞微载体悬浮培养及PCV2 增殖工艺研究
2019-08-20李亚杰易小萍杨保收
梁 武,乔 健,李亚杰,易小萍,杨保收
(1.中国农业大学动物医学院,北京 海淀100193;2.天津瑞普生物技术股份有限公司,天津 空港300308;3.华东理工大学生物反应器国家重点实验室,上海 徐汇200237)
猪圆环病毒病(PCVD)主要由猪2 型圆环病毒(PCV2)引起的免疫抑制性疾病,造成免疫抑制,使猪群生产性能下降,自1991 年发现以来已成为危害养猪的主要疫病之一,给世界养猪业带来了巨大的损失。疫苗免疫是预防PCVD 最有效的手段,目前国内外学者对PCV2 疫苗的研究主要是从灭活疫苗、嵌合病毒疫苗、亚单位疫苗、重组腺病毒基因工程疫苗以及核酸疫苗等方面进行研究。在我国,已商品化的PCV2 疫苗绝大部分为全病毒灭活疫苗,但PCV2 增殖滴度较低,PCV2 感染宿主细胞后,病毒采用滚环复制(Rolling circle replication)模式进行复制,在病毒生长的S 期复制效率较高,随宿主细胞复制而复制,因此,PCV2 的复制周期比其他病毒长,这为研究高效PCV2 疫苗带来了障碍[4-5]。为了提升PCV2 疫苗市场竞争力,就需要优化疫苗生产工艺,降低生产成本,减少批间差异,保证产品质量稳定。本研究利用细胞微载体悬浮培养技术摸索PCV2 在敏感细胞株PK-15 细胞增殖工艺,旨在打破现有PCV2 灭活疫苗生产过程中病毒效价低的技术瓶颈,从而进一步提升PCV2 疫苗质量和临床免疫效果,带动行业技术升级。
1 材料与方法
1.1 材料
1.1.1 病毒毒株、细胞与血清 猪圆环病毒PCV2-ZJ/C 株,病毒含量107.5TCID50/mL,由天津瑞普生物技术股份有限公司制备、保存;PK-15 细胞由本公司研究院保存,新生牛血清,购自美国Gibco 公司。
1.1.2 培养基及生物反应器 PK-15 细胞专用低血清培养基P-LSM,购自苏州沃美生物技术有限公司(货号P22301-2);14 L、42 L 生物反应器,购自德国赛多利斯(Sartorius)公司。
1.1.3 单抗及微载体 PCV2 免疫荧光单抗由浙江大学周继勇教授惠赠;Cytodex1 微载体,购自GE Healthcare 公司。
1.2 试验方法
1.2.1 细胞密度的测定 采用结晶紫染色法,计算微载体上细胞数量,具体步骤为:将样品吹打均匀后取出1 mL 微载体悬液置于EP 管中,1 000 r/min,离心5 min 后弃上清,加入等量的0.1%柠檬酸结晶紫(0.1 mol/L)溶液并混匀,37 ℃孵育1 ~2 h 后,用移液枪吹打,使微载体上的细胞脱落并保证细胞核全部释放,稀释后用血球计数板计数释放的细胞核,即为细胞的密度。
1.2.2 病毒滴度的测定 参照农业部第1893 号公告,按照“猪圆环病毒2 型灭活疫苗(ZJ/C 株)制造及检验试行规程”进行PCV2 ZJ/C 株毒液病毒滴度的测定(间接免疫荧光法)。
1.2.3 细胞初始接种密度优化 设定0.25×106、0.5×106、0.75×106、1.00×106cells/mL 四个初始细胞接种密度,分别接种于14 L 生物反应器培养,每隔24 h 取样进行细胞计数,绘制细胞生长曲线。其他参数条件为:微载体浓度:3 g/L,搅拌转速:60 r/min,pH 值:7.2,溶氧(DO)40%,培养温度:37 ℃,培养基:P-LSM 专用低血清培养基。
1.2.4 微载体浓度的优化 选取浓度分别为2、3、4、5 g/L 的微载体与适量细胞浓度(0.5×106cells/mL)悬液于14 L 反应器进行培养,观察不同微载体浓度对细胞生长影响,确定微载体最适浓度。其他参数条件:细胞初始接种密度:0.5×106cells/mL,搅拌转速:60 r/min,pH 值:7.2,溶氧(DO)40%,温度:37 ℃,培养基:P-LSM 专用培养基。
1.2.5 搅拌转速选择 设定50、60、70、80 r/min 4个搅拌转速,于14 L 反应器培养,每隔24 h 取样观察计数、绘制细胞生长曲线,选择最适搅拌转速。其他参数条件:细胞初始接种密度:0.5×106cells/mL,微载体浓度:3 g/L,pH 值:7.2,溶氧(DO)40%,温度:37 ℃,培养基:P-LSM 专用培养基。
1.2.6 不同接毒时间对ZJ/C 株增殖的影响 将PK-15 细胞以0.5×106cells/mL 的密度接种于14 L反应器,分别在细胞生长0、6、12 h 和24 h,以病毒感染复数(MOI)0.5 接种PCV2-ZJ/C 株,于培养24、48、72 h 和96 h 分别取样,测定病毒滴度,确定最适接毒时间。其他参数条件:溶氧(DO)40%,转速:60 r/min,温度:37 ℃。
1.2.7 接毒剂量对ZJ/C 株增殖的影响 将PK-15细胞以0.5×106cells/mL 密度接于14 L 反应器,细胞培养6 h 时,分别设定MOI 为0.05、0.5、1、3 四组,于病毒培养24、48、72 h 和96 h 取样,测定病毒滴度,确定最适接毒剂量。其他参数条件:转速:60 r/min,温度:37 ℃。
1.2.8 收毒时间的确定 将PK-15 细胞以0.5×106cells/mL 密度接种于14 L 反应器中,细胞培养6 h 接毒(MOI 为0.5),于病毒培养第60、72、96 h和120 h 分别取样,测定病毒滴度,确定最适收毒时间。其他参数条件:病毒感染复数:0.5,转速:60 r/min,培养温度:37 ℃。
1.2.9 培养温度对PCV2 增殖的影响 将PK-15细胞以0.5×106cells/mL 密度接种于14 L 反应器中,培养6 h 后接毒,分别设定36 ℃、37 ℃、38 ℃、39 ℃培养,于病毒培养60、72 h 和96 h 取样,测定病毒滴度,确定最适培养温度。其他培养条件:病毒感染复数:0.5,转速:60 r/min。
1.2.10 PK-15 细胞悬浮培养消化与放大工艺验证 按照预准备、细胞消化、重悬培养三步进行放大工艺研究,方法如下:(1)预准备:细胞消化前,先将适量培养基与微载体处理液注入42 L 反应器;(2)清洗:将14 L 反应器细胞打入消化罐,间断性搅拌弃去生长液,注入PBS,清洗微载体;(3)消化:将适量胰酶注入消化罐中,采用间歇性搅拌弃去胰酶方式消化载体上细胞;(4)终止:将生长液注入消化罐中,搅拌终止消化并注入42 L罐。补足培养液。参数如下:转速:35 r/min,病毒培养温度:39 ℃,MOI:0.5,病毒培养96 h 收获,测定病毒滴度。
2 结果与分析
2.1 细胞初始接种密度优化 选择0.25×106、0.5×106、0.75×106、1.00×106cells/mL 四个接种密度分别于14 L 反应器培养,结果表明,密度为0.5×106cells/mL 和0.75×106cells/mL 时,细胞生长延滞期均较短,均可达到最大细胞密度,基于生产成本考虑,选择0.5×106cells/mL 为细胞的最佳初始接种密度(见图1)。
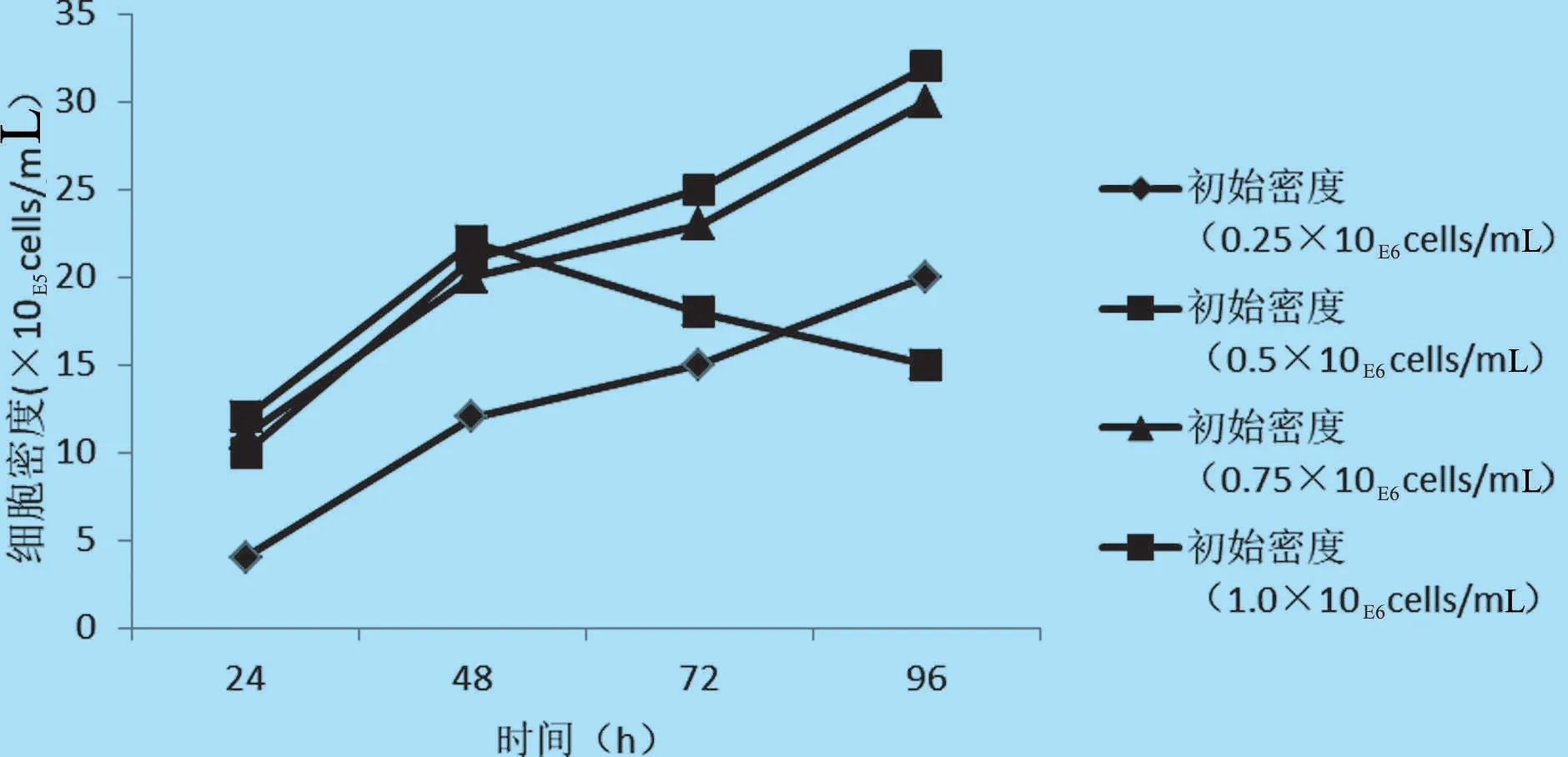
图1 不同初始接种密度PK-15 细胞生长曲线
2.2 微载体浓度优化 选取2、3、4、5 g/L 的微载体浓度与0.5×106cells/mL 细胞悬液在14 L 反应器培养,结果表明,当微载体浓度为3 g/L 时,细胞于微载体上生长满球率最高,达到95%以上(见图2、图3),初步确定3 g/L 为最佳微载体使用浓度。
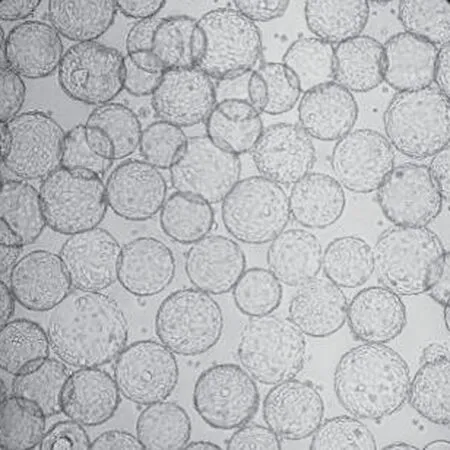
图2 PK-15 细胞在3 g/L 微载体浓度下状态 (20×)
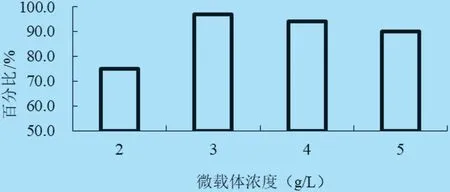
图3 不同微载体浓度培养PK-15 细胞比较
2.3 搅拌转速的选择 选取不同搅拌转速于14 L反应器进行PK-15 细胞培养,结果表明,当搅拌转速为60 r/min 时,细胞生长密度最大,因此,选择60 r/min 为最适搅拌转速(见图4)。
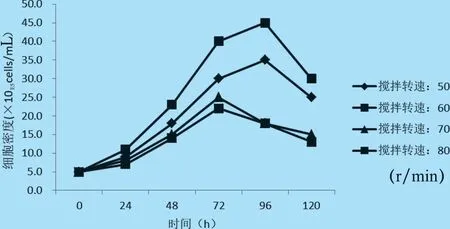
图4 不同搅拌转速下PK-15 细胞生长密度的比较
2.4 病毒接种时间的确定 选取细胞生长0、6、12 h 和24 h 四个接毒时间于14 L 反应器进行病毒培养,于细胞培养24、48、72 h 和96 h 取样,测定病毒滴度。结果表明,当细胞生长6 h 时接毒,产毒效果最好,培养96 h 收获病毒滴度可达108.0TCID50/mL,因此,确定细胞培养6 h 为最佳接毒时间(见图5)。
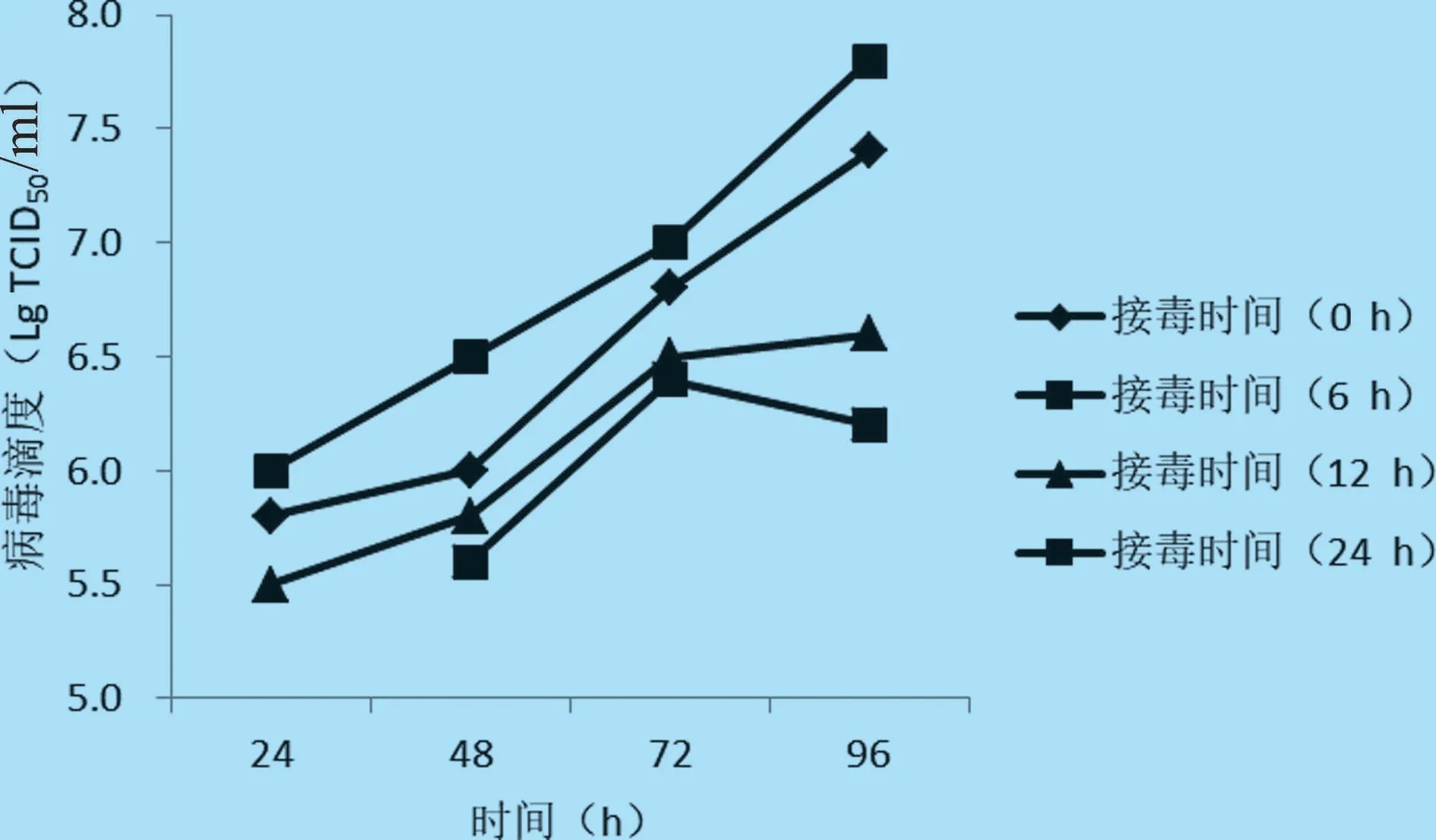
图5 不同接毒时间的PCV2 增殖曲线
2.5 病毒感染复数(MOI)的确定 选取接毒剂量(MOI)为0.05、0.5、1、3 于14 L 反应器进行病毒培养,病毒培养24、48、72 h 和96 h 取样,测定病毒滴度。结果表明,病毒感染复数MOI 为0.5、1 时,产毒效果最好,病毒最高滴度107.8TCID50/mL,因此,考虑成本因素,选择MOI 为0.5 为最佳接毒剂量(见图6)。
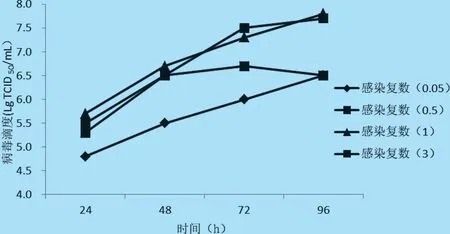
图6 不同接毒剂量的PCV2 增殖曲线
2.6 最佳收毒时间的确定 选取病毒培养60、72、96 h 和120 h 四个不同收毒时间于14 L 反应器进行病毒培养。结果表明,96 h 收获病毒滴度最高,达到108.5TCID50/mL,因此,选择96 h 为最佳收毒时间(见图7)。
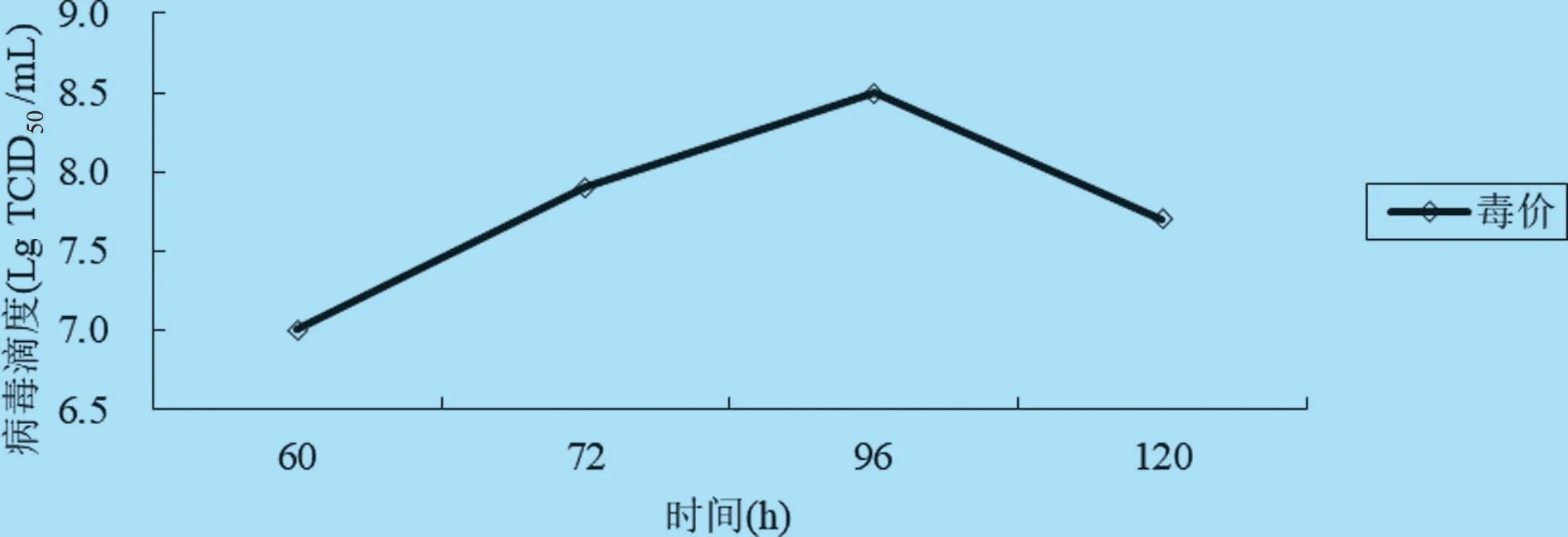
图7 最佳收毒时间的确定
2.7 病毒培养温度的确定 选择36 ℃、37 ℃、38 ℃、39 ℃4 个温度于14 L 反应器进行病毒培养,病毒培养60、72 h 和96 h 取样,测定病毒滴度。结果表明,39 ℃时细胞生长较快,产毒较37 ℃培养要高,最高滴度108.5TCID50/mL,较37 ℃培养高0.5 个滴度。因此,选择39 ℃为最佳病毒增殖温度(见表1)。
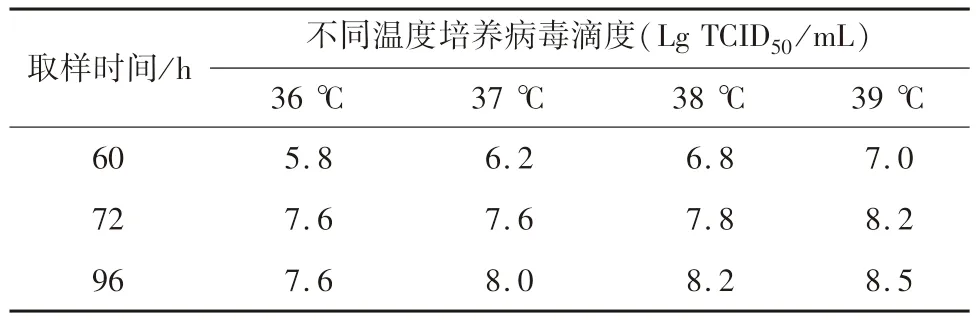
表1 不同培养温度下PCV2 增殖滴度
2.8 微载体悬浮培养PK-15 细胞14 L 罐消化分散结果 按1.2.10 项方法,将14 L 反应器微载体悬浮培养48 h 的PK-15 细胞进行消化分散。结果表明,95%以上的PK-15 细胞从微载体上成功消化,细胞分散良好,折光性好,无明显结团现象,可满足下一级42 L 罐进行PCV2 病毒培养(见图8)。
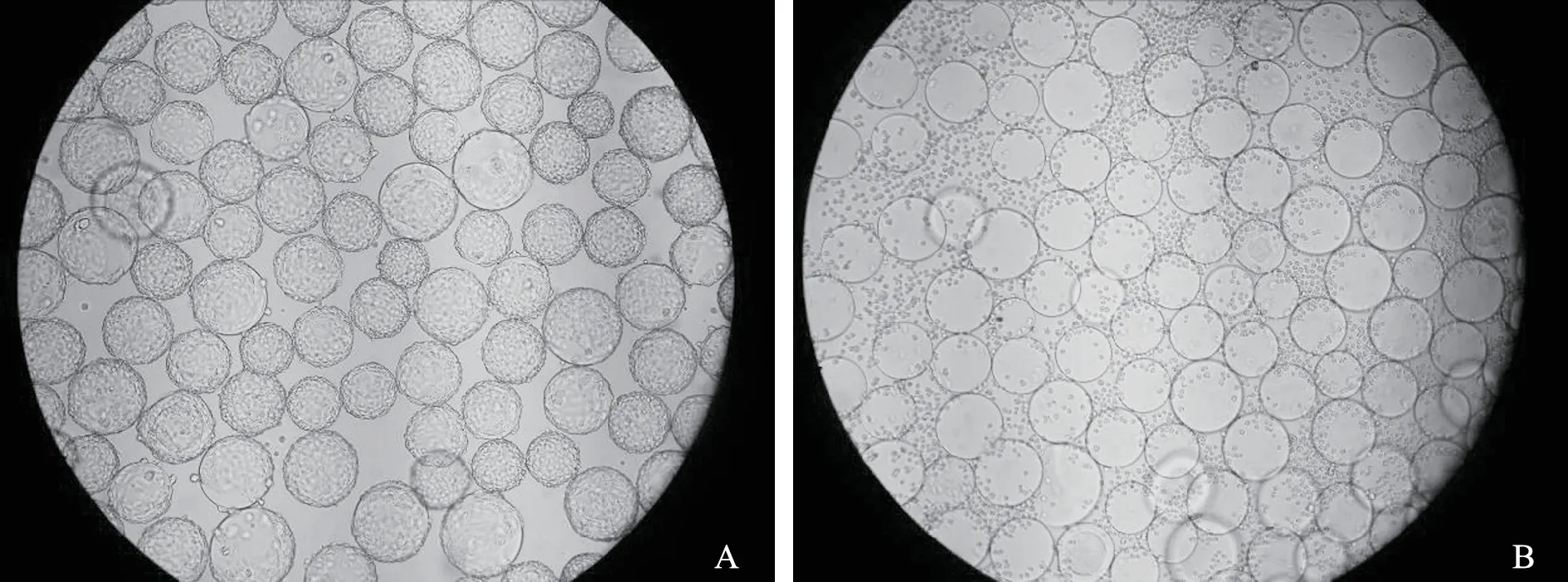
图8 14 L 反应器培养PK-15 细胞消化分散效果
2.9 PCV2 ZJ/C 株的生物反应器42 L 放大培养工艺验证及与转瓶培养工艺的比较 按方法1.2.10项确定的工艺参数,于42 L 反应器中培养48、72、96 h 后收获病毒,结果表明,按上述14 L 已摸索接毒工艺,病毒培养96 h 收获,病毒滴度可稳定在108.3TCID50/mL,是转瓶培养工艺的10 倍(见表2)。因此,本研究初步建立了一种高效、稳定、低成本利用PK-15 细胞反应器微载体悬浮培养PCV2 抗原的生产工艺。
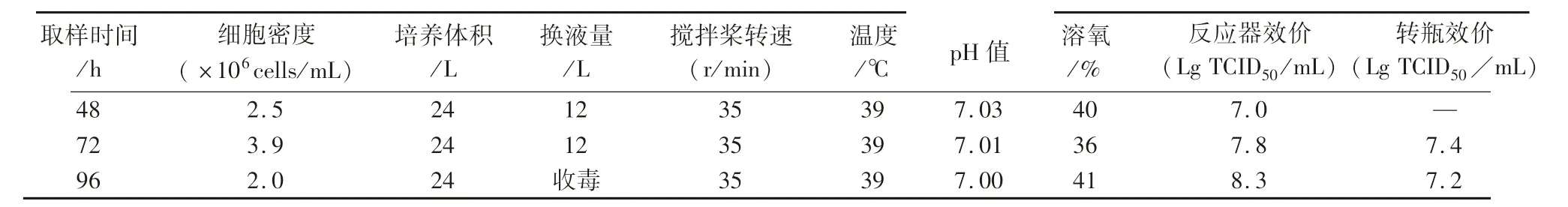
表2 42 L 生物反应器培养PCV2 ZJ/C 株毒价验证
3 讨论
应用微载体培养技术,初期细胞快速贴附并延展是培养成功的关键之一,因此,多数学者趋向于提高细胞初始接种密度和采用间歇搅拌方式。但也有人提出间歇搅拌会使细胞在微载体上贴附不均一,出现空微载体的几率大大增加[6-7]。本研究发现,当初始接种密度为0.5×106cells/mL 和0.75×106cells/mL时,细胞生长延滞期均较短,细胞密度最大,并没有因初始接种密度的无限增大而增加细胞密度,进一步说明高接种密度时,细胞会更早进入对数生长期,细胞受到接触抑制作用的程度比低接种密度组更强,使得细胞比生长速率下降更快;而采用低转速连续搅拌效果较好,可使细胞在微载体上均匀分布,对细胞生长影响最小,微载体满球率更高。
微载体消化放大工艺是指用胰蛋白酶消化上一级反应器中贴附于微载体上的细胞,并把细胞或细胞和旧微载体接入下一级更大规模反应器,补加新微载体和新鲜培养基进行新一轮的培养。本研究采用将消化下来的细胞和旧微载体一起接入下一级反应器的方法,解决了新旧微载体上细胞贴附不均匀的问题,从而提高了消化放大过程中的细胞回收率,减少了新微载体的消耗。消化放大工艺中存在的种种难题是微载体广泛应用于大规模生产的障碍,除了细胞培养、消化等设备的限制,微载体上连续消化传代过程中细胞生长速率的急剧下降是普遍面临的难题。Forestell 等认为培养基中的血清浓度是关键因素,他们证明降低培养基中血清含量可有效缓解MRC-5 细胞在微载体传代过程中生长速率的下降[8-9]。
本研究通过对PK-15 细胞悬浮驯化及生物反应器培养参数优化研究,进一步说明应用生物反应器系统和微载体悬浮培养技术培养PK-15 细胞,在细胞密度、比生长速率等方面均优于传统转瓶培养方式;在此基础上,通过优化PCV2 在生物反应器培养工艺参数,进行了14 L 至42 L 生物反应器消化放大并获得成功,其病毒滴度较转瓶相比提高了约10 倍,为下一步实现1 000 升级工业规模放大工艺奠定了基础。
