氟苯尼考胁迫对土壤细菌耐药性的影响
2019-08-20牛金利彭金菊明月月
牛金利,彭金菊,明月月,吴 群,马 驿
(广东海洋大学农学院动物医学系,广东 湛江524088)
氟苯尼考(Florfenicol)又称为氟甲砜霉素,是一种动物专用的广谱抗生素,在酰胺醇类药物中其抗菌活性优于氯霉素及甲砜霉素,特别对一些耐氯霉素及甲砜霉素的大肠杆菌、沙门菌、克雷伯菌仍表现出较高的抗菌活性。氟苯尼考被广泛用于预防或治疗家畜的细菌感染性疾病,主要用于敏感细菌所致的猪、鸡及鱼的细菌性疾病,尤其对呼吸系统感染和肠道感染疗效显著[1]。近年来,由于抗菌药的大量使用和滥用,动物源性致病菌和环境细菌的耐药率逐渐上升,多重耐药现象也日益严重[2-3]。Goni[4]在对187 株沙门菌的耐药性进行检测时发现,有103 株具有多重耐药性。相关研究认为,兽用抗生素的大量使用,不仅影响环境中微生物的数量和功能,而且会使细菌产生耐药性基因并遗传,造成环境生态结构的改变,从而使土壤、水等环境中的耐药细菌种类和数量不断增加[5-6]。 本试验通过在土壤中添加不同浓度的氟苯尼考,分离培养土壤细菌,采用微量肉汤二倍稀释法测定氟苯尼考对土壤优势细菌的敏感性,同时采用药敏纸片扩散法测定用药前后分离的氟苯尼考敏感菌和耐药菌对18 种抗菌药物的敏感性,进而了解氟苯尼考对土壤优势细菌耐药性的影响。
1 材料与方法
1.1 材料 土壤:采自广东海洋大学校内菜地10 ~20 cm 的优质土壤。经检测不含氟苯尼考。氟苯尼考:含量98%,华北制药股份有限公司(批号13021322)。药敏纸片:链霉素、阿奇霉素、多粘菌素B、头孢氨苄、头孢唑啉、丁胺卡那霉素、复方新诺明、利福平、多西环素、青霉素、恩诺沙星、氟苯尼考、红霉素、克林霉素、卡那霉素、苯唑西林、大观霉素、呋喃唑酮,杭州驰成医药科技有限公司。培养基:LB 固体培养基、LB 液体培养基,北京凯欧迪生物科技有限公司。
1.2 方法
1.2.1 土壤处理与分组 采集的土壤过4 mm 筛,阴干后按每组2.5 kg 分装于塑料桶内,共5 组,加入氟苯尼考使各组土壤中的药物浓度分别为:Ⅰ组0 mg/kg、Ⅱ组0.1 mg/kg、Ⅲ组1 mg/kg、Ⅳ10 mg/kg、Ⅴ组100 mg/kg,每组3 个重复。调节土壤含水量至田间最大持水量的50%,用透气纱布覆盖,25 ℃±3 ℃的室温下培养。
1.2.2 样品的采集 在用药后第14 天、28 天、56天分别从各组中采集土壤用灭菌蒸馏水进行倍比稀释,制备细菌悬液。具体稀释方法:取10 g 土壤样品于250 mL 锥形瓶中,加入90 mL 灭菌水,震荡摇匀30 min 后取10 mL 悬浮液于另一个250 mL 的锥形瓶中,再加入90 mL 的灭菌水,以此类推,依次稀释到适宜的浓度。
1.2.3 细菌的分离、培养 将上述制备好的不同浓度的细菌悬液各取0.1 mL 均匀涂布在LB 固体培养基上,每组涂10 个培养皿,28 ℃培养48 h。观察细菌生长情况。每组挑取60 株乳白色、半透明、表面较光滑、边缘整齐、易挑取的中等大小的优势菌落接种到LB 液体培养基中,28 ℃培养24 h。
1.2.4 氟苯尼考对土壤优势细菌耐药性的影响
1.2.4.1 土壤优势细菌对氟苯尼考的敏感性试验采用微量肉汤二倍稀释法测定土壤优势细菌对氟苯尼考的敏感性。培养24 h 的土壤细菌采用平板计数法计数,用LB 肉汤稀释至105CFU/mL。取灭菌的96 孔板,于每一排的各孔中加入菌液,在第1孔中加入药液,然后依次稀释至第11 孔,第12 孔为不加药对照,使各排12 个孔的菌液中氟苯尼考含量分别为:256、128、64、32、16、8、4、2、1、0.5、0.25、0 μg/mL。稀释完28 ℃培养24 h 后观察并记录结果,每株细菌重复3 次。
1.2.4.2 土壤优势细菌对其他抗菌药物的敏感性试验 取30 株加药前分离的氟苯尼考敏感菌和用药后第56 天分离的30 株氟苯尼考耐药菌,进行对18 种抗菌药物的敏感性试验。药物的敏感性试验按照美国NCCLS 药敏试验纸片扩散法进行:培养过夜的细菌用LB 稀释至105CFU/mL,吸取0.1 mL 的菌液于LB 固体培养基上,均匀涂布,贴药敏纸片后28 ℃培养24 h,测定抑菌圈直径。每种药物重复3 次。
1.2.5 数据统计与处理 试验数据采用SPSS20.0统计分析软件进行单因素方差分析检验差异显著和Excel 软件进行方差分析。
2 结果与分析
2.1 氟苯尼考残留对土壤优势细菌耐药性的影响 对分离的优势菌鉴定结果表明,绝大多数菌株为革兰阴性菌,菌体杆状或弯曲状,单个、成对或短链状,水解明胶、淀粉试验阴性,葡萄糖氧化发酵(O/F)试验为O(氧化产酸),细胞色素氧化酶试验阳性,运动性试验阳性。结合部分细菌基因测序鉴定,培养分离的土壤优势细菌为芽孢杆菌属(Bacillus)和假单胞菌属(Pseudomonas)的细菌。
氟苯尼考对细菌的MIC(最小抑菌浓度)小于或等于加药前60%细菌的MIC 时,判定该菌株对氟苯尼考敏感。氟苯尼考对分离的菌株的MIC 大于或等于加药前60%细菌的MIC 的8 倍时,判定该菌株对氟苯尼考耐药,为耐药菌株。
通过本试验可知,氟苯尼考对加药前分离的优势细菌中60%以上的菌株的MIC=16 μg/mL,故MIC≤16 μg/mL 的菌株为敏感菌株,MIC≥128 μg/mL 的菌株为耐药菌株。
氟苯尼考残留对土壤优势细菌的耐药性作用在加药后第14 天、28 天、56 天分见表1、表2、表3。结果表明,随着药物浓度的加大和药物作用时间的延长,耐药菌的数量逐渐增多。
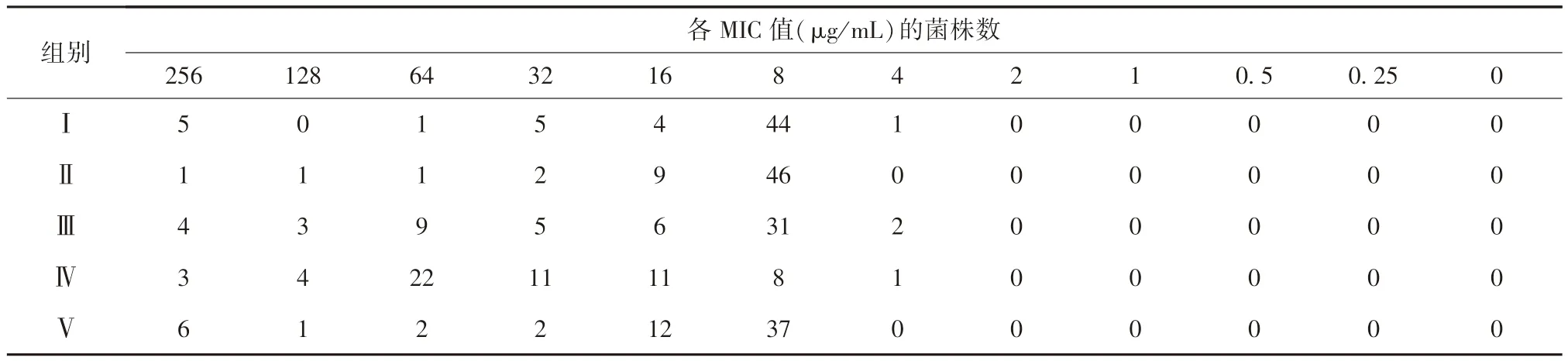
表1 用药后第14 天土壤细菌对氟苯尼考的敏感性试验结果
用药后14 d(表1),Ⅰ~Ⅴ组耐药菌株数依次 为5、2、7、7、7 株,耐药率分别为8.33%、3.33%、11.67%、11.67%、11.67%,耐药率随药物浓度逐渐 升高。

表2 用药后第28 天土壤细菌对氟苯尼考的敏感性试验结果
用药后28 d(表2),Ⅰ~Ⅴ组耐药菌株数依次为5、4、9、8、14 株,耐药率为8.33%、6.67%、15%、13.33%、23.33%,耐药率随药物浓度逐渐升高。

表3 用药后第56 天土壤细菌对氟苯尼考的敏感性试验结果
用药后56 d(表3),Ⅰ~Ⅴ组耐药菌株数依次为6、7、9、15、16 株,耐药率为10%、11.67%、15%、25%、26.67%,耐药率随药物浓度逐渐升高。

表4 用药后土壤细菌对氟苯尼考耐药率的比较
从表4 可以看出,土壤细菌对氟苯尼考的耐药率分别为:Ⅰ组8.33% ~10%,Ⅱ组3.33% ~11.67%,Ⅲ组11.67% ~15%,Ⅳ组11.67% ~25%,Ⅴ组11.67%~26.67%。表明,随着时间的延长,在药物浓度相同条件下,细菌的耐药率逐渐升高。
2.2 土壤优势细菌对其他抗菌药物的敏感性试验
利用药敏纸片扩散法测定18 种抗菌药对用药前分离的30 株氟苯尼考敏感菌和用药后56 d 分离的30 株氟苯尼考耐药菌的抑制情况。试验结果见表5,在供试的18 种抗菌药中,氟苯尼考敏感菌对红霉素、克林霉素、卡那霉素等9 种抗菌药的敏感性显著高于氟苯尼考耐药菌(P <0.01);氟苯尼考敏感菌对头孢唑林、复方新诺明、多粘菌素B 的敏感性与其耐药菌差异不显著(P >0.05);对链霉素、利福平等4 种抗菌药的敏感性与其耐药菌差异显著(P <0.05);而苯唑西林和青霉素G 对氟苯尼考敏感菌和耐药菌无抑制作用(抑菌圈直径为0 mm)。
3 讨论
3.1 氟苯尼考残留对土壤优势细菌耐药性的影响抗生素的大量使用和滥用而引起细菌耐药的问题已经引起人们的密切关注。范葶莉等[7]通过建立土壤生态模型,发现随着硫酸黏菌素浓度的逐渐增大,土壤环境中的耐药菌数量就会增加。彭金菊等[8]在池塘水中加入不同浓度的诺氟沙星,诱导水中的细菌产生耐药性,结果表明,诱导水中细菌产生耐药性的诺氟沙星的最低浓度是8 μg/mL。马驿等[9]研究表明,细菌对恩诺沙星的耐药率和耐药水平随土壤中药物浓度的加大和时间的延长而明显增加。本试验结果表明,土壤中添加氟苯尼考后,土壤优势细菌对氟苯尼考的耐药率会随药物浓度的加大和作用时间的不断推移而逐渐增多。细菌耐药性是靠耐药基因的水平传播[10]还是通过质粒进行垂直克隆传播[11],细菌耐药性具体的传播途径如何,环境细菌的耐药性是否能传递给人源或动物源细菌,还需要更深一步的研究。

表5 抗菌药对土壤细菌的抑制作用
3.2 土壤优势细菌的多重耐药试验 动物和人类病原菌的多重耐药现象已经非常普遍,环境细菌的多重耐药现象也越来越多。李晴等[12]研究从污水处理厂污水中分离的50 株产超广谱β-内酰胺酶大肠杆菌阳性菌株对19 种抗菌药物的敏感性时发现,其对氨苄西林、头孢噻吩、头孢噻肟呈100%的耐药性;对阿莫西林、复方新诺明、氨曲南等呈一定耐药性。杨守深等[13]检测196 株菌对18 种抗菌药物的敏感性时发现,对青霉素、四环素、红霉素、氨苄西林、泰乐菌素、阿奇霉素、苯唑西林和万古霉素高度耐药。本试验结果表明,18 种抗菌药中有9 种药物对氟苯尼考耐药菌的敏感性都显著低于对氟苯尼考敏感的细菌,表明对氟苯尼考耐受的细菌对其他的抗菌药物也有耐受性,而对多粘菌素B、复方新诺明和头孢唑啉的差异不显著,苯唑西林和青霉素G对氟苯尼考敏感菌和耐药菌均无抑制作用。李琳等[14]发现130 株分离菌中有118 株菌对三种或三种以上的抗生素显示耐药,且耐药率有的高达95%以上。另外,耐药菌的广泛传播是否会通过水、食物、环境污染等传播给人类或动物引起人们的高度重视。
