犬DEA1.1 血型抗体间接Dot-ELISA 检测方法建立
2019-08-20姜忠玲丰艳妮曹荣峰田文儒李华涛
王 娟,姜忠玲,丰艳妮,丛 霞,曹荣峰,田文儒,李华涛
(青岛农业大学动物医学院,山东 青岛266109)
在犬临床输血治疗过程中,DEA1.1 和DEA1.2的抗原-抗体反应是导致急性输血性溶血的最主要因素[1],鉴定DEA1.1 血型是非常必要的。目前,在兽医临床上缺乏准确、简便和便宜的犬血型鉴定试剂。由于犬的血型系统复杂[2-10],品种繁多[11-15],又缺乏强大的抗体制备和筛选技术。至今国际上存在的仅有Andrews 等在1992 年研制出了DEA1.1 血型定型单克隆抗体[16]。Hara 等1991 年研制出DEA3血型定型单克隆抗体,由于实验室管理不善消失[17]。现如今,对犬血型可以用多克隆免疫抗体鉴定。但是所制备的多克隆免疫抗体必须用已知血型的试剂红细胞筛查方可应用于临床。由于试剂红细胞常规保存方法较短,而不同血型的红细胞又很难收集并应用到免疫血清和单克隆抗体的筛选中。所以,本研究欲建立一个更为简单和敏感的方法,以作为不使用试剂红细胞检测犬DEA1.1 血型抗体的替代方法。
1 材料
1.1 样品来源 血液样本采自广东及周边地区养殖场饲养的158 只实验用比格犬,使用EDTA 抗凝。
1.2 试剂及仪器设备 DEA1.1 阳性抗原红细胞:经QuickVet/RapidVet Canine DEA1.1 Blood Typing Test 鉴定后红细胞。DEA1.1 多克隆抗血清,购自加利佛尼亚国际动物血液资源库。抗犬IgG 抗体,购自北京奥博森生物技术有限公司;凝聚胺介质试剂盒,购自珠海贝索生物技术有限公司;HRP 酶标抗犬IgG 二抗,购自BD 公司。TMB 储存液:称取20 mgTMB(固体),加10 mL 无水乙醇,在37 ℃振荡,使其充分溶解,-20 ℃保存备用。底物溶液(TMBH2O2):取0.5 mL TMB 储存液于10 mL 底物缓冲液,再加1 μL 30%H2O2,混匀,现配现用。
2 方法
2.1 样本DEA1.1 血型鉴定 采用凝聚胺介质试剂抗球蛋白实验检测血型,将试管标号并分别加入犬抗DEA1.1 多克隆抗体100 μL 和5%DEA1.1 阳性红细胞各1 滴。各加LIM 0.7 mL,混合均匀后,再各加Polybrene 溶液2 滴,并混合均匀。用BASO专用离心机1 000 r/min 离心10 s,倒掉上清液,让管底残留约0.1 mL 液体。轻轻摇动试管,目测红细胞有无凝集,如无凝集,须重新制作。最后加入Resuspending 2 滴,轻轻转动试管混合并同时观察结果。如果凝集散开,表示是由Polybrene 引起的非特异性聚集,DEA1.1 血型抗体筛检结果为阴性;如凝集不散开,则为红细胞抗原抗体结合的特异性反应,DEA1.1 血型抗体筛检结果为阳性。
2.2 红细胞膜的制备 将158 只犬采集的含有DEA1.1 抗原阴性和阳性的血液,按1∶10(v/v)的比例混于153.8 mmol/L NaCl 溶液(含抗凝剂EDTA 40.3 mmol/L)中。参照文献描述的方法分离红细胞膜[18],于-20 ℃下储存直至使用。
2.3 Dot-ELISA 方法的建立 免疫斑点试验是一种实验室常用的简单、重现性高的免疫诊断方法[19]。在本研究中,我们对该方法进行了改进,通过自制的环形固定器将硝酸纤维素膜(NCM)固定到96 孔板的孔底(图1)。使用0.01 mol/L pH 值为7.4 的PBS 稀释红细胞膜,于96 孔板中每个NCM点样2 μL,使斑点直径为2 mm,并在37 ℃下干燥10 min。 用5%w/v 的脱脂奶粉封闭缓冲液,在37 ℃下静置孵育20 min,阻断NCM 上的非特异性结合位点。0.01 mol/L PBS(pH 值为7.4)洗涤4次。使用封闭缓冲液1∶200 稀释抗DEA1.1 多克隆抗体,加入到该板的孔中,并于37 ℃抗孵育30 min。按上述方法洗涤4 次。孔中加入辣根过氧化物酶标记的酶标二抗,然后将该板于37 ℃孵育30 min。按照TMB 试剂盒说明书加入显色液,在37 ℃下避光反应5 ~15 min,停止反应,用蒸馏水冲洗96 孔板。用相机记录试验结果。
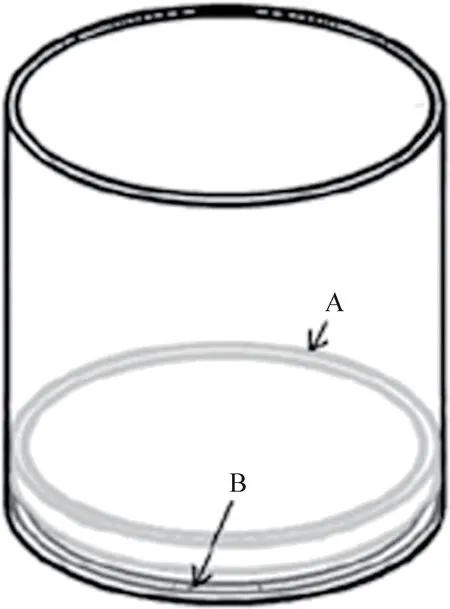
图1 固定硝酸纤维素膜到96 孔板孔中的模式图
2.4 红细胞膜中血红蛋白残留检测 抗原包被浓度与所提取的红细胞膜内残留的血红蛋白含量有关。血红蛋白可以和底物反应显色,抗原包被浓度较大可能会提高血红蛋白残留的含量,增加与血清中抗体进行非特异性结合的几率,进而致使阴性血清出现斑点。所以在摸索过程中需设置不加血清只加底物显色的试验组,排除血红蛋白残留的干扰。结果显示的没有出现斑点或颜色变化的稀释度,是确定抗原包被浓度时所用到的最大浓度。用0.01 mol/L PBS(pH 值7.4)2 倍倍比稀释提取的红细胞膜,每孔NCM 上点样2 μL,置于37 ℃烘箱中干燥10 min。将Dot-ELISA 96 孔板用3%脱脂乳于37 ℃培养箱中封闭30 min。向板内加入0.01 mol/L PBS(pH值7.4)振摇洗涤3 次,每次5 min,弃去液体拍干。向孔中加入一定系适度底物显色溶液,避光振摇显色5 ~10 min。蒸馏水洗涤终止反应。用相机记录结果。
2.5 优化细胞膜抗原浓度 将犬DEA1.1 阳性红细胞膜2 倍倍比稀释,2 μL 等份于NCM 上点样,并在37 ℃下干燥10 min。封闭液1 ∶200 稀释犬抗DEA1.1 多克隆抗血清和阴性血清。按照上述反应程序进行检测,最终优化获得最佳抗原浓度。
2.6 Dot-ELISA 的灵敏度、特异性及稳定性检测 采用相同的抗原浓度,倍比稀释待检血清,用Dot-ELISA 检测,并与抗球蛋白试验结果相比确定其灵敏度。用阴阳性DEA1.1 犬红细胞膜进行点膜,用DEA1.1 阳性血清检测,观察有无交叉反应以确定其特异性。整个体系不变的情况下,将提取的红细胞膜反复冻融20 次进行检测,以及-20 ℃储存11 个月后进行检测,测试间接Dot-ELISA 方法的稳定性。
2.7 临床样本验证间接Dot-ELISA 检测方法 采用间接Dot-ELISA 方法,用犬DEA1.1 血型抗血清对收集的158 条犬的血液样本进行血型鉴定,结果与抗球蛋白试验结果做对比。
3 结果及分析
3.1 血液样本DEA1.1 血型抗体检测 加入Resuspending 后,轻轻摇动试管,可明显发现阳性血液仍保持凝集状态,阴性血液凝集散开。显微镜下观察,发生凝集的血液红细胞呈团块状存在,而未发生凝集的血液红细胞呈单个存在。结果显示,在158 只犬的血液样本中,共计有12 只犬为DEA1.1阳性,146 只犬为阴性。
3.2 犬红细胞膜DEA1.1 血型抗原鉴定及最佳作用浓度 提取的DEA1.1 血型阳性抗原(红细胞膜),用间接Dot-ELISA 鉴定。提取的红细胞膜可以保存犬血型DEA1.1 抗原,并用间接Dot-ELISA试验鉴定,可与DEA1.1 阳性血清反应,与空白血清不反应(图2)。抗原的浓度越大越容易出现非特异性结合,即4 mg/mL 细胞膜处。阴性抗体血清显示无色或没有斑点出现,阳性抗体血清显示颜色最深的浓度为最佳的抗原包被浓度。提取的细胞膜在0.5 ~4 mg/mL 浓度,于硝酸纤维素膜上点样2 μL,不出现非特异性反应。细胞膜浓度在0.5 mg/mL 时能非常明确的鉴定出细胞膜上抗原(图2)。
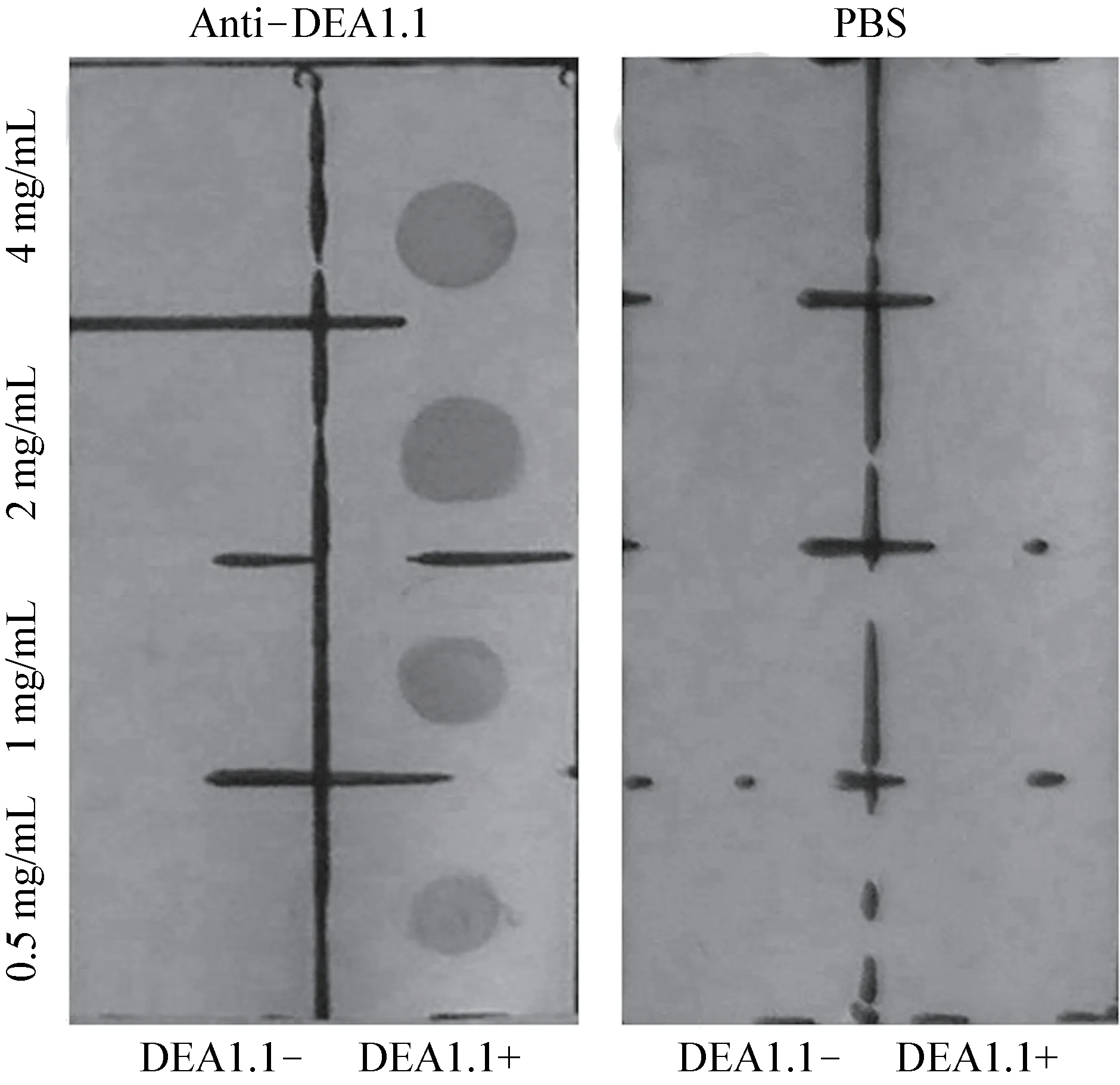
图2 犬红细胞膜DEA1.1 血型抗原鉴定
3.3 犬红细胞膜血红蛋白残留的检测 试验随机挑选9 个样本,由高到低共4 个浓度,点膜直接与TMB 显色底物反应。不同样本由于提取细胞膜的过程中,血红蛋白含量不一样,因此显色的颜色有差别,随膜浓度的增高,显示颜色也在加深,但是与抗体反应后的阳性相比,差别非常明显(图3),说明我们提取的细胞膜血红蛋白含量很低,完全能够达到试验的要求。
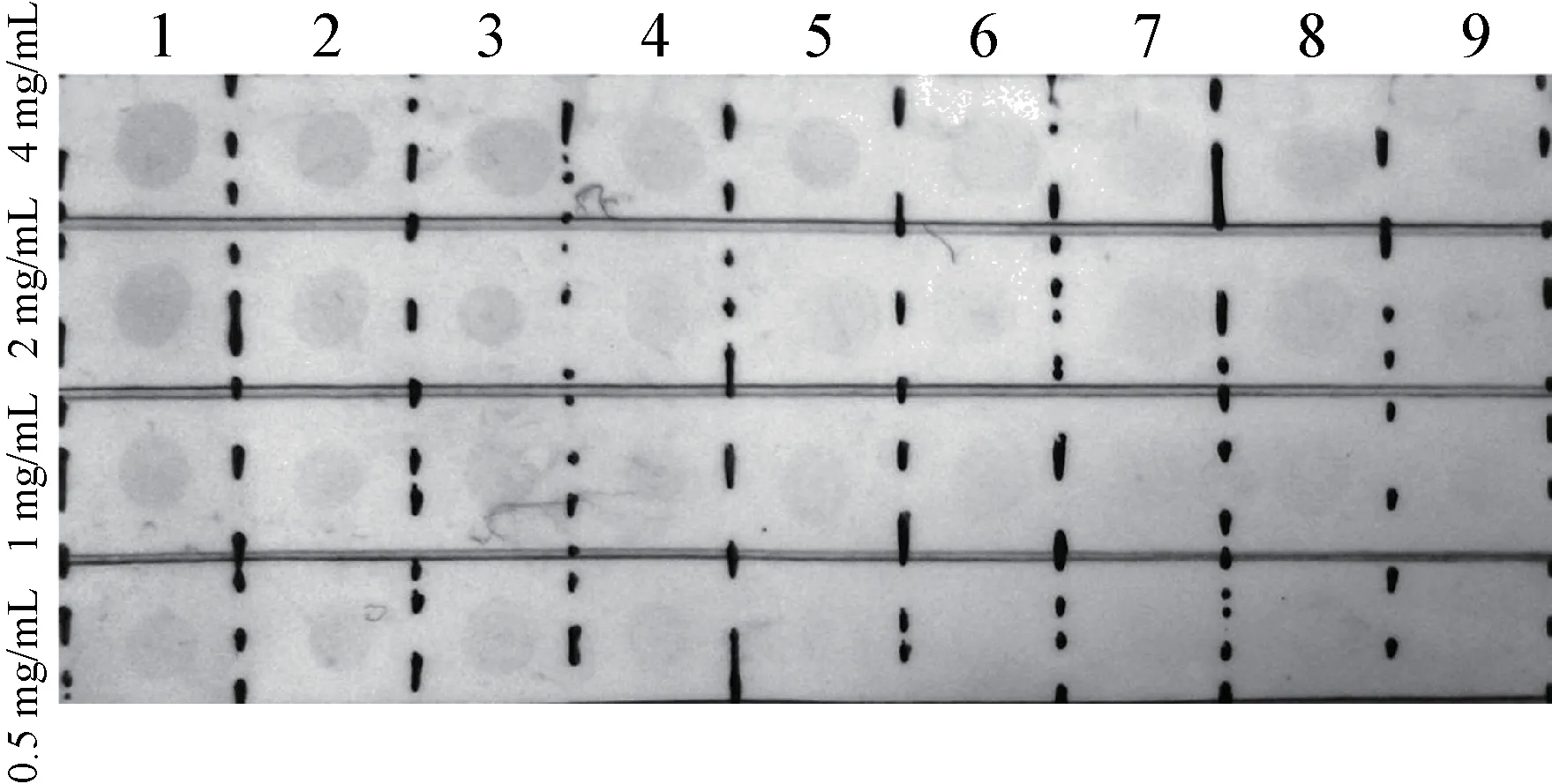
图3 犬红细胞膜血红蛋白残留的检测
3.4 特异性试验 用不同浓度的犬DEA1.1 阳性抗原和阴性抗原分别与阴性、阳性抗体抗血清反应,观察间接Dot-ELISA 方法的特异性。结果显示,具有相应抗原的红细胞膜,与阳性抗体抗血清反应,结果显示深褐色斑点(+++),其他的无斑点(见中插彩版图4),说明间接Dot-ELISA 检测方法具有很高的特异性。
3.5 灵敏度试验 一定浓度的犬DEA1.1 阳性抗原与不同稀释度(倍比稀释)的阳性抗血清反应,并与凝聚介质试验相比,观察间接Dot-ELISA 方法的灵敏性。两种方法相比,间接Dot-ELISA 方法比凝聚胺介质试验灵敏度高8 倍(见中插彩版图5)。说明间接Dot-ELISA 方法具有很高的灵敏度,能检测出弱抗体或浓度较低的抗体。
3.6 稳定性试验 红细胞膜在-20 ℃长时间保存,反复冻融20 次,固定于Dot-ELISA 板4 ℃保存后进行检测,观察Dot-ELISA 方法的稳定性。当红细胞膜在-20 ℃保存11 个月时并不影响检测结果,反复冻融20 次也不影响检测结果。固定在Dot-ELISA 板4 ℃保存后发现2 个月内不影响检测结果(图6)。说明Dot-ELISA 具有很高的稳定性,可长期保存抗原,替换掉试剂红细胞。
3.7 临床样本检测 提取158 只犬红细胞膜用DEA1.1 抗血清进行细胞抗原检测。并与凝聚胺介质试验相比,观察两种方法的符合率。用DEA1.1抗原阳性的细胞膜对158 分犬血清进行DEA1.1 抗体检测。临床样本检测各个对比试验显示,符合率均为100%。说明Dot-ELISA 检测方法可以用于抗体的筛查。

图6 间接Dot-ELISA 方法稳定性检测
4 讨论
Dot-ELISA 的基本原理与常规ELISA 和免疫酶染色法基本相同,即将抗原或抗体首先吸附在纤维素薄膜(如硝酸纤维素膜,NC)表面,并保持其免疫活性,通过与相应的抗体或抗原和酶标记物的一系列免疫反应,形成酶标记抗原抗体复合物,在底物的参与下,结合物上的酶催化底物使其水解、氧化成另一种带色物质,沉着于抗原抗体复合物吸附的部位,呈现出肉眼可见的颜色斑点。试验的结果可通过颜色斑点的出现与否和色泽深度进行判定。
Dot-ELISA 在检测和鉴定抗体方面比常规的血清学技术更加敏感[20],特别是用于检测识别临床意义抗体与传统血清学检测技术有相似或更高的灵敏性,可以用来检测低浓度和弱亲和力的抗体,增加了低浓度和弱亲和抗体的检测准确度。进一步改进了血型检测方法和改善输血安全。用于检测抗体的红细胞膜的抗原性可以在反复冻融和-20 ℃保存11 个月的条件下不受影响,说明此方法非常稳定,并可以长时间保存血型抗原,解决了长期保存和运输血型抗原问题。高稳定性结果可提供更高的可靠性,从而进一步提高实验室的标准化和控制程序。本研究建立的Dot-ELISA 方法,具有较高的准确性,临床样本的检测结果与现有的检测方法符合率较高。在本研究中环形固定器所起到的作用是可以把NCM 膜固定到96 孔板的底部。把整个红细胞膜固定到酶标板上,建立检测抗体的间接ELISA 方法,这样可以用现在已经商业化的ELISA 检测分析仪器进行检测,进而能够达到自动化操作,节省人力,减少人为误差和高通量检测的目的。
总而言之,本研究所建立的Dot-ELISA 方法便捷易操作、准确、稳定性高,可作为输血前检测的有效方法,从而避免传统试剂红细胞的使用。
