禽流感H5、H7 和H9 亚型多重PCR 方法的建立
2019-08-20陈有才戴悦涵胡卫杰
胡 凌,张 鹏,陈有才,张 军,戴悦涵,胡卫杰
(四川省自贡市动物疫病预防控制中心,四川 自贡643000)
禽流感(AI)病是由正粘病毒科A 型流感病毒引起的一种急性人兽共患的传染病,根据其HA 基因的抗原性差异可分为16 个HA 亚型,被世界动物卫生组织(OIE)规定为A 类传染病[1-2]。此外,高致病性禽流感(HPAI)主要是由H5 或H7 两种亚型引起的,潜伏期极短,且常不见任何临床症状而突然死亡的传染病。HPAI的发病率和病死率高达100%,并可感染人导致人的死亡[3,4]。 H9 亚型的禽流感病毒为低致病力的毒株,分布范围十分广泛,使鸡群产生免疫抑制,如果与金黄色葡萄球菌、大肠杆菌等其他的病原体同时感染则对家禽的产蛋率、死亡淘汰率和料肉比等生产性能有严重影响。 且近十几年来,我国的H9 亚型禽流感在呈上升趋势,严重的危害了我国的养禽业发展,威胁着人类的健康,同时还影响着畜产品的国际贸易,给我国带来严重的经济损失[5]。
禽流感H5、H7、H9 是我国当前主要流行的禽流感病毒亚型,其致病性极强,威胁着养禽业的健康发展,所以已在全国范围内引起各界学者的关注。而早期快速确诊是预防和控制禽流感发生的先决条件,尤其是针对H5、H7 和H9 亚型的检测。通过往年研究来看,对AI 的诊断和对AIV 的定型常用的方法仍是病毒的分离和血清学试验。但这些方法操作繁琐复杂,效率低下,很难及时对AI 的防治提供理论支持。聚合酶链式反应(PCR)是敏感性高、特异性强,且已成为分子生物学领域最重要也是最基本的技术手段之一[6],而多重PCR 是一种特殊的PCR 形式,即可以在一个反应中于短时间内同时鉴别出多种病原体[7],该方法缩短了AIV 的检出时间,提高了检测效率,为AIV 的早期快速诊断提供了敏感、快速、实用的方法。本试验根据RT-PCR 的技术原理,采用多重PCR 检测的技术,旨在建立能够在一个反应中同时检测H5、H7 和H9 亚型AIV 的多重RT-PCR 检测方法,以期为AIV的流行病学调查提供技术支撑,为AIV 的防治提供理论基础。
1 材料与方法
1.1 毒株 H5 亚型病毒(re-6 株)为鸡胚毒由哈尔滨兽医研究所提供,H7 亚型病毒、H9 亚型病毒为鸡胚毒由华南农业大学提供,新城疫病毒(NDV)、禽白血病病毒(ALV)、网状内皮增生症病毒(REV)、传染性支气管炎病毒(IBV)、传染性腔上囊病毒(IBDV)均是疫苗株,来源于商业资源。
1.2 主要试剂 RT-PCR 扩增试剂盒和MAKER,购自宝生物工程(大连)有限公司;pUC-18T 载体、TOP10 感受态细胞,购自北京全式金生物技术有限公司;琼脂糖,购自生工生物工程(上海)股份有限公司;DNA/RNA 提取试剂盒为洛阳莱普生信息科技有限公司生产,质粒提取试剂盒、胶回收试剂盒,购自OMEGA 公司,其余试剂均为国产分析纯。
1.3 引物的设计 参照GenBank 中登录的H5、H7、H9 亚型毒株HA 基因序列,使用Megalign 进行序列比对,获得保守性较强的区域,使用DNAStar 和Oligo 6.0 进行引物设计,选取合适的引物(表1)送生工生物工程(上海)股份有限公司进行合成。

表1 扩增目的片段的引物
1.4 核酸的提取 按说明书使用DNA/RNA 提取试剂盒分别提取H5、H7、H9 病毒核酸,获得模板。
1.5 引物验证 RT-PCR 反应在20 μL 的体系中进行,包括2×Taq Buffer 10 μL、上游引物1 μL、下游引物1 μL、酶混合液0.8 μL、ddH2O 4.7 μL、模板2.5 μL。反应程序:50 ℃30 min;94 ℃2 min,94 ℃30 s、55 ℃30 s、72 ℃40 s,35 个循环;最后72 ℃10 min。取5 μL RT-PCR 扩增产物于10 g/L 琼脂糖凝胶中进行电泳鉴定。
1.6 测序 纯化回收后的目的片段与T 载体连接后转化到DH5α 受体菌中。阳性克隆产物扩大培养后送至宝生物工程(大连)有限公司进行序列测定。
1.7 多重RT-PCR 扩增及优化 以这3 种病毒重组质粒的等比例混合物为模板,参照单重RT-PCR扩增的反应条件,以改变某一参数且固定其他参数的方式分别对多重RT-PCR 的退火温度(49.5 ℃~63.8 ℃),各病毒特异性引物浓度(5 μmol/L ~20 μmol/L)和循环数(25 ~40)等进行优化,以确定最佳反应体系及条件,扩增产物于20 g/L 琼脂糖凝胶中进行电泳鉴定。
1.8 敏感性试验 将提取的包含各病毒目的片段的重组质粒用蛋白质核酸仪测定浓度后,计算各病毒拷贝数,用双蒸水做10 倍系列稀释,用已建立的多重RT-PCR 测定其敏感性。
1.9 特异性试验 以H5、H7、H9、NDV、ALV、REV、IBV、IBDV 核酸为模板检测其特异性,同时随机混合各模板进行多重RT-PCR 反应以测其交叉反应性。
1.10 重复性试验 非同日分3 次分别提取H5、H7、H9 样本进行RT-PCR 扩增以验证其重复性。
1.11 多重RT-PCR 对临床样品的检测 对108 份已通过国标(GB/T19438-2004)验证检测的临床样品进行Multiplex RT-PCR 检测,并对两者的检测结果进行比较。
2 结果
2.1 引物验证 以提取的各亚型的病毒核酸为模板,分别用各自特异性引物进行扩增,结果见图1。H5、H7、H9 均扩增出1 条清晰条带,大小分别与预期的199 bp,341 bp 和532 bp 结果相符。
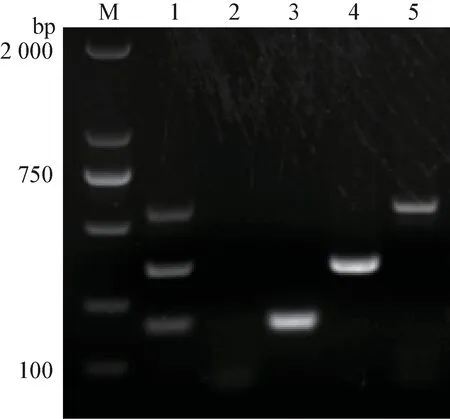
图1 引物验证结果
2.2 RT-PCR 产物的鉴定 测序结果显示,各特异性引物扩增的基因序列与NCBI 上登录的各病毒的基因序列同源性均达98%以上,表明扩增片段分别为各自病毒的特异性条带。
2.3 多重RT-PCR 扩增及优化 通过对反应体系的摸索及条件的筛选,当反应总体积为20 μL,退火温度为55 ℃,病毒特异性引物浓度均为10 μmol/L,35 个循环时,其反应是结果最佳的。
2.4 敏感性试验 该多重RT-PCR 反应的最低检测量为104拷贝/μL(图2)。
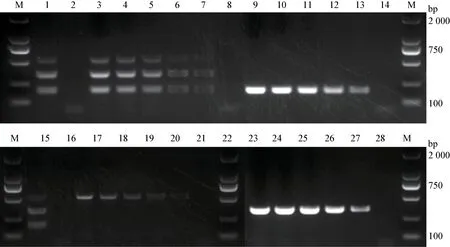
图2 多重RT-PCR 敏感性试验
2.5 特异性试验 在最优反应条件下,以H5、H7、H9、NDV、ALV、REV、IBV、IBDV 核酸为模板验证其特异性,该多重RT-PCR 对阳性对照扩增目的片段,阴性样品未扩增出条带,且引物间无非特异性片段产生(图3);当随机混和带各病毒目的片段的重组质粒时,其产物也能很好的区分开来(图4)。
2.6 重复性试验 非同日分3 次分别提取H5、H7、H9 单模板及多模板样本进行RT-PCR 扩增,均能扩增出有效目的条带,重复性良好(图5)。

图3 多重RT-PCR 特异性

图4 多重RT-PCR 交叉反应性

图5 多重RT-PCR 重复性
2.7 临床样本的检测 通过对108 份临床样品的检测,发现其结果与国标检测结果一致,但本方法可同时检测出3 种病原体,在节约人力、物力的同时能够快速对临床样本作出诊断。见表2。

表2 单重PCR 和多重PCR 对108 份临床样品的检测结果
3 讨论
PCR 诊断技术自从1985 年问世至今经过近几十年的发展,已经成为了医学和现代分子生物学等领域中不可或缺的一种重要的科研手段,并且在疾病的诊断方面发挥了重要的作用[8]。随着飞速发展的生物检测技术,用户需求也基本由特异性和敏感性发展到了对操作性能与检测性能等多层面的考量[9,10]。而多重PCR 诊断技术则是在同一个PCR 反应的体系中加入两对或两对以上的特异性引物,在同一个反应中于短时间内同时扩增出多个目的片段的PCR 反应。其操作原理、操作过程和试剂与一般的PCR 相同,但引物设计相对于单重PCR 而言技术难度更大[11]。影响多重PCR 扩增效果的主要因素为反应体系和反应条件两大类。其中,反应的体系包括缓冲液、引物浓度、dNTP、模板和TaqDNA 聚合酶等;反应条件主要包括循环数和退火温度两方面。因此,在建立多重PCR 的反应体系时,必须对反应条件进行一连串的繁琐的优化[12,13]。本试验通过对反应条件及反应体系的一系列优化,最终成功建立了能在一个反应中同时诊断H5、H7、H9 的RT-PCR 检测方法。结果表明,该方法具有特异性高、敏感性强、快速等优点,且检测的H5、H7、H9 亚型AIV 与其他禽病病原无交叉反应性,在节约人力、物力的同时能对H5、H7、H9 快速诊断的同时,为禽流感的流行病学调查提供了技术支撑,为禽流感的高效防治提供了理论基础,对防止其传播起到重要作用。
