M1和M2型巨噬细胞在ACS中的研究
2019-08-19江政松童金凤陈雪礼刘晓峰
江政松 童金凤 陈雪礼 刘晓峰
【摘要】 目的:探讨M1和M2型巨噬细胞在急性冠状动脉综合征(ACS)中的表达水平。方法:选取本院32例ACS患者为ACS组、30例稳定性心绞痛(SAP)患者为SAP组及32例健康对照者(HC)为HC组,流式细胞技术检测外周血M1、M2细胞,ELISA方法检测M1分泌的细胞因子TNF-α、M2分泌的细胞因子TGF-β1,仪器法检测超敏C反应蛋白(hs-CRP)。结果:ACS组M1型细胞比例、TNF-α、hs-CRP水平均高于HC组、SAP组(P<0.05),且M1细胞与TNF-α呈显著正相关(P<0.000 1);ACS组M2型细胞比例、TGF-β1水平均低于HC组、SAP组(P<0.05),且M2细胞与TGF-β1呈显著正相关(P<0.000 1);SAP组M2型细胞比例、TGF-β1水平均低于HC组,TNF-α水平高于HC组,差异均有统计学意义(P<0.05),SAP组和HC组M1型细胞比例、hs-CRP水平比较,差异均无统计学意义(P>0.05)。结论:在ACS的病程进展中,M1型细胞及其分泌的细胞因子TNF-α具有促炎作用,而M2及其分泌的细胞因子TGF-β1可能具有免疫保护作用。
【关键词】 M1; M2; 巨噬细胞; 急性冠状动脉综合征
【Abstract】 Objective:To investigate the expression of M1 and M2 macrophages in acute coronary syndrome(ACS).Method:32 patients with ACS were selected as ACS group,30 patients with stable angina pectoris(SAP)were selected as SAP group,32 healthy controls(HC)were selected as HC group.Flow cytometry was used to detect M1 and M2 cells in peripheral blood,the cytokines TNF-α and TGF-β1 secreted by M1 and M2 were detected by ELISA,high sensitivity C-reactive protein(hs-CRP)was detected by instrumental method.Result:The percentage of M1 cells,TNF-α and hs-CRP levels in ACS group were higher than those of HC group and SAP group(P<0.05),there was a significant positive correlation between M1 cells and TNF-α(P<0.000 1).The percentage of M2 cells and the level of TGF-β1 in ACS group were lower than those of HC group and SAP group(P<0.05),there was a significant positive correlation between M2 cells and TGF-β1(P<0.000 1).The percentage of M2 cells and the level of TGF-β1 in SAP group were lower than those of HC group,and the level of TNF-α was higher than that of HC group,the differences were statistically significant(P<0.05).The percentage of M1 cells and the level of hs-CRP in SAP group and HC group were compared,the differences were not statistically significant(P>0.05).Conclusion:In the progression of ACS,M1 cells and their secreted cytokine TNF-α have pro-inflammatory effects,while M2 and its secreted cytokine TGF-β1 may have immunoprotective effects.
【Key words】 M1; M2; Macrophages; Acute coronary syndrome
First-authors address:The First Peoples Hospital of Jiujiang,Jiujiang 332000,China
doi:10.3969/j.issn.1674-4985.2019.12.005
急性冠狀动脉综合征(acute coronary syndromes,ACS)是指动脉粥样硬化斑块脱落,血小板聚集,血栓形成,致使冠状动脉狭窄、阻塞、引起心肌缺血以及心肌梗死(acute myocardial infarction,AMI)的病理现象,包括不稳定性心绞痛(unstable angina pectoris,UAP)、非Q波心肌梗死(non-Q wave myocardial infarction,NQMI)、Q波心肌梗死(Q wave myocardial infarction,QMI)乃至ACS终末期临床表现猝死等。据世界卫生组织介绍,尽管全力防止和治疗手段不断改进,包括冠状动脉疾病在内的心血管疾病仍然是造成死亡的首要原因[1]。巨噬细胞分为M1型巨噬细胞和M2型巨噬细胞。目前对于这两类细胞在ACS中的作用还不清楚。笔者通过流式细胞技术检测ACS患者外周血M1、M2细胞,ELISA方法检测M1分泌的细胞因子TNF-α、M2分泌的细胞因子TGF-β1,仪器法检测超敏C反应蛋白(hs-CRP),以明确ACS患者体内炎症因子的变化情况及其之间的相互关系,为下一步早期诊断和干预治疗提供依据。现报道如下。
1 资料与方法
1.1 一般资料 选取2018年5月-2019年1月本院心内科收治的经冠脉造影确诊为ACS患者32例为ACS组(AMI 13例、UAP 19例)、稳定性心绞痛(stable angina pectoris,SAP)30例为SAP组,另选取同期32例健康体检者为HC组(health control,HC)。纳入标准:AMI为休息状态下持续性胸痛30 min以上,心肌酶谱升高2倍以上,并且心电图发生典型ST段抬高或压低改变;UAP为1个月内新发的严重心绞痛,心绞痛程度加重,或休息时发生心绞痛,心电图发生缺血性改变,心肌酶谱升高在2倍以内;SAP为1个月内心绞痛发生频率,持续时间和程度没有改变,心肌酶谱正常。排除标准:感染、全身免疫性疾病、恶性肿瘤、肝肾功能不全者。本研究符合人体试验的伦理学标准,检查者均签署知情同意书。
1.2 方法
1.2.1 试剂及仪器 CD163-PE、CD86-APC、CD68-FITC单抗购自美国eBioscience公司;TNF-α、TGF-β1 ELISA kit试剂盒购自晶美公司;FC500流式细胞仪(美国Beckman公司);贝克曼库尔特IMMAGE800特定蛋白分析仪;ST-360型酶标仪(科华生物)。
1.2.2 标本采集及处理 所有受检者均于冠状动脉造影手术前空腹抽取静脉血3管,1管EDTA抗凝用于流式细胞分析,另2管为普通干管,2干管均分离血清,取其中1管血清分装至无核酶、无蛋白酶的EP管后立即放入-80 ℃冰箱保存备用,另1干管立即上机进行hs-CRP检测。
1.2.3 流式细胞检测M1和M2型巨噬细胞比例 取流式管,加入待检全血50 μL,随后加入抗人CD163-PE、抗人CD86-APC、抗人CD68-FITC各5 μL,充分混匀,室温置暗处20 min。加入BD溶血剂1 mL,轻轻摇匀并置室温暗处10 min。200 g离心5 min,倾去上清,洗涤3次,加2%多聚甲醛400 μL,震荡摇匀。同时用FITC、PE、APC标记的抗人IgG抗体设置同型对照,用贝克曼库尔特FC500流式细胞仪上机检测。采用CD68/SSC设门,确定巨噬细胞群体,进一步进行巨噬细胞亚群分析。数据分析使用WinMDI 2.9软件。
1.2.4 血清TNF-α、TGF-β1浓度检测 将收取到的患者和对照组冰冻血清室温解冻,使用ELISA kit试剂盒测定TNF-α、TGF-β1浓度,所有操作严格参照说明书。
1.2.5 hs-CRP检测 分离普通干管血清,立即使用贝克曼库尔特IMMAGE800特定蛋白分析仪分析患者血清hs-CRP。
1.3 统计学处理 使用SPSS 19.0软件对所得数据进行统计分析,计量资料用(x±s)表示,组间比较采用非参数Kruskal-Wallis秩和检验;计数资料以率(%)表示,比较采用字2检验;相关性利用Pearson分析。以P<0.05为差异有统计学意义。
2 结果
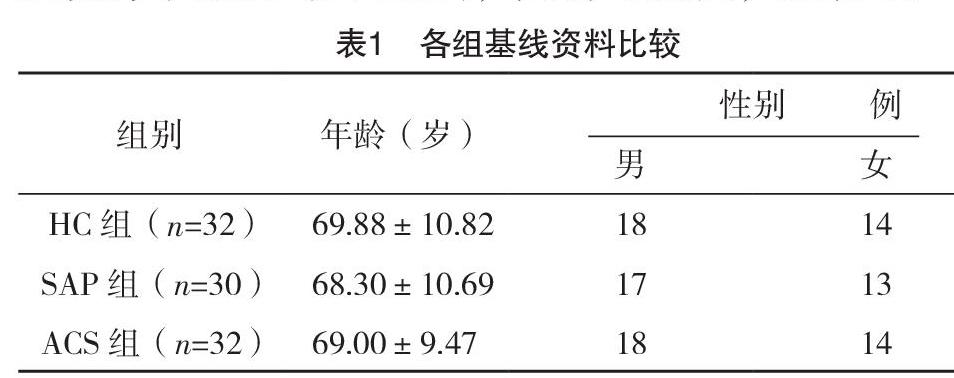
2.1 各组基线资料比较 三组一般资料比较,差异无统计学意义(P>0.05),具有可比性,见表1。
2.2 三组M1、M2型巨噬细胞比例比较 巨噬细胞分析以CD68/SSC设门,进一步分析M1和M2型细胞在CD68+细胞的比例。ACS组M1型细胞比例均高于HC组、SAP组,M2型细胞比例均低于HC组、SAP组,差异均有统计学意义(P<0.05);HC組和SAP组M1型细胞比例比较,差异无统计学意义(P>0.05),但SAP组M2型细胞比例低于HC组(P<0.05),见表2。
2.3 三组血清TNF-α、TGF-β1、hs-CRP比较 ACS组TNF-α、hs-CRP水平均高于HC组、SAP组,TGF-β1水平均低于HC组、SAP组,差异均有统计学意义(P<0.05);SAP组TNF-α水平高于HC组,TGF-β1水平低于HC组,差异均有统计学意义(P<0.05),但HC组和SAP组的hs-CRP水平比较,差异无统计学意义(P>0.05),见表3。
2.4 M1、M2细胞及相应细胞因子TNF-α、TGF-β1的相关性分析 相关性分析发现,M1细胞与TNF-α呈显著正相关(r=0.814 3,P<0.000 1)、M2细胞与TGF-β1呈显著正相关(r=0.930 3,P<0.000 1),见图1。
3 讨论
冠状动脉斑块破裂(或侵蚀)致血栓形成和急性狭窄或闭塞而产生的综合征是冠心病致死致残的主要原因[2]。炎症和免疫影响动脉斑块形成现在已被广泛接受。积累的证据强调不同炎症和免疫细胞如单核细胞和T淋巴细胞在动脉粥样硬化病变的病理生理学中的关键作用[3]。已有研究表明,巨噬细胞亚群与多种疾病,如肿瘤、病毒引起的脑损伤、肥胖和肾病等相关[4-9]。机体通过多个信号通路选择性表达靶基因,使巨噬细胞呈现相应特征性的分子标志物,最终实现不同极性及功能,即促炎的M1型和抗炎的M2型巨噬细胞。本研究结果显示,ACS组M1型细胞比例及TNF-α均高于HC组、SAP组(P<0.05),且M1细胞与TNF-α呈显著正相关(P<0.000 1)。M1型巨噬细胞表面有CD11c、CD86、主要组织相容性复合体-Ⅱ、胶原样结构巨噬细胞受体等特征性受体,具有高表达IL-12和IL-23,低表达IL-10的表型特征,并能产生活性氧、诱导型一氧化氮合酶及炎症因子(如IL-1β、肿瘤坏死因子及IL-6)等。研究发现,TNF-α等炎症因子在冠心病患者体内明显偏高,炎症因子诱导心肌细胞出现损伤,使局部心肌结构和心肌氧化应激出现病理性改变,导致电重构,诱导心律失常的同时参与心肌重建[10-11]。
本研究结果显示,ACS组hs-CRP水平高于HC组、SAP组(P<0.05),CRP是全身炎症反应的敏感指标,由肝细胞合成分泌,在炎症反应的早期就成百上千的升高,可以引起局部坏死心肌的炎症反应[12-13]。这表明M1型细胞在ACS进展中分泌促炎细胞因子,具有促进炎症的作用。
M2型巨噬细胞具有高表达IL-10、低表达IL-12和IL-23的表型特征,并高表达清道夫受体、甘露醇受体、半乳糖受体、精氨酸酶、Dectin-1(CLEC7A)、CD206和CD163等,这类细胞分泌细胞因子CCL17、CCL22、CCL24、TGF-β,TGF-β可以增强成纤维细胞产生细胞外基质成分的能力,刺激血管内皮生成因子促进血管生成[14]。TGF-β1能够使血管细胞黏附分子1、细胞间黏附分子1的表达下调,从而抑制巨噬细胞黏附[15]。本研究结果显示,ACS组M2型细胞比例、TGF-β1水平均低于HC组、SAP组(P<0.05),且M2细胞与TGF-β1呈显著正相关(P<0.000 1)。ACS相较于SAP是更严重的心血管病变。这表明M2巨噬细胞显示免疫调节和抗炎属性。
综上所述,在ACS的病程进展中,M1型细胞及其分泌的细胞因子TNF-α具有促炎作用,而M2及其分泌的细胞因子TGF-β1可能具有免疫保护作用。
参考文献
[1] Mendis S,Puska P,Norrving B.Global Atlas on Cardiovascular Disease Prevention and Control[J].Geneva World Health Organization,2011.
[2]杨跃进,杨进刚,袁晋青,等.高龄老年(≥75岁)急性冠狀动脉综合征患者规范化诊疗中国专家共识[J].中国循环杂志,2018,33(8):732-750.
[3] Cimmino G,Loffredo F S,Morello A,et al.Immune-inflammatory Activation in Acute Coronary Syndromes:A Look into the Heart of Unstable Coronary Plaque[J].Curr Cardiol Rev,2017,13(2):110-117.
[4] Zaki M A,Wada N,Ikeda J,et al.Prognostic implication of types of tumor-associated macrophages in Hodgkin lymphoma[J].Virchows Arch,2011,459(4):361-366.
[5] Soulas C,Conerly C,Kim W K,et al.Recently infiltrating MAC387(+)monocytes/macrophages a third macrophage population involved in SIV and HIV encephalitic lesion formation[J]Am J Pathol,2011,178(5):2121-2135.
[6] Prieur X,Mok C Y,Velagapudi V R,et al.Differential lipid partitioning between adipocytes and tissue macrophages modulates macrophage lipotoxicity and M2/M1 polarization in obese mice[J].Diabetes,2011,60(3):797-809.
[7] Harford K A,Reynolds C M,McGillicuddy F C,et al.Fats,inflammation and insulin resistance:insights to the role of macrophage and T-cell accumulation in adipose tissue[J].Proc Nutr Soc,2011,70(4):408-417.
[8] Zhang L,Sugiyama T,Murabayashi N,et al.The inflammatory changes of adipose tissue in late pregnant mice[J].J Mol Endocrinol,2011,47(2):157-165.
[9] Waddell A,Ahrens R,Steinbrecher K et al.Colonic eosinophilic inflammation in experimental colitis is mediated by Ly6C(high)CCR2(+)inflammatory monocyte/macrophage-derived CCL11[J].J Immunol,2011,186(10):5993-6003.
[10]郑堃,马丽霞,郭秀珍,等.血清CD40L、TNF-α、IL-1β水平与急性冠脉综合征继发室性心律失常的关系[J].山东医药,2015,55(41):45-46.
[11]张源,黎玲伊,陈洁,等.急性冠状动脉综合征患者外周血单个核细胞TLR4和TNF-α的变化及临床意义[J].中国动脉硬化杂志,2017,25(5):480-484.
[12] Pasceri V,Willerson J T,Yeh E T.Direct proinflammatory effect of C-reactive protein on human endothelial cells[J].Circultion,2000,102(18):2165-2168.
[13] Venugopal S K,Devarj S,Yuhanna I,et al.Demonstration that C-reactive protein decreases eNOS expression and bioactivity in human aortic endothelial cells[J].Circultion,2002,106(12):1439-1441.
[14] Gombozhapova A,Rogovskaya Y,Shurupov V,et al.
Macrophage activation and polarization in post-infarction cardiac remodeling[J].J Biomed Sci,2017,24(1):13.
[15] Feinberg M W,Jain M K,Werner F,et al.Transforming growth factor-beta 1 inhibits cytokine-mediated induction of human metalloelastase in macrophage[J].J Biol Chen,2000,275(33):25766-25773.
(收稿日期:2019-01-07) (本文编辑:董悦)
