miR-18a对人正常滋养细胞中MMP-2、MMP-9表达的影响
2019-08-19杨洋陈蕊王稳莹刘成娟
杨洋,陈蕊,王稳莹,刘成娟
子痫前期(pre-eclapmpsia,PE)是产科常见疾病,母胎病死率高,但发病原因尚未明确[1-2]。近期研究表明,滋养细胞浸润能力下降、子宫螺旋动脉重塑异常最终引发致胎盘功能障碍可能是PE的病理基础和主要病因学说[3-4]。妊娠早期,滋养细胞的正常浸润保证了胎盘形成及正常妊娠的成功;滋养细胞分泌的基质金属蛋白酶2(MMP-2)、MMP-9能够降解胞外基质相关组分,帮助其顺利侵入子宫[5]。作为滋养细胞自身直接分泌的细胞功能因子,MMP-2、MMP-9表达异常会影响正常妊娠,并导致多种妊娠相关疾病的发生。
微小RNA(microRNA,miRNA)是一类非编码小分子 RNA,通过与靶 mRNA 的 3′非编码区(3′-UTRs)结合后调控相关基因转录翻译及信号转导[6],影响细胞生理过程。部分miRNA能够影响滋养细胞功能,可能与PE发病相关[7-8]。笔者所在课题组的前期研究发现,PE胎盘组织中病理性低表达的miR-18a能够靶向调控雌激素受体α(ER-α)[9-10],并影响滋养细胞浸润[11],进一步明确了PE相关miR-18a对滋养细胞功能的影响作用,但机制未明。然而有研究发现,通过ER-α介导的雌二醇(E2)能够间接影响滋养细胞表达 MMP-2、MMP-9[12]。另外,miR-18a也能通过对其他靶基因的调控影响MMP表达,影响滋养细胞功能[13]。HTR-8细胞为人绒毛膜滋养层细胞,是目前与体内滋养细胞正常生理功能最为接近,且被相关研究领域认可的正常滋养细胞功能研究的良好模型,笔者所在课题组在前期研究中已应用该细胞系完成了部分miRNA功能研究,证明该细胞系是研究滋养细胞浸润功能的良好模型[9-10]。本研究旨在分析miR-18a是否能够通过对细胞浸润相关因子MMP-2、MMP-9表达的调节影响滋养细胞浸润能力。
1 材料与方法
1.1 细胞株及主要试剂、仪器 HTR-8细胞由空军军医大学唐都医院妇产科惠赠。DMEM-F12培养基、胎牛血清(FBS)购自美国Gibco公司;TRIzol Reagent购自美国Invitrogen公司,反转录试剂盒、实时定量聚合酶链反应(RT-qPCR)试剂盒购自日本TaKaRa公司;miR-18a前体分子(pre-miR-18a),包括 miR-18a类似物(miR-18a mimics)、miR-18a抑制物(miR-18a inhibitor)以及羧基荧光素(FAM)标记 miR-18a空白载体(NC)均购自中国上海吉玛生物公司;Opti-MEM培养基及LipofectamineTM2000转染试剂购自美国Invitrogen公司;PCR引物中国北京奥科公司合成;细胞裂解液、蛋白定量试剂盒购自中国科昊生物公司;FITC-鼠抗人MMP-2、MMP-9单克隆抗体、鼠抗人GAPDH单克隆抗体、HRP标记的山羊抗鼠抗体购自英国Abcam公司;RT-qPCR分析仪购自美国Bio-Rad公司。
1.2 HTR-8细胞转染 将冻存的HTR-8细胞解冻后接种于RPMI-1640完全培养液(含10%FBS),调整细胞数后接种于培养皿中,置于5%CO2、37℃的培养箱中;待细胞生长密度至70%左右时行转染实验。分组:miR-18a过表达组、miR-18a抑制组、阴性对照组(转染实验选取6孔板进行)。消化待转染HTR-8细胞并调整细胞密度,按照LipofectamineTM2000说明书配制转染试剂,配制时避光进行;将转染液逐一加入到对应孔径中,并设置阴性对照,随即将细胞放入培养箱,6 h后第1次换液为RPMI-1640完全培养液(含10%FBS);随即于荧光显微镜下观察转染效率、记录结果。
1.3 RT-qPCR检测转染后HTR-8细胞中 miR-18a、MMP-2、MMP-9 mRNA的表达 转染后48 h使用TRIzol Reagent提取HTR-8细胞总RNA,测定RNA质量后保存待用。根据PrimerBank公布的基因序列设计miR-18a、MMP-2、MMP-9及内参U6、β-actin的引物序列,具体序列,见表1;吸取 1 μL(1 μg/μL) 总 RNA 为模板,反转录合成 miR-18a cDNA;根据TaKaRa RT-qPCR试剂盒说明配制反应体系后加样,以U6为内参,进行PCR,具体反应条件见表1。
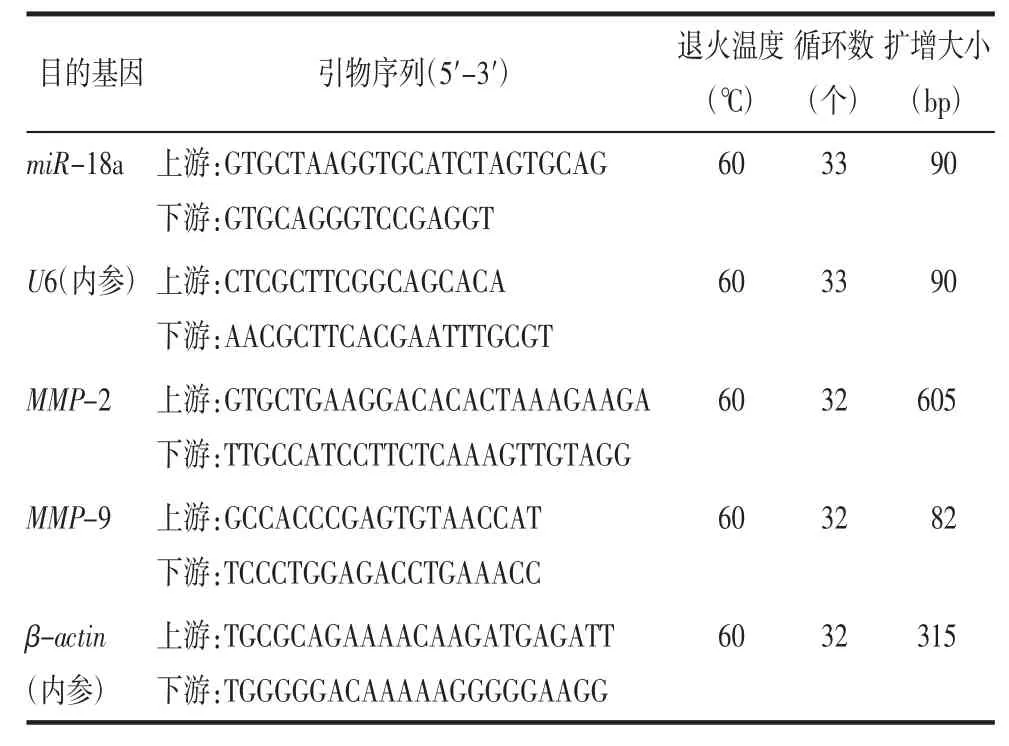
表1 目的基因引物序列及PCR反应条件
检测时每个样本重复5次。以上在每个PCR循环的延伸期采集荧光信号,PCR完成后利用温度梯度变性获得熔解曲线供PCR产物定性分析。根据PCR扩增曲线,得到每个样本的循环周期数(Ct值),使用2-△△Ct法计算各组中目的基因mRNA的相对表达量。
1.4 蛋白质印迹(Western blotting)检测转染后HTR-8细胞中MMP-2、MMP-9的表达 转染后48 h使用细胞裂解液提取HTR-8细胞蛋白,并检测蛋白浓度。取30 μg蛋白进行电泳,半干法转膜至聚偏二氟乙烯膜(PVDF)上,将膜置于含5%脱脂奶粉封闭液中,封闭1 h;加一抗鼠抗人MMP-2、MMP-9 单抗(1∶2 500)、鼠抗人 GADPH 单抗(1∶1 500),室温孵育2 h;弃一抗后加HRP标记的山羊抗鼠抗体(1∶5 000)二抗孵育1 h;化学发光反应后,显影、定影,用BIO-RAD成像系统对X光片扫描成像,记录灰度值并行半定量分析,目的蛋白的相对表达量以MMP-2/GADPH、MMP-9/GADPH比值表示。
1.5 统计学方法 采用SPSS 19.0软件分析,定量资料正态分布的数据用均数±标准差(±s)表示,多组间比较用方差分析,两两比较采用LSD-t检验;两组间比较用两独立样本均数的t检验。P<0.05为差异有统计学意义。
2 结果
2.1 荧光显微镜下观察miR-18a转染效率 HTR-8细胞中过表达与抑制miR-18a后6 h,于荧光显微镜下观察细胞转染效率约为90%,见图1(见后插二)。
2.2 3组HTR-8细胞转染后miR-18a、MMP-2、MMP-9 mRNA表达量的比较 3组HTR-8细胞转染后 miR-18a、MMP-2、MMP-9 mRNA 表达量的比较,差异均有统计学意义(均P<0.001)。miR-18a过表达组miR-18a mRNA表达量比阴性对照组升高,miR-18a抑制组miR-18a mRNA表达量比阴性对照组降低,差异均有统计学意义(均P<0.001)。miR-18a抑制组MMP-2、MMP-9 mRNA表达量比阴性对照组降低,差异均有统计学意义(均P<0.001)。见表2。
表2 3组HTR-8细胞转染后miR-18a、MMP-2、MMP-9 mRNA 表达量的比较(±s)

表2 3组HTR-8细胞转染后miR-18a、MMP-2、MMP-9 mRNA 表达量的比较(±s)
分组 n miR-18a MMP-2 MMP-9 miR-18a过表达组① 5 1.04±0.13 0.94±0.09 1.03±0.09阴性对照组② 5 0.61±0.07 0.92±0.06 1.04±0.12 miR-18a抑制组③ 5 0.35±0.05 0.34±0.07 0.49±0.07 F(P) 73.130(<0.001) 90.640(<0.001) 52.350(<0.001)组间比(P)①∶② <0.001 0.780 0.720③∶② <0.001 <0.001 <0.001①∶③ <0.001 <0.001 <0.001
2.3 抑制miR-18a后MMP-2、MMP-9蛋白表达量的比较 miR-18a抑制组MMP-2、MMP-9蛋白表达量较阴性对照组降低,差异均有统计学意义(均P<0.010),见表 3、图 2。
表3 抑制miR-18a后MMP-2、MMP-9蛋白表达量的比较(±s)

表3 抑制miR-18a后MMP-2、MMP-9蛋白表达量的比较(±s)
组别 n MMP-2 MMP-9阴性对照组 5 1.05±0.10 1.05±0.07 miR-18a抑制组 5 0.78±0.04 0.79±0.06 t 5.626 6.307 P<0.001 <0.001
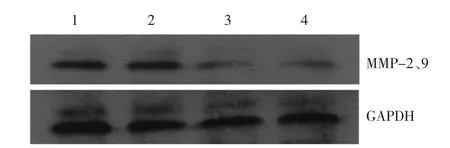
图2 抑制miR-18a后MMP-2、MMP-9蛋白Western blotting图
3 讨论
作为常见的妊娠期疾病,PE在我国发生率较高[14],因其病因不明,且缺乏安全有效的早期诊断预测方法,往往发病时孕妇机体已发生了不可逆转的病理生理变化,导致围生期母婴死亡率较高[15],临床并发症多。近年来,关于PE的病因学研究领域取得了一定进展,滋养细胞浸润能力下降及胎盘功能异常因素引发一系列机体变化[3-4],逐渐成为其主要病因学说。
miRNA通过对其靶基因调控,影响多种人体生理过程,参与包括PE在内的诸多疾病过程。PE患者的miRNA主要通过影响滋养细胞功能涉及胎盘浅着床、子宫螺旋动脉重铸障碍等一系列病理过程[8,16-17]。Zhu等[9]发现了在PE患者胎盘组织中低表达的miR-18a,笔者后续研究中进一步验证了其与PE的相关性[10]。此外,体外细胞功能实验发现抑制miR-18a的表达可明显降低HTR-8的浸润能力,但其机制未明。本研究选择HTR-8细胞作为体外细胞实验模型,并在该细胞系中过表达与抑制miR-18a表达,效果显著,这与笔者前期研究相一致。miR-18a是通过何种途径实现其对滋养细胞浸润功能的影响,以及是否能够直接影响细胞浸润相关因子的表达,从而参与细胞浸润功能调节过程均值得探究。
多种定位于胎盘组织中的蛋白及细胞因子影响滋养细胞浸润功能,可能参与PE发病[18]。MMP-2和MMP-9更是在滋养细胞的浸润调节过程中发挥重要作用,并借此参与维系妊娠[19]。本研究发现抑制miR-18a的表达能同时影响HTR-8细胞中MMP-2、MMP-9在mRNA和蛋白水平的表达,说明miR-18a能够在转录和翻译水平调控MMP-2、MMP-9的表达,从而影响滋养细胞浸润能力。笔者前期研究发现miR-18a与ER-α间具有负性靶向调控关系,ER-α是人体内E2发挥其生理效应的重要介质[10],而胰岛素样生长因子结合蛋白7(insulin-like growth factor binding protein 7,IGFBP7)表达受体内雌激素水平调控,E2在其中发挥关键作用;IGFBP7能进一步抑制滋养细胞中MMP-2、MMP-9的表达,从而影响滋养细胞浸润[12];故推测发生PE时,低表达的miR-18a可能通过该途径间接导致IGFBP7过表达,从而加重滋养细胞浸润障碍,参与疾病过程。
另外,Song等[13]发现miR-18a能在脑胶质瘤细胞中靶向调控再生蛋白(Neogenin),从而影响肿瘤细胞的浸润、凋亡;而Neogenin可直接影响人绒毛外滋养细胞MMP-9的表达,调节滋养细胞浸润[20]。虽然PE相关miRNA能够调控母体环境中部分细胞因子和蛋白,影响滋养细胞功能、胎盘发育和妊娠结局;但一个miRNA可靶向调控若干靶基因,而这些靶基因不一定直接参与细胞功能调控过程。因此,PE时miR-18a也可能通过对不同靶基因的调控作用,直接或间接影响了细胞浸润相关因子MMP-2、MMP-9的表达,进而参与了抑制滋养细胞浸润能力的调控过程。其中涉及的具体机制,笔者后续会深入研究。
本研究初步探讨了PE相关miR-18a影响滋养细胞浸润能力的部分机制,为进一步探索PE病因,以及miRNA在PE预测、临床诊治中应用提供了部分参考。
