色素上皮衍生因子通过抑制PI3K/Akt通路降低宫颈癌HeLa细胞活性和侵袭相关蛋白表达
2019-08-19周洋金志军王丹吴玉仙王成才
周洋,金志军,王丹,吴玉仙,王成才
宫颈癌是恶性程度极高的妇科恶性肿瘤之一, 其发病率和死亡率在恶性妇科肿瘤中仅次于乳腺癌[1]。宫颈癌的恶性生物学特征主要是癌细胞的过度增殖和侵袭,但至今仍未明确其具体的调控机制[2]。磷脂酰肌醇 3 激酶(PI3K)/蛋白激酶 B(Akt)信号通路参与许多肿瘤的重要生物学过程,包括细胞的增殖凋亡、转录翻译、能量代谢和细胞周期调控等[3]。研究表明在人乳头瘤病毒(HPV)阳性的宫颈鳞状细胞癌中,PI3K/Akt信号通路经常被激活,且与肿瘤细胞的增殖和存活有关[4-5]。
色素上皮衍生因子(PEDF)是丝氨酸蛋白酶超家族成员之一的多功能旁分泌糖蛋白,其广泛分布于人体大多数组织和器官[6]。最近有研究表明,PEDF具有较强的抗肿瘤作用,主要是通过抑制肿瘤血管新生从而造成肿瘤细胞凋亡实现的[7]。据报道,在小鼠宫颈癌组织中PEDF表达量下降,且通过外源性注射PEDF的方式可使宫颈癌肿块缩小68%,肿瘤组织微血管密度显著下降[8]。但PEDF的抗肿瘤作用是否与调节PI3K/Akt信号通路有关目前尚不明确。c-Met即肝细胞生长因子受体(hepatocyte growth factor receptor,HGFR)是原癌基因的编码产物。c-Met在多种恶性肿瘤中呈高表达,除了有刺激细胞增殖、血管新生及阻止细胞凋亡等作用外,还可促进肿瘤侵袭和转移,故被认为是肿瘤侵袭相关蛋白[9-10]。而PEDF对肿瘤组织中c-Met蛋白表达的影响目前也有待确认。因此,本研究通过建立PEDF蛋白预处理的宫颈癌HeLa细胞模型,探究PEDF对肿瘤细胞活性和侵袭相关蛋白表达的作用是否与PI3K/Akt通路的调节有关。
1 材料与方法
1.1 病例资料 本研究标本来自于上海长征医院病理科收集的2016年10月—2018年10月手术切除后经病理学诊断确诊的40例宫颈癌组织及其对应的癌旁组织标本,患者年龄 28~75岁,平均年龄(50.5±10.1)岁,其中≤50岁 18例,>50岁22例;肿瘤直径大小≤4 cm者24例,>4 cm者16例;肿瘤浸润≤1/2肌层者10例,>1/2肌层者30例;病理分级Ⅰ级6例,Ⅱ级11例,Ⅲ级23例;淋巴结转移阴性者25例,阳性者15例。
1.2 主要材料和仪器 人宫颈癌HeLa细胞株购自上海中科院细胞典藏馆;人正常宫颈上皮HCerEpiC细胞株购自美国ScienCell公司;胎牛血清(FBS,#10100154)和 DMEM 高糖培养基(#10566024)购自美国Gibco公司;免疫组织化学ABC试剂盒(#AK-5200)和 DAB 显色剂(#SK-4100)购自美国Vector公司;CCK-8细胞活性测定试剂盒(#CK04)购自日本Dojindo公司;重组人PEDF蛋白(#ab86705)购自英国Abcam公司;PI3K 抑制剂 LY294002(#1130)、Akt抑制剂 GSK 690693(#4144)、PI3K 激活剂 740 Y-P(#1983)和 Akt激活剂IGF-1(#291-G1)购自美国R&D公司;PEDF多克隆抗体(#ab180711)、PI3K多克隆抗体(#ab154598)、p-Akt多克隆抗体(#ab38449)、Akt单克隆抗体(#ab179463)、c-Met单克隆抗体(#ab51067)和 β-actin单克隆抗体(#ab8226)购自英国Abcam公司。细胞两气培养箱购自美国Thermo Scientific公司;倒置荧光显微镜和PM-CB20显微照相系统购自日本Olympus公司;Synegy2多功能酶标仪购自美国BioTek公司;Odyssey凝胶扫描仪购自美国Li-cor公司。
1.3 细胞培养及预处理 HeLa细胞和HCerEpiC细胞培养基使用含有10%FBS的DMEM高糖培养基,并放入37℃、5%CO2的常氧培养箱中培养。细胞每2~3 d传代1次,传代时用胰酶使细胞悬浮,并用DMEM培养基洗涤2次,将细胞悬液按1∶3稀释后传代。细胞蛋白提取前,预先2 h在细胞培养基中加入10 nmol/L PEDF蛋白或按推荐浓度加入LY294002、GSK 690693(30 μmol/L)、740 Y-P(50 g/L)或 IGF-1(100 mg/L)。笔者所在研究团队的前期结果发现,HeLa细胞在使用 PEDF 浓度梯度(1、5、10、20和 40 nmol/L)处理后,10 nmol/L的PEDF剂量对HeLa细胞活性和侵袭相关蛋白水平的抑制作用最显著,低于或者高于10 nmol/L的剂量对HeLa细胞的抑制作用均低于10 nmol/L(结果尚未发表),因此在本研究中使用PEDF的浓度为10 nmol/L。
1.4 免疫组织化学ABC法和染色结果判定 取得宫颈癌组织及癌旁组织样本后,立即于10%甲醛溶液中固定过夜,经梯度酒精脱水,浸二甲苯和石蜡,然后进行包埋,切成4 μm的切片,存放于4℃冰箱备染。
1.4.1 免疫组织化学ABC方法 二甲苯脱蜡、梯度酒精水化;3%H2O2室温10 min灭活内源性酶;磷酸盐缓冲液(PBS)清洗后,进行高压加热抗原修复;恢复室温后,PBS清洗切片,用检测抗体所对应的血清封闭30 min,加一抗后4℃过夜;次日依次滴加生物素化二抗及ABC试剂,室温下各孵育30 min,PBS清洗;DAB显色;苏木素复染;盐酸酒精分化后脱水、透明,封片晾干,于倒置荧光显微镜的明场下观察分析。
1.4.2 免疫组织化学染色评分标准 染色强度分为4个等级:无着色计0分,浅黄色计1分,棕黄色计2分,棕褐色计3分;染色面积分为4个等级:阳性细胞占0~5%计0分,6%~25%计1分,26%~50%计2分,50%以上计3分;染色最后得分为染色强度与染色面积的乘积:0~1分为阴性,2~5分为弱阳性,6~8分为中阳性,9分为强阳性。
1.5 细胞活性测定(CCK-8法) 细胞经胰酶消化后,按104/孔的数量将细胞悬液接种到96孔板中,每孔100 μL。培养 24 h后,将 10 μL 的 2-(2-甲氧基-4-硝苯基)-3-(4-硝苯基)-5-(2,4-二磺基苯)-2H-四氮唑单钠盐(WST-8)添加到各孔中,再孵育1 h。通过酶标仪对所有孔的吸光度(OD)值进行测量,从而计算细胞活性。细胞活性=(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%。
1.6 蛋白质印迹(Western blotting)检测 将各组细胞置于冰上,加入4℃的预冷RIPA细胞蛋白裂解液,提取细胞全蛋白,蛋白浓度定量检测采用二喹啉甲酸(BCA)法。蛋白经十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳(电压:浓缩胶200 V,分离胶100 V;时间约90 min)后,进行半干转膜[时间:(蛋白分子量+5)min,电压 40 V]。随后加入 5%的脱脂奶粉-TBST封闭液于室温封闭2 h,再分别加入按1∶1 000比例稀释的 PEDF、PI3K、p-Akt、Akt、c-Met和 β-actin 一抗,4 ℃轻摇过夜;第2天加入相应二抗(1∶100比例稀释),在37℃恒温下摇床避光孵育2 h。最终蛋白的相对表达量用待测蛋白灰度值/β-actin灰度值计算得出。
1.7 统计学方法 采用SPSS 19.0统计软件进行统计分析。定量资料采用均数±标准差(±s)表示,两组间比较采用两样本均数的t检验,3组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验;定性资料采用例数(百分比)表示,组间比较采用卡方检验。所有检验均以P<0.05为差异有统计学意义。
2 结果
2.1 癌旁组织和宫颈癌组织样本中蛋白表达水平及评分 免疫组织化学染色结果显示:癌旁组织样本中的PEDF蛋白多为棕褐色,呈强阳或中阳性(7~9分);PI3K和磷酸化Akt(p-Akt)蛋白多为浅黄色,均为弱阳性(2~3分和2~5分),见图1(见封三)。而在宫颈癌组织切片中PEDF蛋白着色明显变淡,多为棕黄色,呈弱阳性或中阳性(4~7分),这说明在宫颈癌组织中PEDF蛋白的表达降低;而PI3K和p-Akt蛋白均显浓棕褐色,为强阳或中阳性(8~9分),表明宫颈癌组织中的PI3K/Akt信号通路被显著激活。

图2 HCerEpiC、HeLa、HeLa+PEDF细胞中PEDF、PI3K、p-Akt和c-Met的蛋白表达情况
2.2 PEDF抑制HeLa细胞中PI3K/Akt通路并降低细胞活性和侵袭相关蛋白表达 通过Western blotting检测发现,在人正常宫颈上皮HCerEpiC细胞中的PEDF表达较高,而在人宫颈癌HeLa细胞中PEDF水平显著降低(P<0.01),见图 2。此外,HeLa细胞中的PI3K/Akt信号通路较HCerEpiC细胞显著激活(P<0.01)。HeLa细胞中的 c-Met表达较HCerEpiC细胞显著增加(P<0.01)。使用10 nmol/L PEDF处理HeLa细胞后,细胞内的PI3K、p-Akt和c-Met蛋白的表达均显著降低(P<0.01)。而且HeLa细胞的活性经PEDF处理也被显著抑制(P<0.01),见表1。
2.3 PEDF通过PI3K/Akt双重抑制作用降低HeLa细胞的活性和侵袭相关蛋白水平 在HeLa+PEDF组中添加PI3K激活剂740 Y-P并无法使下游的p-Akt表达增加,且c-Met蛋白水平和细胞活性也没有增加。而当使用Akt激活剂IGF-1时,HeLa细胞内的c-Met蛋白水平和细胞活性较Hela+PEDF组均有显著提升(P<0.01)。见图3和表2。
2.4 PEDF的抗肿瘤作用机制并不限于PI3K/Akt通路的抑制 使用PI3K抑制剂LY294002和Akt抑制剂GSK690693来对比PEDF对PI3K/Akt通路的抑制作用,结果表明LY294002和GSK690693对PI3K/Akt通路的抑制程度与PEDF的抑制作用相当。然而,LY294002和GSK690693对HeLa细胞活性和侵袭相关蛋白水平的抑制作用不如PEDF明显(P<0.01)。见图4和表3。
表1 HCerEpiC、HeLa、HeLa+PEDF 细胞中蛋白表达水平及细胞活性比较(±s,n=10)
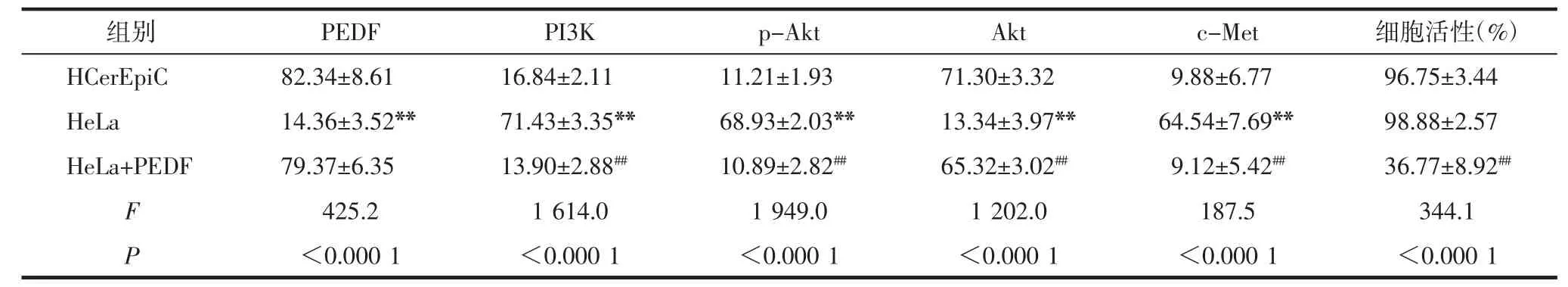
表1 HCerEpiC、HeLa、HeLa+PEDF 细胞中蛋白表达水平及细胞活性比较(±s,n=10)
注:**与 HCerEpiC 细胞组比较,P<0.01,##与 HeLa细胞组比较,P<0.01。
组别 PEDF PI3K p-Akt Akt c-Met 细胞活性(%)HCerEpiC 82.34±8.61 16.84±2.11 11.21±1.93 71.30±3.32 9.88±6.77 96.75±3.44 HeLa 14.36±3.52** 71.43±3.35** 68.93±2.03** 13.34±3.97** 64.54±7.69** 98.88±2.57 HeLa+PEDF 79.37±6.35 13.90±2.88## 10.89±2.82## 65.32±3.02## 9.12±5.42## 36.77±8.92##F 425.2 1 614.0 1 949.0 1 202.0 187.5 344.1 P<0.000 1 <0.000 1 <0.000 1 <0.000 1 <0.000 1 <0.000 1

图3 HeLa细胞经PEDF、PI3K激活剂或Akt激活剂处理后蛋白表达水平变化
表2 HeLa+PEDF、HeLa+PEDF+740Y-P、HeLa+PEDF+IGF-1细胞中蛋白的水平变化及细胞活性变化 (±s,n=10)

表2 HeLa+PEDF、HeLa+PEDF+740Y-P、HeLa+PEDF+IGF-1细胞中蛋白的水平变化及细胞活性变化 (±s,n=10)
注:**与HeLa+PEDF细胞组比较,P<0.01。
组别 PI3K p-Akt Akt c-Met 细胞活性(%)HeLa+PEDF 13.54±2.42 13.24±2.12 73.36±4.32 9.23±3.02 34.73±7.77 HeLa+PEDF+740 Y-P 84.03±3.12** 12.39±2.43 71.28±3.61 9.67±2.71 31.12±6.63 HeLa+PEDF+IGF-1 12.45±3.03 59.45±1.99** 9.60±4.12** 82.12±6.29** 74.28±6.08**F 2 980.0 1 732.0 799.4 1 151.0 171.3 P<0.000 1 <0.000 1 <0.000 1 <0.000 1 <0.000 1

图4 HeLa细胞经PEDF或PI3K/Akt抑制剂处理后蛋白的表达情况
表3 HeLa+PEDF、HeLa+LY294002+GSK690693细胞中蛋白水平及细胞活性的对比(±s,n=10)

表3 HeLa+PEDF、HeLa+LY294002+GSK690693细胞中蛋白水平及细胞活性的对比(±s,n=10)
组别 PI3K p-Akt Akt c-Met 细胞活性(%)HeLa+PEDF 11.28±2.01 14.11±2.61 74.62±5.12 10.03±2.69 31.19±5.28 HeLa+LY294002+GSK690693 10.08±3.38 13.27±3.06 78.96±4.31 28.72±3.10 59.31±8.27 t 0.96 0.66 2.05 14.41 9.06 P 0.348 0 0.517 4 0.055 4 <0.000 1 <0.000 1
3 讨论
在全球女性恶性肿瘤中,宫颈癌的发病率仅次于乳腺癌和结直肠癌,而在发展中国家妇女中其发病率则在恶性肿瘤中排第一位[11]。目前宫颈癌的治疗主要是手术、放疗和(或)放疗,但晚期宫颈癌对化疗不敏感且已失去手术意义。传统的化疗药物在延长宫颈癌患者生存期和提高生活质量方面的效果不佳且不良反应严重[12],所以近年来探索针对宫颈癌信号转导通路的靶向药物已成为研究热点。PI3K作为RAS信号通路的下调因子,是一种常见的受体信号转导相关脂类激酶[13]。PI3K激活后可将膜脂磷脂酰肌醇-4,5-二磷酸盐(Ptd Ins[4,5]P2)转化成磷脂酰肌醇-3,4,5-三磷酸盐(Ptd Ins[3,4,5]P3),Akt和磷酸肌醇依赖性蛋白激酶1(PDK1)又通过直接与Ptd Ins[3,4,5]P3结合而被募集到 PI3K 活性位点[14],且PDK1与Ptd Ins[3,4,5]P3结合促进了Akt的磷酸化[15],导致其下游蛋白的磷酸化,从而发挥一系列下游效应。PI3K/Akt信号通路与宫颈癌的相关研究一直以来都备受关注。有研究发现PI3K/Akt/哺乳动物雷帕霉素靶蛋白(mTOR)信号通路参与人宫颈癌细胞的增殖、分化以及凋亡的调节[16];而PI3K/Akt/核因子κB(NF-κB)信号通路对宫颈癌HeLa细胞的迁移和侵袭起重要作用[17]。
由于宫颈癌细胞中有显著的PI3K/Akt通路激活现象,使PI3K/Akt抑制剂用于治疗宫颈癌成为可能。常见的PI3K抑制剂有wotrmannin、槲皮素、LY294002和吲哚-3-甲醇等,而Akt抑制剂主要有GSK 690693、MK-2206、SC-66和木黄酮。最近有研究发现,PI3K/mTOR双重抑制剂BEZ235可有效地阻断HeLa细胞中PI3K和mTOR的活化,并以时间和浓度相关的方式抑制细胞生长,最终导致细胞停滞在G1期并发生凋亡[18]。PI3K/mTOR的双重抑制剂有较多好处,其在抑制PI3K激酶的同时又能作用于非PI3K依赖的靶点mTOR上,且可以避免产生负反馈环路导致mTOR抑制剂效果不佳[19]。
PEDF具有显著地抑制血管内皮增殖、迁移和促进凋亡作用[20]。近年来,PEDF的抗新生血管生成作用在抗肿瘤方面的研究也逐渐被重视。研究表明,PEDF可导致肿瘤组织内的血管生成减少,从而促进肿瘤细胞凋亡和分化;此外,PEDF可直接针对肿瘤组织的血管抑制而并不影响周围健康组织的血管新生[21]。PEDF可使宫颈癌组织中微血管密度和血管内皮生长因子(VEGF)的表达显著下降,说明PEDF抑制宫颈癌组织生长的作用有一部分是通过下调VEGF 实现的[22]。
本研究发现了PEDF在宫颈癌方面新作用,即双重抑制PI3K/Akt通路从而下调HeLa细胞的活性和侵袭相关蛋白表达。本研究表明PEDF不但能抑制PI3K的活性,且在PEDF存在的情况下加入PI3K激活剂并不能激活下游Akt的活性,这说明PEDF对Akt的活性也有抑制作用。据报道,PEDF在有些组织中可激活PI3K/Akt通路继而发挥下游效应[23]。推测这可能是PEDF的组织特异性导致PEDF在不同组织中对PI3K/Akt产生不同的作用。此外,本研究对PEDF与PI3K/Akt抑制剂进行比较发现,PEDF对HeLa的细胞活性和侵袭相关蛋白表达的影响大于PI3K/Akt抑制剂。这说明PEDF的抗肿瘤效果可能更优于单纯的PI3K/Akt抑制剂,而造成这一现象的可能原因是PEDF的抗新生血管作用,但PEDF是否还有别的抗肿瘤机制仍有待于进一步研究。
综上所述,本研究揭示了PEDF抑制了宫颈癌HeLa细胞中PI3K/Akt通路的激活,进而调节HeLa细胞的活性和侵袭相关蛋白水平。本研究所发现的PI3K/Akt通路抑制现象拓宽了PEDF在抗肿瘤方面的机制和运用,为宫颈癌的防治策略提供了有益的理论依据。
