盐-水相平衡制备硫酸钾综合实验
2019-08-16杨秀山唐思扬
李 季,杨秀山,田 文,唐思扬
(四川大学 化学工程学院,成都 610065)
0 引 言
盐-水体系是指水和钾、钠等盐类构成的多元液固体系。盐-水体系相平衡广泛应用于食盐、化肥、海水淡化、污水处理等领域[1-6],由于盐-水体系构成复杂,热力学理论还无法对该体系的电解质溶液进行可靠的理论推导,目前只能对简单或特定体系进行热力学预测[7],而热力学理论预测结果正确与否,也得通过等温法和多温法等实验验证。基于盐-水体系相平衡数据,指导开发制备相应化工产品的工艺路线和条件,针对性地进行实验,使得研发过程有的放矢,周期更加紧凑,使研发过程更加高效[5,8-9]。
我国的忌氯经济作物种类繁多,规模巨大,硫酸钾年消耗量很大。目前,我国硫酸钾供给主要依赖进口,国内产能严重不足,因此,研发适合我国国情的硫酸钾的生产工艺有很强的现实意义。而我国的芒硝资源极为丰富,因此基于盐-水体系相平衡原理的芒硝法是最适合我国国情的硫酸钾生产方法之一[10-13]。

1 实验部分
1.1 实验仪器及试剂
紫外分光光度计(UV1800PC,北京普析通用仪器有限责任公司),恒温水浴锅(SPT-SY-2-4,南京威美特科学仪器有限公司),分析型超纯水机(ZYCGF-I-40L,四川卓越水处理设备有限公司)。分液漏斗、移液管(1 mL、10 mL)、容量瓶(1 L、100 mL、50 mL棕色)、量筒(10 mL)等玻璃仪器(成都凌云玻璃仪器厂)。
1.2 化学试剂配制
浓盐酸(密度1.19),四苯硼酸钠溶液(约2.5%,约25 mg/mL),取EDTA 10 g及氢氧化钠8 g溶于100 mL蒸馏水中,取四苯硼酸钠溶液40 mL,加蒸馏水稀释至1 L,甲醛溶液(40%),甲基红指示剂(0.1%乙醇溶液)。
1.3 实验原理和流程

(1)
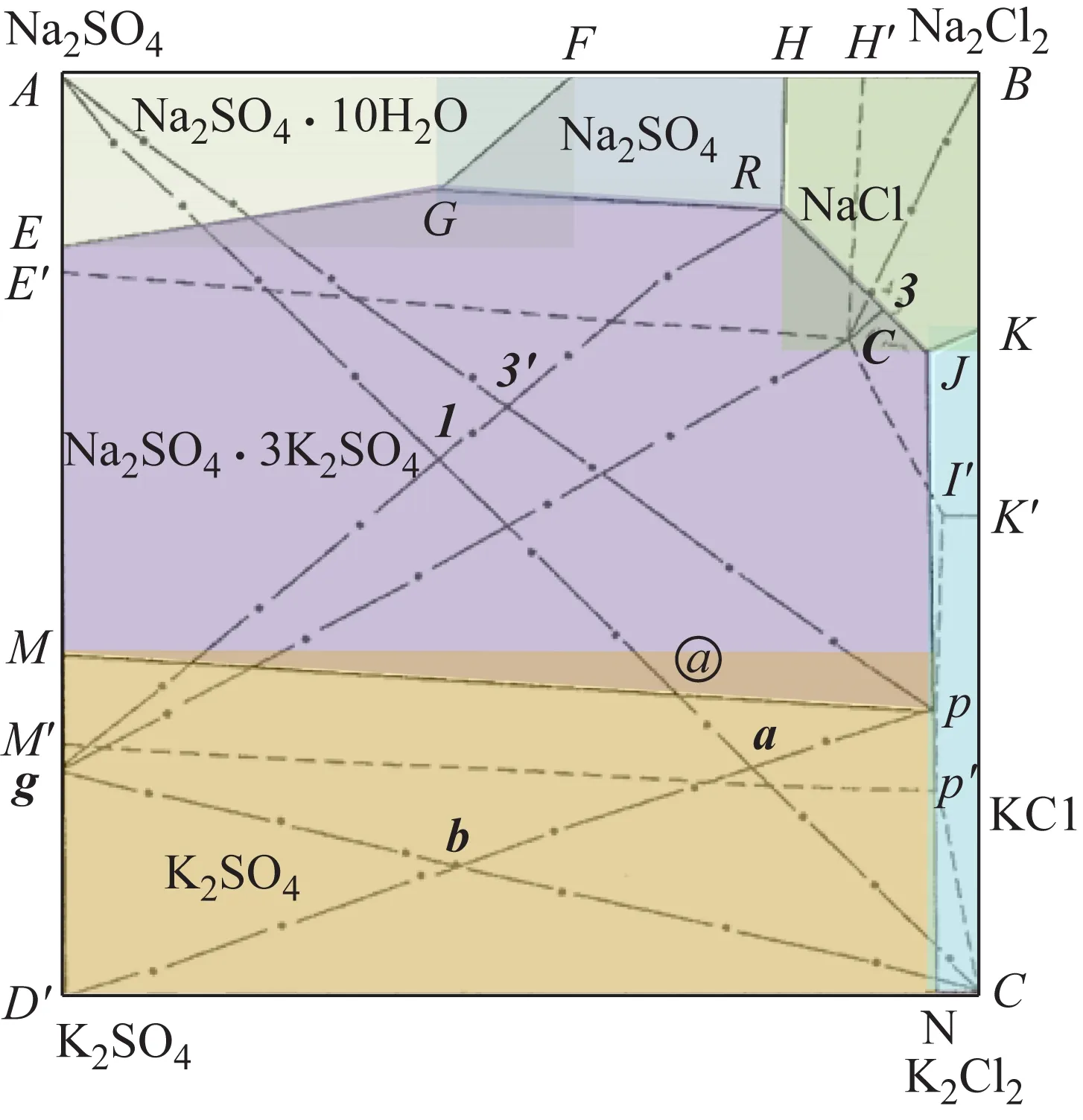
——25 ℃等温溶解度线,----100 ℃等温溶解度线,—·—工艺分析线段
点g与KCl、H2O配制成物系点b,反应式为

(2)
P盐溶液与Na2SO4配制成物系点3,反应式为

(3)
式中,±W为增加或减少的水量。芒硝法工艺过程经过反复结晶操作,钾收率可达80%左右。
如图2所示,硫酸钾制备工艺流程如下:
(1)按25 ℃相图用杠杆原理或用R、P、g的溶解度数据计算物系点1、a、3、b所需各自原料量,干盐总量不超过50 g;
(2)按物系点计算出所需的Na2SO4、KCl、W(H2O)、g(复盐)、P(盐溶液)、R(盐溶液)的量,用台秤称量;
(3)先加少量水于搅拌反应釜中,然后依据不同反应依次加入KCl、g(复盐)、Na2SO4,最后把所余的水全部加入,记温度、时间,反应3~4 h;
(4)反应结束后,用真空泵抽滤盐浆,将分离后固体和液体用台秤称量;

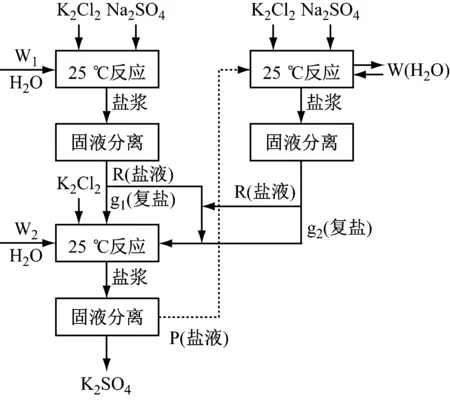
图2 硫酸钾制备实验流程图
1.4 分析检测方法
钾离子、氯离子和硫酸根离子的浓度分别采用四苯硼酸钠重量法[14]、银量法测定[15]、沉淀和紫外分光光度法测定,检测。
2 结果与分析
2.1 样品成分计算
本实验需对P点、R点、产物的液相与固相的钾离子、氯离子、硫酸根离子含量进行测定和计算。钾含量百分率按下式计算:
(4)
式中:G为四苯硼钠质量,g;W为所取试样质量,g。
氧化钾含量百分率按下式计算:
(5)
氯离子含量百分率按下式计算:
(6)
式中:V为滴定时所消耗的AgNO3毫升数;N为AgNO3标准溶液的当量浓度。
采用钡离子沉淀法测定硫酸根浓度。用紫外分光光度计得到吸光度和硫酸钡浓度的线性关系方程,再换算得到固液试样中的硫酸根浓度,其计算式为:
(7)
式中:n为吸光度;K为稀释倍数;V为配制溶液的体积,L;G为样品质量,g;V′为取样体积,mL。
相图P点、R点、1点、b点的样品中钾离子、氯离子、硫酸根离子含量计算结果如表1 所示。
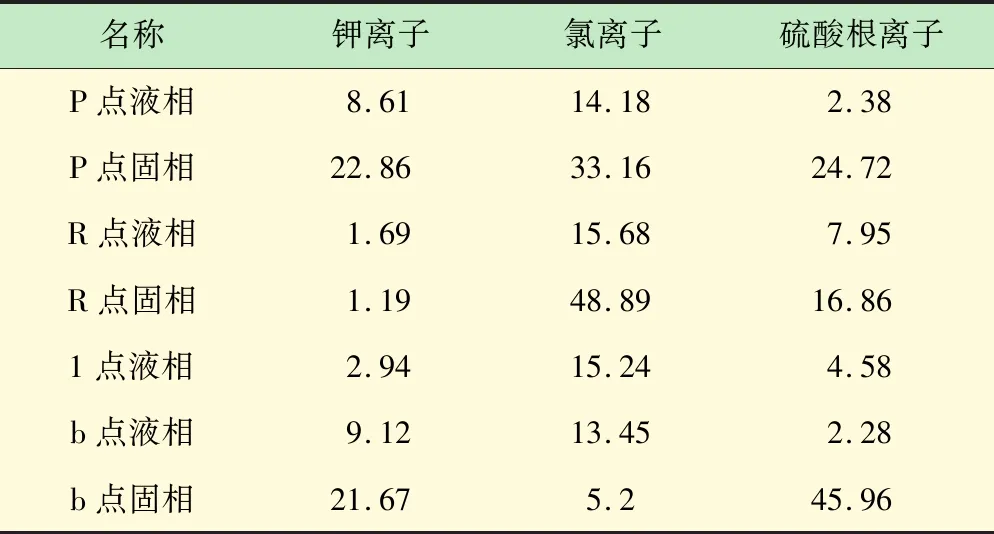
表1 样品离子质量分率计算结果汇总 %
2.2 耶内克指数换算
为了与理论数据进行对比,将质量基准换算成摩尔基准,即换算成耶内克指数。将质量分率按各物质相对原子质量换算成摩尔基准当量。根据阴阳离子电荷守恒计算得到钠离子含量,汇总结果如表2所示。

表2 样品耶内克指数换算结果汇总 %
2.3 钾离子收率计算
硫酸钾的收率是指产品硫酸钾有效成分钾离子的收率。本工艺中存在两次投料,两种原料中氯化钾的质量分别是21.6 g和16.6 g。因而投料中钾离子质量为
wmax(K+)=
(7)
实验得到的固相产物质量为31.9 g,根据表1数据,产品固相钾离子质量为21.67%,从而可以得到芒硝法工艺钾离子的收率:

(8)
本组实验钾离子收率为34.56%。查表3可得氯离子含量为6.13%。

表3 试样离子含量计算结果汇总 %
随机采用10组同学的实验数据分析,得到实测钾离子收率和氯离子残留量含量对比,如图3所示。上述10组学生实验所测定的钾离子收率虽存在一定误差,但除了个别数据异常以外,均在平均值的±20%(在图中以虚线标示)的可控范围内浮动。因此,实验结果表明,基于盐-水相平衡原理,通过上述一系列实验操作及分析测试方法,实现了硫酸钾的制备。
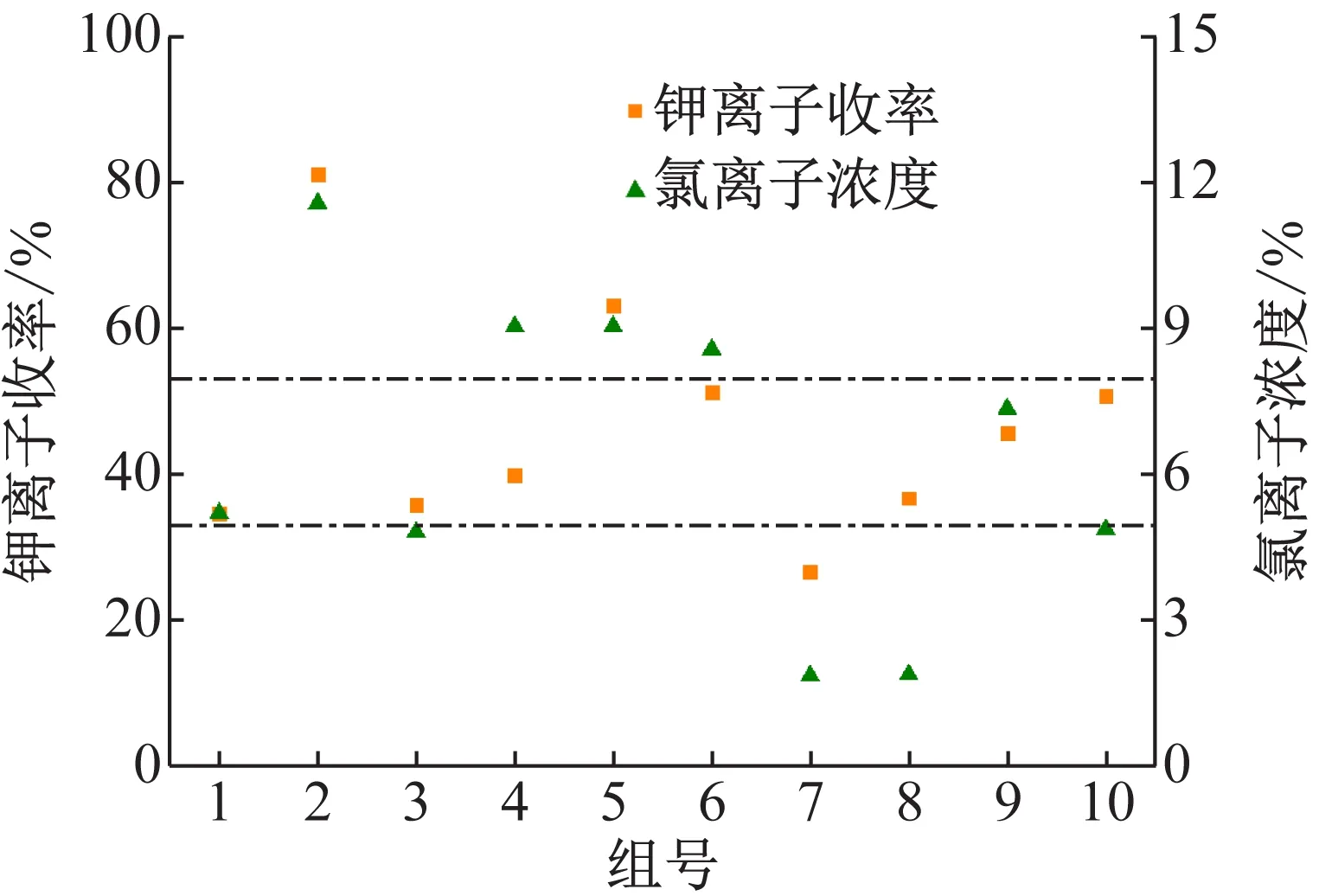
图3 硫酸钾制备实验钾离子收率和氯离子残留量
2.4 教学实践分析
学生掌握了化工热力学、化工原理、反应工程、分离工程等基础理论课程和基本实验技能之后,学生根据自己的兴趣和培养要求,选择实验项目,设计实验流程,编制实验数据记录表,3人一组,分工协作,组队进行实验。获得实验数据后,实验参数各异的多组学生共享实验数据,撰写实验报告,从而对盐-水体系相平衡有更为全面的认识。学生对实验数据进行分析和讨论,指导教师及时给予点评和辅助,在讨论过程中,培养了学生分析判断、逻辑推理、数据归纳与总结的能力,进而实现工程应用能力的培养和提升。互动式的实验教学能够激发学生的兴趣、培养学生自主学习、独立思考的能力,提高学生科学思维和解决问题的能力。利用盐-水相平衡制备硫酸钾综合实验面向四川大学化学工程学院本科生开放多年,已有500多名本科生在该项目上进行了相关的实验操作和研究。这些学生普遍反馈,通过该实验,拓展了知识面,学会了从工程的角度思考问题,提升了对化学工程学科的学习兴趣。
3 结 语
本文基于“立足基础,面向工业”培养要求,将盐-水体系相平衡用于本科生综合实验教学,实现了芒硝法制备硫酸钾。实验过程涵盖多项化学、化工实验操作,以及超级恒温水浴锅、紫外分光光度计等仪器操作,在数据分析和处理过程中需结合化工热力学、仪器分析、数理统计、化工原理和分离工程等多门专业知识对实验数据进行归纳和总结。学生通过此实验,认识了化工产品的开发过程,掌握了化工产品研发的基本方法、锻炼了依据实际需求设计及实施实验的能力,树立了工程应用的意识,实现了综合性实验的教学目的,为工科学生日后的深造和工作打下了良好的基础。
