非肥胖性糖尿病小鼠干眼模型的初步建立
2019-08-15李春华李正日李承霖金海燕汝新宇李英俊
崔 红,李春华,李正日,李承霖,金海燕,任 宁,汝新宇,李英俊
0引言
糖尿病是一种复杂的慢性全身性疾病,是20~74岁人群中最常见的主要致盲原因之一,已成为发展中国家和发达国家日益严重的公共社会问题[1-2]。糖尿病可引起多种眼部并发症,如糖尿病性视网膜病变、糖尿病性角膜病变、代谢性白内障等,其中糖尿病引起的干眼症问题占15%~33%,近几年成为研究热点[3]。干眼症发病机制复杂,选择合适的动物模型是实验研究的关键。非肥胖性糖尿病(non-obese diabetic,NOD)小鼠类似人类1型糖尿病发病特征[4-5],因其可自发糖尿病,常作为自身免疫性糖尿病小鼠模型,用来研究糖尿病相关并发症,如糖尿病肾病等。而国内未见将其作为糖尿病性干眼模型的报道,本研究初步探讨NOD小鼠作为糖尿病性干眼模型的可行性,并就其眼表变化情况进行初步讨论,为以后糖尿病性干眼的研究奠定基础。
1材料和方法
1.1材料选取40只清洁级雌性NOD/LtJ小鼠,均购自美国Jackson实验室。鼠龄12wk,体质量20~25g,无特定病原体,恒温22℃、湿度55%环境下正常进食饲养。该实验严格遵循动物实验中实验动物保护和伦理学要求。
1.2方法
1.2.1 NOD小鼠糖尿病模型的建立鼠龄12wk开始每周检测尿糖2次,发现尿糖强阳性后用血糖仪测血糖,连续2次血糖≥16.7mmol/L诊断为糖尿病。NOD小鼠被诊断为糖尿病作为实验组,同时选用未自发糖尿病的同龄NOD小鼠作为正常对照组。
1.2.2 NOD小鼠糖尿病性干眼模型的建立将实验组NOD小鼠置于40%以下湿度环境,每天皮下注射0.5mg/0.2mL氢溴酸菪胺,并置于可控干燥箱中,每天通风12h,制作蒸发过强型干眼模型。
1.2.3实验分组NOD小鼠随机分为2组:(1)正常对照组:20只未自发糖尿病的NOD小鼠。(2)实验组:干眼1d组:5只糖尿病性干眼模型复制成功后第1d组;干眼7d组:5只糖尿病性干眼模型复制成功后第7d组;干眼10d组:5只糖尿病性干眼模型复制成功后第10d组;干眼14d组:5只糖尿病性干眼模型复制成功后第14d组。
1.2.4泪液分泌测定采用酚红棉线试验测量两组小鼠泪液的分泌量,不同时间点各选用5只小鼠,分别选取右眼进行测定。在裂隙灯下,用眼科显微镊夹酚红棉线,置于小鼠下结膜囊中外1/3,60s后取出,显微镜采用游标卡尺观察棉线湿润长度,读数精确到0.2mm,泪液分泌<5.0mm为低分泌。每组检查后记录数据。
1.2.5结膜印迹细胞学检查不同时间点每组各选取5只小鼠,用颈椎脱臼法处死。用硝酸纤维膜印取每只小鼠的右眼结膜,将其贴于载玻片上并固定,进行过碘酸雪夫(periodic acid-Schiff,PAS)染色,使用透明液(10%乙醇∶冰醋酸=7∶3体积比)对纤维膜进行透明,载片镜检观察结膜上皮细胞和杯状细胞改变情况,计数穹窿结膜杯状细胞数目。镜检、计数由同一专业人员进行,采用单盲法。
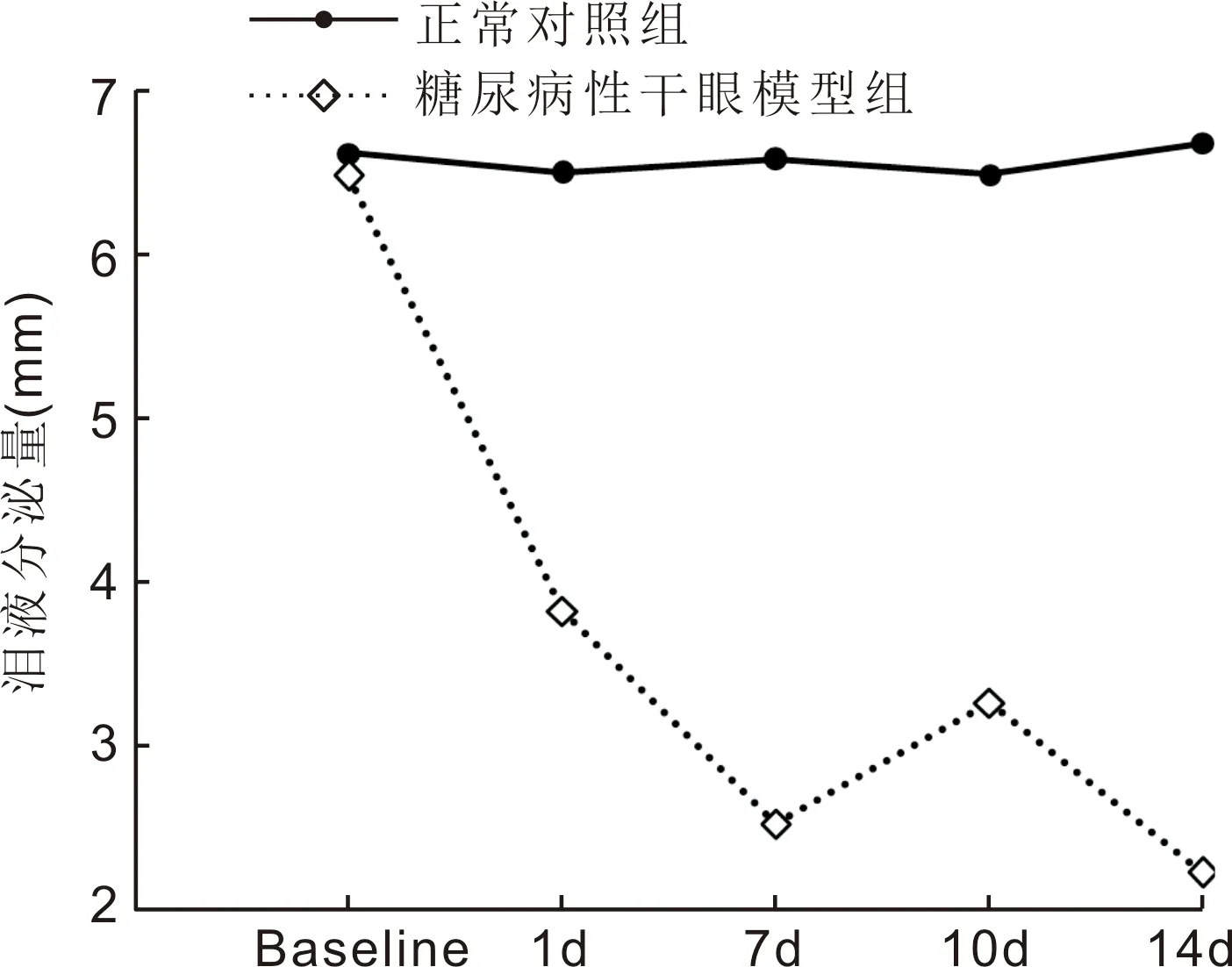
图1小鼠糖尿病性干眼模型组和正常对照组的不同时间点泪液分泌量Baseline:NOD小鼠形成糖尿病干眼模型前的泪液分泌量值。
1.2.6角膜组织病理学检查颈椎脱臼法处死小鼠,每组各选取5只小鼠,取右眼角膜并经中央切开,投入4%多聚甲醛固定。常规石蜡包埋切片,采用苏木精染色检查,观察角膜上皮变化情况。

2结果
2.1各组小鼠泪液分泌结果正常对照组与实验组在第1、7、10、14d时的泪液分泌量情况见表1和图1。对两个实验因素“分组”“时间”以及分组和时间的交互作用进行分析,差异有统计学意义(F组间=9233.79,F时间=626.42,F组间×时间=628.16,均P<0.001)。在造模后的第1、7、10、14d,泪液分泌量较正常对照组均减少,差异均有统计学意义(P<0.001),且从造模后第1d开始,随造模时间延长,实验组的泪液分泌量随时间而逐渐减少,于14d时泪液分泌量达到最低,而正常对照组在不同时间点的泪液分泌量未有明显变化。
2.2各组小鼠结膜印迹细胞学检查结果正常对照组的NOD小鼠结膜细胞小而圆,数量多,连接紧密,杯状细胞核圆,胞质易辨认,上皮细胞与杯状细胞比约1∶1以上。建立糖尿病性干眼模型第1d,结膜细胞变大,细胞间距较正常对照组增大,核浆比减小,杯状细胞数量明显减少,上皮细胞与杯状细胞比约2∶1以上。第7d,杯状细胞数量极少,核质比率=1/5。第10d,结膜细胞鳞状化生化占结膜细胞1/2。第14d结膜细胞呈重度鳞状化生化(图2)。
2.3各组小鼠结膜杯状细胞密度比较对两个实验因素“分组”“时间”以及分组和时间的交互作用进行分析,差异有统计学意义(F组间=408.15,F时间=38.57,F组间×时间=14.62,均P<0.001,表2)。在造模后的第1、7、10、14d,杯状细胞密度较正常对照组均减少,差异均有统计学意义(P<0.001);从造模后第1d开始,随造模时间延长,实验组杯状细胞数量逐渐减少;而正常对照组在不同时间点的杯状细胞数量未有明显变化。
2.4各组小鼠角膜苏木精染色结果正常对照组和糖尿病性干眼模型第10d组角膜病理切片见图3。正常对照组角膜病理切片可见5层角膜上皮细胞,形态清晰、排列紧密。实验组角膜上皮层变薄,部分上皮细胞变性,部分基底细胞水肿。

图2各组小鼠结膜印迹细胞学检查(过碘酸-希夫染色×200)A:正常对照组;B:干眼1d组;C:干眼7d组;D:干眼10d组;E:干眼14d组。

图3各组小鼠角膜病理切片(苏木精染色×200)A:正常对照组;B:干眼10d组。

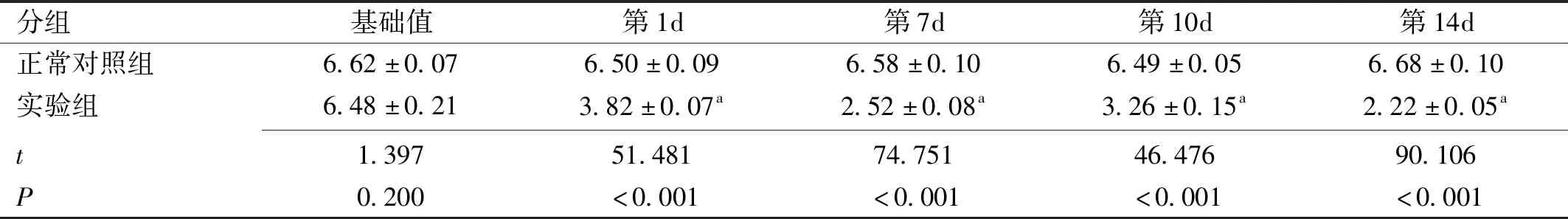
分组基础值第1d第7d第10d第14d正常对照组6.62±0.076.50±0.096.58±0.106.49±0.056.68±0.10实验组6.48±0.213.82±0.07a2.52±0.08a3.26±0.15a2.22±0.05at1.39751.48174.75146.47690.106P0.200<0.001<0.001<0.001<0.001
注:基础值:NOD小鼠形成糖尿病干眼模型前的泪液分泌量值;aP<0.05vs同一时间点对照组。

表2 各组小鼠结膜杯状细胞密度比较 个/cm2)
注:aP<0.05vs同一时间点对照组。
3讨论
糖尿病引起的并发症可累及全身各个系统及器官,其中糖尿病相关性眼病是其中一个主要并发症[6],包括糖尿病性视网膜病变、糖尿病性角膜病变、代谢性白内障等。近年来,糖尿病并发的干眼症问题因其对眼表的损害可造成视力下降而引起广泛关注[7]。动物模型实验是进行糖尿病性干眼研究必不可少的环节,选择合适的动物模型是实验研究的关键。目前,国内1型糖尿病及相关并发症的研究大多采用左脲链霉素(streptozocin,STZ)诱导的糖尿病动物模型,但该模型并没有完全模拟出1型糖尿病发病的免疫机制,且常有自愈倾向,不利于长期观察。而NOD小鼠是一种广泛使用的研究1型糖尿病的动物模型[8],其自发性糖尿病发病率较高,且雌性小鼠更易患病。
干眼症发病机制复杂,主要包括泪膜不稳定、泪液渗透压升高、眼表炎症和损害以及神经感觉异常[9],根据病因不同可分为泪液分泌不足型干眼和蒸发过强型干眼。NOD小鼠因其器官特异性自身免疫的特性可使泪腺发生自身免疫性病变[10],使得NOD小鼠成为研究干眼症的合适模型。然而,NOD小鼠是否适合建立糖尿病性干眼模型,在国内未曾报道。本实验选取雌性NOD/LtJ品系小鼠(均购自美国Jackson实验室),将实验组小鼠置于40%以下湿度环境,每天皮下注射0.5mg/0.2mL氢溴酸菪胺,并置于可控干燥箱中,每天通风12h,制作蒸发过强型干眼模型,这也符合临床干眼症发病的病理生理过程。
本研究中,通过对两组NOD小鼠进行泪液分泌量测定、结膜印迹细胞学形态检查、结膜杯状细胞密度数测定和角膜病理切片染色,比较两组小鼠的眼表情况,以初步探讨NOD小鼠作为糖尿病性干眼模型的可行性。本实验采用酚红棉线测量泪液分泌量,结果显示实验组NOD小鼠的泪液分泌量在不同时间点较正常对照组减少,并且从建立糖尿病性干眼模型的第1~14d,实验组泪液分泌量逐渐减少并达到最低值,由此可知实验组小鼠泪液分泌量随造模时间逐渐减少。有研究表明,泪膜稳定性可受角结膜细胞成分、结膜炎症状态与增生情况所影响[11],并且结膜杯状细胞具有维持眼表稳定性等作用,当结膜杯状细胞密度降低时,引起眼表黏蛋白分泌减少,泪膜稳定性与功能性也就变差[12],是反映眼表健康的重要指标。本实验采用PAS染色方法对两组小鼠结膜杯状细胞进行检查与计数,结果发现正常对照组小鼠结膜细胞小而圆,数量多,连接紧密,杯状细胞核圆,胞质易辨认,实验组结膜杯状细胞数量不断减少、体积变大,结膜细胞不断向鳞状上皮化生。在不同时间点,实验组小鼠结膜杯状细胞数量较正常对照组均减少。我们还发现,从造模第1d开始,实验组杯状细胞密度随着造模时间而逐渐降低,而正常对照组在不同时间点上未有明显变化。可见NOD小鼠建立蒸发过强型干眼模型,可表现为眼表泪液分泌量减少,结膜杯状细胞数目减少,结膜细胞变大且鳞状上皮化,而杯状细胞密度随着造模时间逐渐减低的原因可能与干眼的严重程度有关。
有研究发现[13],干眼症患者角膜上皮厚度是变薄的,同时当泪液分泌不足或者眼表蒸发过强时可导致泪膜厚度降低。本实验采用苏木精染色观察角膜病理组织切片,结果显示实验组小鼠角膜上皮层变薄,部分上皮细胞变性,部分基底细胞水肿,这些发现与临床上干眼症表现是一致的[14]。由此我们可推测,NOD小鼠眼表损害不断加重使其角膜上皮完整性被不断破坏,而临床上角膜上皮点状着色可能与其有关。
综上所述,本实验初步建立了NOD小鼠干眼模型,该模型可操作性强、重复性好,采用泪液分泌量测定、结膜组织PAS染色、角膜上皮苏木精染色等方法显示,其眼表变化与临床上干眼症表现类似。但本研究仍有不足之处,所选取小鼠样本少,且本实验模型仅是初步建立,其可行性与科学性还需有大量实验去验证。
