免疫抑制方案中他克莫司联合缬沙坦对慢性移植肾失功患者肾功能、脂代谢的影响及机制研究Δ
2019-08-15刘琴邹和群
刘琴,邹和群
(南方医科大学第三附属医院肾内科,广州510630)
慢性移植肾失功(Chronic allograft dysfunction,CAD)是指肾移植手术后3个月乃至更长时间发生的移植肾功能进行性减退,临床上主要表现为血肌酐(Scr)进行性升高、24 h蛋白尿进行性加重[1]。CAD其病理生理改变为广泛的移植肾血管内膜增生、肾间质纤维化、肾小球硬化及萎缩,其本质上是一种慢性免疫排斥反应。研究显示,肾移植术后1、3、5年患者生存率分别为94%、84%、76%,而影响患者长期生存率的主要因素就是CAD[2]。目前肾移植术日趋成熟,决定术后患者生存期的主要是免疫抑制方案的选择,肾移植术后免疫抑制方案主要为钙调磷酸酶抑制剂+抗增殖类药物+激素。抗增殖类药物选择中,《肾移植受者免疫抑制治疗指南:2016版》中已经建议麦考酚酯作为抗增殖类药物的一线用药[3];钙调磷酸酶抑制剂他克莫司作为第二代免疫抑制剂的代表药物,其免疫抑制作用比环孢素A强10~100倍,但他克莫司治疗窗窄,剂量过高会引起药物毒性反应,增加肾移植后糖尿病风险,剂量过低则达不到抑制移植排斥反应的效果[4]。CAD的发生发展受到多种因素影响,已经明确的危险因素包括高脂血症、高血压等[5]。肾移植术后约有60%~75%的患者会出现脂代谢异常,高脂血症既是CAD的独立危险因素,又是CAD的主要并发症[6];除了合理应用免疫抑制剂外,改善机体高血脂状态对于延缓CAD发展具有积极意义。另外,缬沙坦作为常用的血管紧张素Ⅱ抑制剂,其在各种肾病引起的蛋白尿、高血压改善方面具有肯定的疗效,且能够有效延缓肾功能损伤[7];但关于缬沙坦对移植肾功能的影响报道较少。本文主要研究钙调磷酸酶抑制剂他克莫司联合缬沙坦治疗CAD患者后,其肾功能、脂代谢以及基质金属蛋白酶2(Matrix metalloproteinase 2,MMP-2)、MMP-9、基质金属蛋白酶组织抑制因子2(Tissue inhibitors of matrix metalloproteinases 2,TIMP-2)和转化生长因子β(TGF-β)水平的影响,以期为临床治疗
CAD提供参考依据。
1 资料来源与方法
1.1 纳入标准与排除标准
1.1.1 纳入标准 ①肾移植至少3~6个月后出现移植肾功能和形态学进行性恶化的患者,其Scr>150 μmol/L、24 h尿蛋白>150 mg/24 h,诊断为CAD;临床上表现为进行性蛋白尿、Scr升高和高血压等;病理学上表现为广泛的血管内膜增生、间质纤维化、肾小球硬化和肾小管萎缩等,最终发展为终末期肾衰;②发生CAD前持续接受环孢素A+麦考酚酯+泼尼松免疫抑制治疗;③患者及家属知情同意并签署同意书。
1.1.2 排除标准 ①因外科手术并发症、难以控制的感染、急性排除反应、慢性环孢素A中毒等引起的CAD;②因原发性或继发性糖尿病引起的移植肾功能异常;③其他不符合纳入本研究的情况。本研究为前瞻性随机对照研究,符合赫尔辛基宣言,并经医院伦理委员会批准。
1.2 纳入患者的基线资料
采用前瞻性研究方法,选取2016年3月-2018年6月南方医科大学第三附属医院(以下简称“我院”)肾内科收治的CAD患者,按照随机数字表法分为A、B、C组,每组34例患者。记录3组患者性别及入选时的年龄、肾移植术后时间、缺血时间、急性排斥反应发生情况、血压等基线资料。
1.3 治疗方法
A组患者给予环孢素A[商品名:赛洛明,广东仙乐制药有限公司,批准文号:国药准字H20058147,规格:50 mg,给药量:6~8 mg/(kg·d),给药方式:口服]+吗替麦考酚酯胶囊(商品名:骁悉,上海罗氏制药有限公司,批准文号:国药准字H20031240,规格:0.25 g,给药量:0.5~1.0 g、2次/d,给药方式:口服)+醋酸泼尼松片(浙江仙琚制药股份有限公司,批准文号:国药准字H33021207,规格:5 mg,给药量:5~10 mg/d,给药方式:口服)。
B组患者给予他克莫司胶囊[商品名:赛福开,杭州中美华东制药股份有限公司,批准文号:国药准字H20-094027,规格:1 mg,初始剂量:0.15~0.25 mg/(kg·d),给药方式:口服,维持血药浓度在5 ng/mL]+吗替麦考酚酯胶囊(给药量:0.5~1.0 g、2次/d,给药方式:口服)+醋酸泼尼松片(给药量:5~10 mg/d,给药方式:口服)。
C组患者在B组给药基础上辅以缬沙坦胶囊[商品名:代文,北京诺华制药有限公司,批准文号:国药准字H20040216,规格:80 mg,给药量:80~160 mg,给药方式:清晨顿服,目标血压控制在130/80 mmHg(1 mmHg=0.133 kPa)以下]。
3组患者均连续治疗3个月后观察治疗效果,整个治疗期间包括肾移植术后均未服用大黄类制剂、他汀类降脂药物及其他降脂药物,严格控制使用肾毒性药物。
1.4 指标检测
1.4.1 取样 所有患者均于研究开始当日、治疗3个月后次日清晨空腹抽取静脉血5 mL,离心后取上层血清,放置在-20℃冰箱中待用;并于相同时间点留取患者尿液。
1.4.2 指标 所有患者检测下列指标:①肾功能指标:采用苦味酸法测定患者24 h尿蛋白水平,酶联免疫吸附试验(ELISA)测定患者Scr、TGF-β水平;②血脂指标:采用罗氏P800全自动生化分析仪测定患者总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)水平;③血清学指标:采用ELISA法检测MMP-9、TIMP-2水平,酶标多克隆抗体夹心法检测MMP-2水平。所有试剂盒均由上海富众生物科技发展有限公司提供。
1.5 统计学方法
采用SPSS 21.0软件进行数据分析,计量资料以±s表示,组间两两比较采用独立样本t检验;3组间比较采用单因素方差分析;计数资料以例/构成比表示,组间比较采用χ2检验;样本量较小的组间比较采用Fisher确切概率法。P<0.05表示差异有统计学意义。
2 结果
3组患者基线资料差异无统计学意义(P>0.05),具有可比性。3组患者基线资料比较结果见表1。
表1 3组患者基线资料比较结果(±s)Tab 1 Comparision of baseline data of patients among 3 groups(±s)
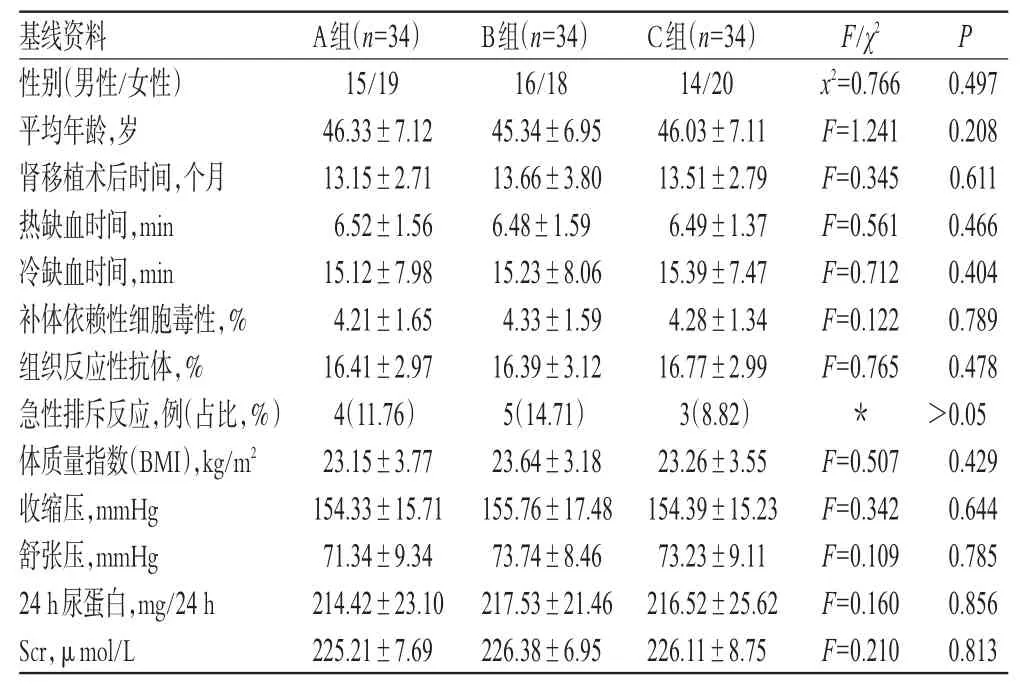
表1 3组患者基线资料比较结果(±s)Tab 1 Comparision of baseline data of patients among 3 groups(±s)
注:*表示采用Fisher确切概率法Note:* means by Fisher extract probability
基线资料性别(男性/女性)平均年龄,岁肾移植术后时间,个月热缺血时间,min冷缺血时间,min补体依赖性细胞毒性,%组织反应性抗体,%急性排斥反应,例(占比,%)体质量指数(BMI),kg/m2收缩压,mmHg舒张压,mmHg 24 h尿蛋白,mg/24 h Scr,μmol/L A组(n=34)15/19 46.33±7.12 13.15±2.71 6.52±1.56 15.12±7.98 4.21±1.65 16.41±2.97 4(11.76)23.15±3.77 154.33±15.71 71.34±9.34 214.42±23.10 225.21±7.69 B组(n=34)16/18 45.34±6.95 13.66±3.80 6.48±1.59 15.23±8.06 4.33±1.59 16.39±3.12 5(14.71)23.64±3.18 155.76±17.48 73.74±8.46 217.53±21.46 226.38±6.95 C组(n=34)14/20 46.03±7.11 13.51±2.79 6.49±1.37 15.39±7.47 4.28±1.34 16.77±2.99 3(8.82)23.26±3.55 154.39±15.23 73.23±9.11 216.52±25.62 226.11±8.75 F/χ2 x2=0.766 F=1.241 F=0.345 F=0.561 F=0.712 F=0.122 F=0.765*F=0.507 F=0.342 F=0.109 F=0.160 F=0.210 P 0.497 0.208 0.611 0.466 0.404 0.789 0.478>0.05 0.429 0.644 0.785 0.856 0.813
2.1 24 h尿蛋白和Scr水平
治疗前,3组患者的24 h尿蛋白、Scr水平差异均无统计学意义(P>0.05)。治疗后,A组患者24 h尿蛋白、Scr水平仍高于正常范围;B组患者24 h尿蛋白仍高于正常范围,Scr水平在正常范围上限附近;C组患者24 h尿蛋白、Scr水平均恢复到正常范围内。B组和C组患者治疗后的24 h尿蛋白、Scr水平明显低于A组(P<0.05);C组患者治疗后的24 h尿蛋白、Scr水平明显低于B组(P<0.05)。3组患者24 h尿蛋白、Scr水平比较结果见表2。
表2 3组患者24 h尿蛋白、Scr水平比较(±s,n=34)Tab 2 Comparison of 24 h urinary protein,Scr levels among 3 groups(±s,n=34)
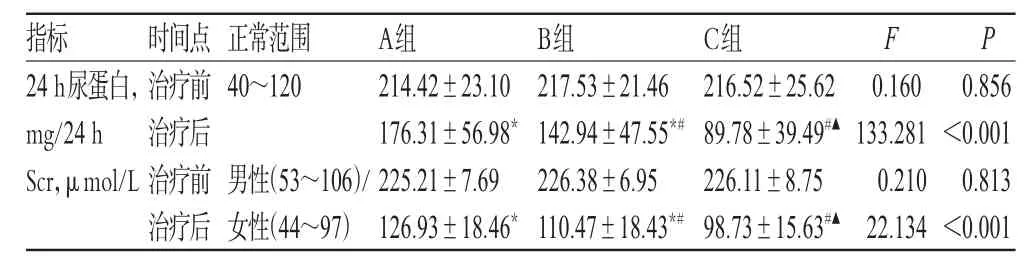
表2 3组患者24 h尿蛋白、Scr水平比较(±s,n=34)Tab 2 Comparison of 24 h urinary protein,Scr levels among 3 groups(±s,n=34)
注:与治疗前比较,*P<0.05;与A组比较,#P<0.05;与B组比较,▲P<0.05Note:vs.before treatment,*P<0.05;vs.group A,#P<0.05;vs.group B,▲P<0.05
0.856<0.001 0.813<0.001指标24 h尿蛋白,mg/24 h Scr,μmol/L时间点治疗前治疗后治疗前治疗后正常范围40~120 F P男性(53~106)/女性(44~97)A组214.42±23.10 176.31±56.98*225.21±7.69 126.93±18.46*B组217.53±21.46 142.94±47.55*#226.38±6.95 110.47±18.43*#C组216.52±25.62 89.78±39.49#▲226.11±8.75 98.73±15.63#▲0.160 133.281 0.210 22.134
2.2 TC、TG、LDL和HDL水平
治疗前,3组患者的TC、TG、LDL和HDL水平差异均无统计学意义(P>0.05)。治疗后,A组和B组患者TC水平均仍高于正常范围,TG、LDL和HDL水平均在正常范围内;C组患者的TC、TG、LDL和HDL水平均在正常范围内。B组和C组患者治疗后的TC、TG、LDL水平明显低于A组(P<0.05),HDL水平明显高于A组(P<0.05);C组患者治疗后的TC、TG、LDL和HDL水平与B组差异无统计学意义(P>0.05)。3组患者TC、TG、LDL和HDL水平比较结果见表3。
表3 3组患者TC、TG、LDL和HDL水平比较(±s,n=34)Tab 3 Comparison of TC,TG,LDL and HDL levels among 3 groups(±s,n=34)
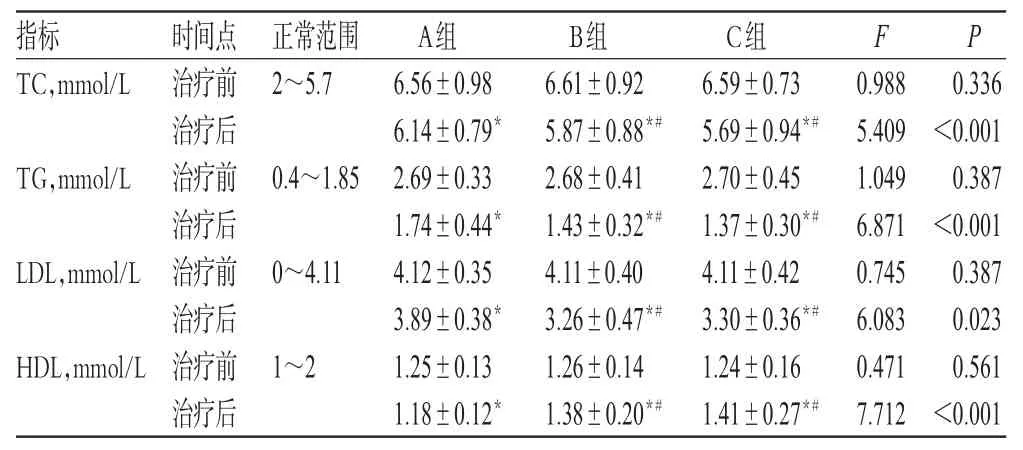
表3 3组患者TC、TG、LDL和HDL水平比较(±s,n=34)Tab 3 Comparison of TC,TG,LDL and HDL levels among 3 groups(±s,n=34)
注:与治疗前比较,*P<0.05;与A组比较,#P<0.05Note:vs.before treatment,*P<0.05;vs.groupA,#P<0.05
指标TC,mmol/L 0.336<0.001 0.387<0.001 0.387 0.023 0.561<0.001时间点治疗前治疗后治疗前治疗后治疗前治疗后治疗前治疗后正常范围2~5.7 F P TG,mmol/L 0.4~1.85 LDL,mmol/L 0~4.11 HDL,mmol/L 1~2 A组6.56±0.98 6.14±0.79*2.69±0.33 1.74±0.44*4.12±0.35 3.89±0.38*1.25±0.13 1.18±0.12*B组6.61±0.92 5.87±0.88*#2.68±0.41 1.43±0.32*#4.11±0.40 3.26±0.47*#1.26±0.14 1.38±0.20*#C组6.59±0.73 5.69±0.94*#2.70±0.45 1.37±0.30*#4.11±0.42 3.30±0.36*#1.24±0.16 1.41±0.27*#0.988 5.409 1.049 6.871 0.745 6.083 0.471 7.712
2.3 MMP-2、MMP-9、TIMP-2和TGF-β水平
治疗前,3 组患者的 MMP-2、MMP-9、TIMP-2、TGF-β水平差异均无统计学意义(P>0.05)。与治疗前比较,A组患者TGF-β水平明显升高(P<0.05),MMP-2、MMP-9、TIMP-2水平差异无统计学意义(P>0.05);B组和C组患者TGF-β水平明显升高(P<0.05),MMP-2、MMP-9、TIMP-2水平明显降低(P<0.05)。B组和C组患者治疗后的MMP-2、MMP-9、TIMP-2、TGF-β水平明显低于A组(P<0.05);C组患者治疗后的MMP-2、MMP-9、TIMP-2水平明显低于B组(P<0.05)。3组患者MMP-2、MMP-9、TIMP-2和TGF-β水平比较结果见表4。
表4 3组患者MMP-2、MMP-9、TIMP-2和TGF-β水平比较(±s,n=34)Tab 4Comparison of MMP-2,MMP-9,TIMP-2 and TGF-β levels among 3 groups(±s,n=34)
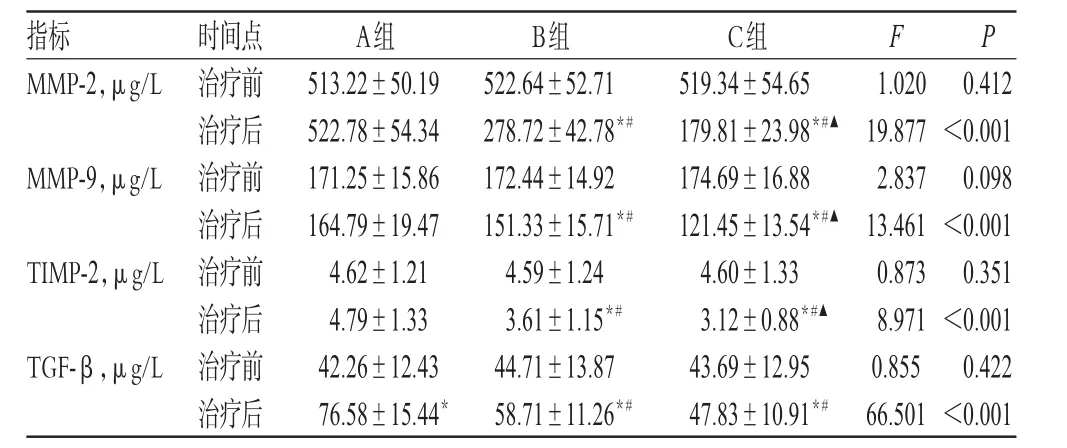
表4 3组患者MMP-2、MMP-9、TIMP-2和TGF-β水平比较(±s,n=34)Tab 4Comparison of MMP-2,MMP-9,TIMP-2 and TGF-β levels among 3 groups(±s,n=34)
注:与治疗前比较,*P<0.05;与A组比较,#P<0.05;与B组比较,▲P<0.05Note:vs.before treatment,*P<0.05;vs.group A,#P<0.05;vs.group B,▲P<0.05
指标MMP-2,μg/L F P MMP-9,μg/L TIMP-2,μg/L TGF-β,μg/L 0.412<0.001 0.098<0.001 0.351<0.001 0.422<0.001时间点治疗前治疗后治疗前治疗后治疗前治疗后治疗前治疗后A组513.22±50.19 522.78±54.34 171.25±15.86 164.79±19.47 4.62±1.21 4.79±1.33 42.26±12.43 76.58±15.44*B组522.64±52.71 278.72±42.78*#172.44±14.92 151.33±15.71*#4.59±1.24 3.61±1.15*#44.71±13.87 58.71±11.26*#C组519.34±54.65 179.81±23.98*#▲174.69±16.88 121.45±13.54*#▲4.60±1.33 3.12±0.88*#▲43.69±12.95 47.83±10.91*#1.020 19.877 2.837 13.461 0.873 8.971 0.855 66.501
3 讨论
近年来,他克莫司作为新型的免疫抑制剂在临床上得到广泛的应用,由于其相对于传统的环孢素A具有免疫抑制效果好、毒性小的特点,逐渐被各大指南推荐为肝肾移植术后的一线免疫用药[8]。他克莫司与环孢素A的作用机制类似,能够抑制T细胞刺激后信号传导过程中出现的早期钙依赖现象,在体内与相应的他克莫司受体和细胞性蛋白质相结合,抑制钙调磷酸酶的活性,抑制Ca2+内流,进而发挥抗宿主反应和迟发型变态反应的效果[9]。美国糖尿病及慢性肾脏病临床实践指南已将他克莫司推荐为治疗特发性膜性肾病、难治性局灶性节段性肾小球硬化、难治性狼疮肾炎和儿童肾病综合征的特效药[10-11]。他克莫司在国内应用尚不广泛,多数医院仍将环孢素A作为肾移植术后免疫抑制方面的经典用药;另外,由于他克莫司治疗窗窄,其药动学、生物利用度、敏感性和特异性在不同个体之间差异较大,在一定程度上限制了其应用范围。
高血压作为肾移植术后蛋白尿产生的重要原因,研究表明,肾移植患者术后基础血压水平每上升10 mmHg,其发生CAD的风险增加30%[12],这就是为什么肾移植术后要将血压严格控制在130/80 mmHg以下的原因。缬沙坦作为血管紧张素Ⅱ抑制剂,对于肾功能损害患者能够在有效控制血压的同时减少蛋白尿的发生。但目前关于缬沙坦在治疗肾移植术后CAD方面的报道较少。
本研究中发现,无论是将环孢素A替换为他克莫司还是他克莫司联合缬沙坦使用,其在延缓肾功能恶化方面均优于环孢素A,进一步证实了他克莫司在中国人中的应用效果,与国内外报道相一致[13-14];且他克莫司联合缬沙坦的效果更佳。CAD是个不可逆的过程,随着时间的推移,与治疗前比较,3组患者的TGF-β水平均明显升高(P<0.05),但由于环孢素A能够促进TGF-β的mRNA表达、蛋白质合成,增加纤维连接蛋白的合成,促进细胞外基质(ECM)合成,加重肾脏纤维化[15],由此A组患者的TGF-β升高最明显;而他克莫司就无此作用,B组和C组患者的TGF-β水平明显低于A组(P<0.05),客观上延缓了CAD的进展。血管紧张素Ⅱ是肾素血管紧张素系统的重要组成部分,其主要功能体现在调节血管张力、血流和促进细胞生长、增殖方面;同时,其还具有诱导单核细胞活化、促进巨噬细胞和血管平滑肌分泌炎症因子;肾移植术后核转录因子κB(NF-κB)相关基因表达上调,使得肾素-血管紧张素系统(RAS)进一步活化,因此RAS系统与肾移植术后CAD的发生发展密切相关[16]。移植肾纤维化是各种原因发展至CAD的共同途径,TGF-β是主要的致纤维化因子之一,动物研究表明[17],缬沙坦能够通过抑制Smad信号转导途径进而抑制TGF-β介导的炎症反应,起到减轻肾脏纤维化的作用。但缬沙坦在人体中的研究较少,但笔者通过本研究推测缬沙坦延缓CAD发生的作用机制可能与抑制TGF-β介导的炎症反应有关。
已经证实,高脂血症是CAD发生发展的独立危险因素,且两者相互作用形成恶性循环。一项将环孢素A替代为他克莫司的研究中显示[18],他克莫司能够明显降低CAD患者体内血脂水平,在本研究中也证实了这一结论。高脂血症致CAD的机制研究较多,移植肾活检中发现肾组织中存在单核巨噬细胞、泡沫细胞、活化的T细胞等多种细胞浸润,且存在主要组织相容性复合体(MHC)-Ⅱ类抗原和血小板衍生生长因子(Platelet derived growth factor,PDGF)β受体过度表达。国外学者研究认为[19],器官移植后体内呈现高炎症状态,氧自由基生成过多,LDL升高而受体特异性摄取减少,形成了氧化型的LDL,这种氧化型的LDL可能在CAD发生发展过程中起着关键作用。但他克莫司能够降血脂的机制尚需要进一步研究。
肾小球细胞作为肾脏的固有细胞,在CAD发生发展过程中,该细胞的增殖、纤维化及ECM积聚发挥着重要作用,其中以ECM最为关键[20]。ECM是存在于细胞之间的网状结构,肾移植术后机体的高炎症状态诱导和刺激ECM的增殖,进而导致了移植肾小球硬化、纤维化等一系列病变。MMPs及TIMP是调控ECM的重要酶系,MMP-2、MMP-9是MMPs酶系的重要组成部分,正常情况下该酶系在肾脏组织中表达较少,当机体呈现高炎症状态时,在各种炎症因子共同作用下,刺激肾组织过度表达MMP-2、MMP-9,刺激内源性抑制剂TIMP-2、TIMP-1的产生,过度表达的TIMP-2、TIMP-1会导致ECM的沉积和胶原纤维的增生,进而加重CAD发展。他克莫司能够选择性地抑制MMP-2、MMP-9的表达及活化,进而抑制TIMP-2产生,最终起着减少ECM合成的作用。缬沙坦能够通过下调NF-κB的表达,下调MMP-9水平,进而抑制TIMP-2产生,最终起着减少ECM合成的作用,作用机制[21]为:(1)血管紧张素Ⅱ抑制剂通过阻断血管紧张素Ⅱ的1型(AT-1)受体介导的丝裂原活化蛋白激酶(MAPK)及Janus激酶/信号转导与转录激活子(The Janus kinase/signal transducer and activator of tran-ions,JAK/STAT)等多种信号通路,抑制 MMP-9的核定位和一些核内转录因子NF-κB、AP-1的蛋白磷酸化,直接调控MMP-9基因表达;(2)血管紧张素Ⅱ抑制剂还能直接阻断炎症中的核心因子NF-kB途径,抑制MMP-9启动子与NF-κB位点的结合,调控其基因表达水平;(3)MMP-9表达及活化受多种细胞因子调节,如TGF-β、肿瘤坏死因子(TNF)、白细胞介素1(IL-1)等。这些细胞因子基因的表达主要受NF-κB调控,血管紧张素Ⅱ抑制剂通过拮抗AT-1受体介导的这一通路,抑制细胞因子基因转录的启动,间接遏制MMP-9的表达及活化。
本研究着重分析了他克莫司联合缬沙坦在治疗CAD中的作用,并对其影响机制进行了血清学层面的研究。基于此,笔者总结出几点需要注意之处以及本研究存在的局限性:首先他克莫司治疗窗窄,在使用过程中一定要加强血药浓度监测,避免出现移植排斥反应和毒性反应;另外,他克莫司与环孢素A一样能够引起诸多不良反应,特别是移植肾性糖尿病、高血压、高钾血症等;再者受到样本量限制和研究时间限制,本研究的结论上需要长期随访观察。
综上所述,他克莫司联合缬沙坦能够有效延缓CAD患者肾功能减退,改善脂代谢,其机制可能与抑制MMP-2、MMP-9、TIMP-2、TGF-β表达有关。
