选择性Janus激酶1抑制药Upadacitinib和Filgotinib治疗类风湿性关节炎疗效和安全性的Meta分析Δ
2019-08-15李世琴李亚玲黄毅岚叶云高珊钟志容王述蓉
李世琴,李亚玲,黄毅岚,叶云,高珊,钟志容,王述蓉#
(1.西南医科大学药学院,四川泸州646000;2.西南医科大学附属医院药学部,四川泸州 646000)
类风湿性关节炎(Rheumatoid arthritis,RA)作为一种慢性全身性自身免疫疾病,以持续性破坏多关节的滑膜炎症为主要病变特征[1]。该病好发于青壮年及少儿,并以女性居多,主要临床表现为晨僵、关节肿痛、软骨破坏、滑膜增生、活动功能损伤等。患者病情若未得到控制,最终可能导致关节破坏、畸形、残疾及器官功能的丧失[2]。临床上对于RA患者的一线治疗方法仍是甲氨喋呤(Methotrexate,MTX)单独使用或与其他诸如糖皮质激素、非甾体抗炎药等可改善患者病情的抗风湿性药物(Disease-modifying antirheumatic drugs,DMARDs)联合使用。但仍有一部分患者对以MTX在内的传统DMARDs药物产生耐受,导致患者病情未得到良好的控制甚至加重。因此,找到合适的补充疗法成为临床亟需解决的问题。近年来,靶向小分子药物逐渐成为研发新药的热门领域。但随着小分子Janus激酶(Janus kinase,JAK)抑制药被用于RA的补充疗法后,诸如感染等相关的不良反应也随之暴露[3]。JAK-1是多种Ⅰ型或Ⅱ型炎症因子受体信号转导的关键酶[4]。Upadacitinib和Filgotinib作为选择性JAK-1抑制药,能选择性地与JAK-1蛋白的氨基酸相互作用,提高对JAK-1的选择性[5]。目前,关于这类选择性JAK-1抑制药对RA患者的治疗效果仍处于大量临床试验研究中,试验结果表明其疗效显著,其中Upadacitinib治疗类风湿关节炎的新药申请已经在2019年2月被美国FDA接受,并且获得了优先审评资格,Filgotinib正在临床试验阶段,但两种药物尚未有较全面的系统评价。因此,本研究采用Meta分析的方法,系统评价两种选择性JAK-1抑制药Upadacitinib(暂译名:乌帕替尼,研究编号:ABT-494)、Filgotinib(暂译名:非戈替尼,研究编号:GLPG0634)治疗RA的疗效和安全性,为其上市及上市后的临床研究提供更多的循证医学证据。
1 资料与方法
1.1 纳入与排除标准
1.1.1 研究类型 国内外已发表的随机对照试验(RCT),语种限定为中文和英文。
1.1.2 研究对象 所有RA患者符合1987年美国风湿病协会(American College of Rheumatology,ACR)修订标准或者2010年ACR标准或者欧洲抗风湿病联盟分类标准。患者种族不限、国籍不限。疗程的持续时间至少达到4周,以确保出现足够的不良事件(AE),且患者药物治疗前期未使用其他JAK抑制药。
1.1.3 干预措施 在联合MTX或其他DMARDs的基础治疗上,试验组患者使用JAK-1抑制药治疗,对照组患者使用安慰剂治疗。
1.1.4 结局指标 ①按ACR标准判断病情缓解20%的患者比例(ACR20);②ACR50;③ACR70;④28个关节疾病活动度评分(28-joint disease activity score,DAS28)<3.2(低疾病活动度)的患者比例;⑤AE发生率;⑥严重不良事件(SAE)发生率;⑦感染发生率;⑧严重感染发生率;⑨带状疱疹发生率;⑩肝损害发生率。其中①~④为疗效指标,剩余为安全性指标。
1.1.5 排除标准 ①未公开发表或已发表仅有摘要的文献;②无法获取全文的文献;③同一试验数据重复发表的文献;④无法提取所需结局指标且联系作者未果的文献;⑤试验为非RCT的文献。
1.2 检索策略
计算机检索PubMed、Medline、Embase、Cochrane图书馆、中国生物医学文献数据库、中国期刊全文数据库、万方数据、中文科技期刊数据库。各数据库的检索时限均限定为从建库起至2019年1月。中文检索词包括:“类风湿性关节炎”“JAK抑制药”“JAK-1抑制药”“ABT-494”“GLPG0634”“非戈替尼”“乌帕替尼”等。英文 检 索 词 包 括 :“ABT-494”“GLPG0634”“Selective JAK-1 Inhibitor”“Selective Janus kinase 1 inhibitor”“Rheumatoid arthritis”“Filgotinib”“Upadacitinib”“Randomized controlled trial”等。检索均采用主题词与自由词搭配的方式。
1.3 资料提取和质量评价
所有文献均由两名研究人员根据纳入与排除标准独立筛选临床研究,提取资料并进行交叉核对。如出现意见分歧无法达成一致,则交由第三方评价人员协助进行再评估。提取内容主要有第一作者及发表年份、例数、年龄、性别、各项干预措施、疗程、各项结局指标等。采用Cochrane协作网推荐的系统评价员手册5.1.0风险偏倚评估工具对所纳研究进行方法学质量评估,评估的内容包括随机分配方法、分配方案隐藏、是否对参与人员采用盲法、结果数据的完整性、意向性分析(ITT)及其他偏倚。
1.4 统计学方法
采用系统评价软件Rev Man 5.3对各项效应指标进行Meta分析。采用比值比(Odds ratio,OR)及其95%置信区间(CI)作为计数资料的效应指标,采用均数差(MD)及其95%CI作为计量资料的效应指标。采用χ2检验对纳入研究进行异质性分析,检验水准为α=0.1,结合I2进行判断,若各项研究无统计学异质性(P>0.1,I2≤50%),则采用固定效应模型;反之,则进一步分析异质性来源,在排除临床异质性的干扰后,则采用随机效应模型。P<0.05表示差异有统计学意义。
2 结果
2.1 纳入研究基本信息及方法学评价结果
初步检索出相关文献352篇,排除不能获取全文的、重复发表的、综述性的、药动学及其他不符合主题的文献后初步得到15篇,阅读全文后排除无可用结局指标的,非RCT的文献后最终纳入7篇文章[6-12],8项RCT合计2 738例患者(Vanhoutte F等[10]的文献中报道了两项RCT,以a,b表示分别进行统计)。所有研究纳入语种均为英文且研究的基线资料基本均衡。8项RCT[6-12]均为随机双盲对照试验,对研究过程中的失访退出情况均有记录。5 项 RCT[6-7,9,11-12]详细记录了随机分配方法。纳入文献研究总体质量评估较高。患者纳入研究的基本信息见表1,偏倚风险评估结果见图1、图2,质量评估结果见表2。

表1 纳入研究基本信息Tab 1 Basic characteristics of the included studies

图1 偏倚风险条图Fig 1 Bar chart of bias risk

图2 偏倚风险总图Fig 2 Total chart of bias risk

表2 纳入研究的质量评价结果Tab 2 Quality evaluation results of the included studies
2.2 Meta分析结果
2.2.1 ACR20 8项 RCT[6-12](2 738例患者)报道了ACR20,各研究间无统计学异质性(P=0.4,I2=3%),采用固定效应模型进行分析。结果显示,试验组患者ACR20显著高于对照组,差异有统计学意义[OR=3.37,95%CI(2.80,4.05),P<0.001]。亚组分析提示,Upadacitinib[OR=3.38,95%CI(2.71,4.22),P<0.001]和Filgotinib[OR=3.34,95%CI(2.40,4.66),P<0.001]的ACR20均高于安慰剂,差异均有统计学意义,详见图3。
2.2.2 ACR50 8项 RCT[6-12](2 738例患者)报道了ACR50,各研究间无统计学异质性(P=0.98,I2=0),采用固定效应模型进行分析。结果显示,试验组患者ACR50显著高于对照组,差异有统计学意义[OR=3.78,95%CI(2.98,4.78),P<0.001]。亚组分析提示,Upadacitinib[OR=3.68,95%CI(2.78,4.86),P<0.001]和Filgotinib[OR=4.03,95%CI(2.58,6.29),P<0.001]的ACR50均高于安慰剂,差异具有统计学意义,详见图4。

图3 ACR20的Meta分析森林图Fig 3 Forest plot of Meta-analysis ofACR20

图4 ACR50的Meta分析森林图Fig 4 Forest plot of Meta-analysis ofACR50
2.2.3 ACR706项RCT[6-9,11-12](2 611例患者)报道了ACR70,各研究间无统计学异质性(P=0.85,I2=0),采用固定效应模型进行分析。结果显示,试验组患者ACR70显著高于对照组,差异有统计学意义[OR=4.31,95%CI(3.05,6.09),P<0.001],详见图5。

图5 ACR70的Meta分析森林图Fig 5 Forest plot of Meta-analysis ofACR70
2.2.4 DAS28<3.2分的患者比例4项RCT[6-9](1 731例患者)报道了DAS28<3.2的患者比例,各研究间无统计学异质性(P=0.19,I2=37%),采用固定效应模型进行分析。结果显示,试验组患者DAS28<3.2的患者比例显著高于对照组,差异有统计学意义[OR=3.86,95%CI(2.98,5.00),P<0.001],详见图6。
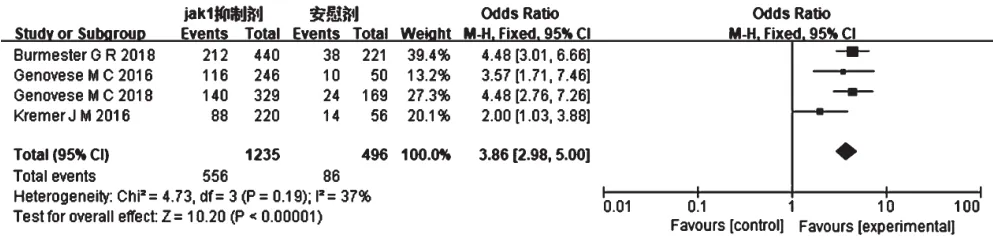
图6 DAS28<3.2分的患者比例的Meta分析森林图Fig 6 Forest plot of Meta-analysis of the proportion of patients with DAS28<3.2
2.2.5 安全性指标的Meta分析结果 各指标各研究间均无统计学异质性,采用固定效应模型合并效应量进行分析。结果显示,试验组患者AE发生率[OR=1.33,95%CI(1.11,1.61),P=0.002]和感染发生率[OR=1.43,95%CI(1.12,1.81),P=0.004]均显著高于对照组,差异均有统计学意义。其他指标差异均无统计学差异(P>0.05),详见表3。
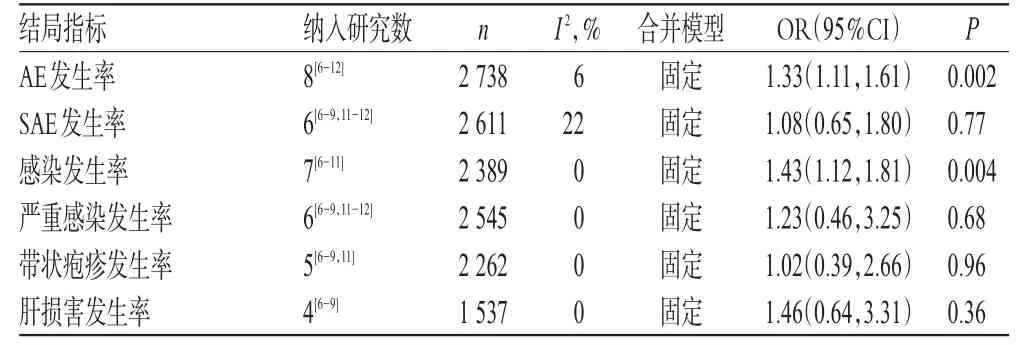
表3 安全性指标的Meta分析结果Tab 3 Meta-analysis results of safety indicators
2.3 敏感性分析
通过改变效应模型对各项指标进行敏感分析,所有结局指标改变模型后Meta分析结果前后比较,未发生翻转。提示敏感性较低,本次Meta分析结果的稳定性较高,详见表4。

表4 敏感性分析的Meta结果Tab 4 Meta-results of sensitivity analysis
2.4 发表偏倚分析
通过漏斗图对ACR20和AE发生率进行偏倚分析,结果显示散点图呈现不对称性,提示存在一定的发表偏倚,详见图7、图8。
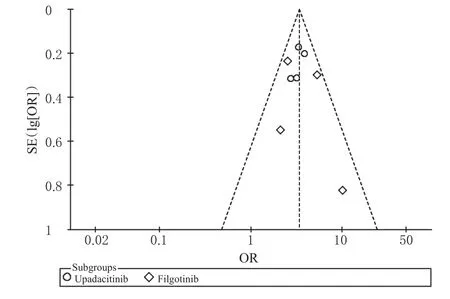
图7 ACR20的倒漏斗图Fig 7 Inverted funnel plot ofACR20
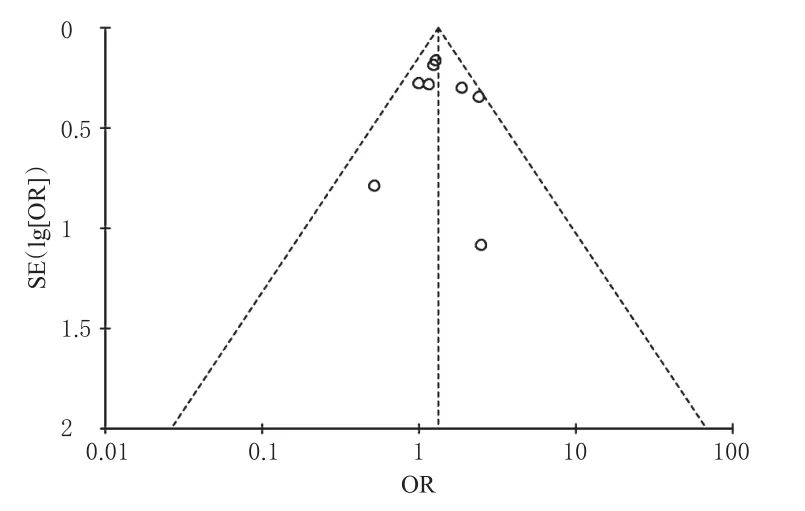
图8 AE发生率的倒漏斗图Fig 8 Inverted funnel plot ofAE
3 讨论
RA作为一种自身免疫性疾病,其具体的发病机制仍旧在探索中,因此临床上至今未有明确的特效药物可根治RA。现临床上常用免疫抑制药、非甾体抗炎药及一些植物药来调节患者的免疫系统,但在治疗过程中常常存在疾病复发、患者耐受能力差等诸多问题[13]。近年研究表明,JAK参与介导多种与RA有关的细胞因子的信号传导,使用JAK抑制药可通过抑制或阻断细胞内的各条信号通路,从而减少细胞因子和各种炎症因子的产生[14],进而改善RA患者关节受损的各种症状,随着诸如托法替尼等JAK抑制药被批准用于MTX等传统DMARDs药物反应不足或无法耐受的RA患者的补充疗法后[14],关于药物在JAK家族通路中的研究也逐渐增多,成为治疗RA的新型药物中的热点[15]。但非选择性JAK抑制药被美国FDA批准用于治疗RA研究后,随着更多关于该类抑制药的研究展开,其存在的一些弊端也逐渐在临床研究中显露出来。如托法替尼会造成其血液毒副作用以及感染、肝损害等不良作用的增加[16],故新型的选择性JAK抑制药成为治疗RA研发药物新的目标。
本文对两种选择性JAK-1抑制药Upadacitinib和Filgotinib的疗效和安全性进行了Meta分析,结果显示两种药物在疗效方面的各项指标诸如ACR20、ACR50、ACR70或DAS28<3.2的患者比例均明显高于对照组。在安全评价方面,AE、感染发生率有所增加,其他不良反应诸如肝损害、带状疱疹、严重感染发生率等均与对照组比较差异无明显统计学意义,提示其不增加患者肝损害、带状疱疹等不良反应的发生率,故选择性JAK-1抑制药有望成为对MTX及其他DMARDs反应不足或无法耐受的患者更精准的补充治疗方案,使患者在得到较好疗效的同时不会增加相关的不良反应发生率。
本文的局限性包括:(1)2个药物尚未广泛用于临床,所纳入研究的样本量有限;(2)对照组干预措施仅限于安慰剂,而与其他DMARDs的疗效对比欠缺,故更进一步的疗效还需更多的临床试验进一步验证;(3)语种仅限于英文与中文,对于其他语种的相关研究未纳入。
综上,JAK-1抑制药在取得较好疗效的同时,可能会增加AE、感染风险,但不增加带状疱疹、肝损害等其他的不良反应发生率,为RA治疗提供了较乐观的前景。受纳入研究方法学质量和样本量限制,该结论有待更多设计严格、长期随访的大样本RCT加以验证。
