真实世界奥马珠单抗治疗中重度过敏性哮喘的疗效及安全性
2019-08-15墨玉清薛小敏金美玲
蔡 慧,墨玉清,薛小敏,叶 伶,杨 冬,金美玲
作者单位:200032 上海,复旦大学附属中山医院呼吸内科
哮喘是一种以气道炎症和气道高反应为主要特征的常见的慢性气道疾病,具有明显的异质性和复杂的发病机制。据统计,全球约有3.6 亿哮喘患者,我国约有3 千万哮喘患者[1-2]。近年来,哮喘的发病率仍呈上升趋势,成为严重的公共卫生问题,对患者乃至社会造成巨大的经济负担。其中中重度哮喘患者对医疗资源的需求远高于轻度患者,重度哮喘的医疗费用占哮喘总费用的一半以上[3]。目前哮喘的临床表型或内型细化,逐步打开了哮喘生物靶向药物的新领域,为哮喘患者尤其是过敏性哮喘患者带来了福音[4]。
奥马珠单抗是哮喘领域的第一个靶向治疗药物,是重组人源化的抗IgE 单克隆抗体[5]。它能够与游离的免疫球蛋白E (immunoglobulin E,IgE)结合,阻断IgE 与炎症细胞上的FcεRI 和CD23 受体结合,从而减轻Th2 型炎症免疫反应[6]。奥马珠单抗在全球上市已有十余年,积累了16 万以上哮喘患者的用药经验[7],但在国内临床应用于2018年3月刚刚起步,中国人群的临床经验和相关检查数据仍十分缺乏[8]。本研究纳入2018年3月至2018年12月49 例奥马珠单抗治疗的中重度过敏性哮喘患者,评价奥马珠单抗的临床疗效及安全性,以积累中国的哮喘治疗经验,为临床广泛应用提供参考依据。
1 对象与方法
1.1 对象
收集2018年3月至2018年12月在复旦大学附属中山医院呼吸科门诊接受奥马珠单抗治疗的中重度过敏性哮喘患者(年龄≥12 岁) 的病历资料,共入选49 例患者。入选标准:(1) 哮喘的诊断标准符合2016年中国哮喘防治指南[9],经第3 级哮喘药物治疗能达到完全控制者为中度哮喘[9];经第4 或5 级哮喘药物治疗能达到完全控制,或即使经过上述治疗仍不能完全控制者为重度哮喘[10]。(2) 过敏原检测阳性:过敏原皮肤点刺试验阳性、血清总IgE 或过敏原特异性IgE阳性[11]。(3) 所有患者均经过规范的吸入性糖皮质激素+长效支气管扩张剂治疗至少6 个月以上。(4) 患者本人或其监护人能够配合医师完成调查问卷。排除标准[11]:(1) 正在接受其他单克隆抗体治疗;(2) 对奥马珠单抗活性成分或者其他任何辅料有过敏反应者;(3) 哮喘急性发作者;(4) 血清总IgE 小于30 IU/ml,或大于1 500 IU/ml。本次参与临床观察的患者均对研究内容知晓并签署同意书,研究过程经过本院伦理委员会同意。
收集的临床信息包括性别、年龄、哮喘病史、吸烟史、哮喘严重程度、并发症、外周血总IgE 和过敏原检测,以及治疗前后症状、哮喘控制评分(asthma control test,ACT)、哮喘生活质量评分(asthma quality of life,AQLQ)、第一秒用力呼气容积 (forced expiratory volume in 1s,FEV1)、FEV1占预计值(FEV1% pred)、用力呼气容积(forced vital capacity,FVC)、呼出气一氧化氮(fractional exhaled nitric oxide,FeNO)、哮喘急性发作次数、口服激素用量等变化,以及奥玛珠单抗的不良反应。
1.2 治疗方案
根据患者治疗前测定的基线血清总IgE 和体质量,确定奥马珠单抗的给药剂量和给药间隔时间(每2 周或4 周给药1 次)[11]。每次给药剂量为150~600 mg,皮下注射,首次注射后在医院观察至少2 h,后续注射后则观察至少0.5 h。经奥马珠单抗治疗至少16 周后根据哮喘总体改善情况判断是否继续应用,如无显著改善,则应停用;若出现显著改善,建议继续用药[11]。
1.3 评价指标
分析患者的一般临床资料、治疗方案、相关检查结果。评估患者经奥马珠单抗治疗前后哮喘症状、ACT 评分、AQLQ 评分、FEV1、FEV1% pred、FVC、FeNO、哮喘急性发作次数、口服激素用量变化。观察患者是否发生不良事件作为药物安全性指标评估。
1.4 统计学处理
全部数据采用Graphpad prism Version 5.01 统计软件进行分析。连续变量采用均数+标准误(±s) 表示;分类变量采用例(n) 和百分数(%)表示。计量资料采用t检验,计数资料采用方差分析。以P<0.05 为差异有统计学意义。
2 结果
2.1 一般情况
49 例中重度过敏性哮喘患者年龄14 ~69 岁,哮喘病史(10.8±2.3)年,其中中度哮喘7 例,重度哮喘42 例。血清总IgE 为(430.3±100.9)IU/ml,有明确过敏原阳性者39 例,其中尘螨最多(55.1%),其次为霉菌或链格孢(22.4%)、草木花粉(18.4%)。ACT 评分为(18.4±0.8),AQLQ评分为(187.2±8.0) (表1)。

表1 49 例中重度哮喘患者的基线资料(n=49)Table 1 Baseline characteristics of moderate-to-severe asthmatic patients (n=49)
2.2 奥玛珠单抗治疗剂量及疗程
接受奥马珠单抗每个月150 mg 皮下注射者29 例,每 个月300 mg 14 例,每2 周450 mg 1 例,每个月450 mg 1 例,每2 周600 mg 1 例,每个月600 mg 3 例。截至2018年12月,25 例已治疗16 周以上(其中1 例已满40 周),13 例不足16 周终止治疗,尚有11 例治疗不足16 周仍在治疗中。
2.3 25 例完成16 周奥玛珠单抗治疗患者疗效评估
对25 例完成16 周奥玛珠单抗治疗的哮喘患者进行治疗前后各项指标的评估。
2.3.1 哮喘控制率、ACT、AQLQ 评分变化:25例患者基线时哮喘良好控制率为24.5%;经奥马珠单抗治疗16 周后,哮喘良好控制率为38.8%,较基线提高,差异有统计学意义 (P<0.05)(表2)。ACT 评分从基线期(18.3±0.9) 升高至治疗16 周后的(20.8±0.6) (P<0.05),AQLQ 评分从基线期(184.8±8.1) 升高至治疗16 周后的(206.8±5.4) (P<0.05) (表2)。
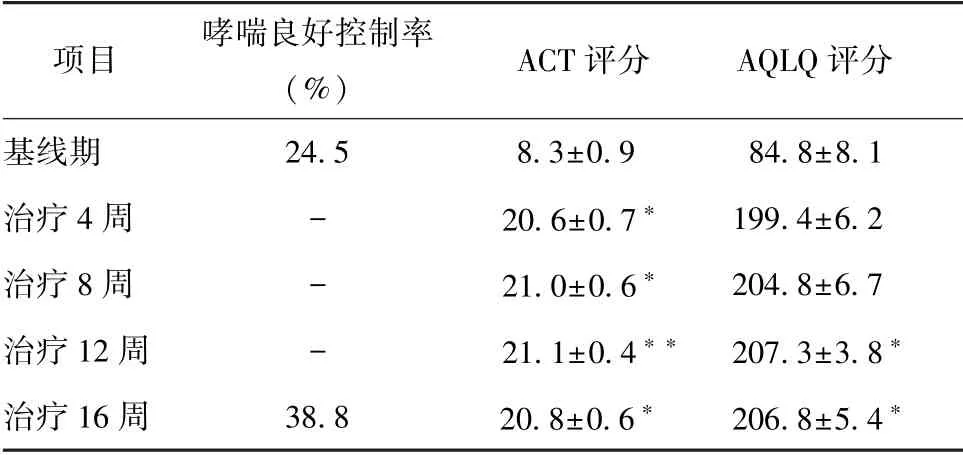
表2 哮喘患者经奥马珠单抗治疗前后ACT、AQLQ评分变化(n=25)Table 2 Changes of ACT and AQLQ scores before/after Omalizumab treatment in asthmatic patients (n=25)
2.3.2 FEV1、FEV1占预计值及FeNO 变化:25例哮喘患者经奥马珠单抗治疗后,FEV1从基线期(2.2±0.2) L 升高至16 周后 (2.3±0.2) L;FEV1% pred 从基线期(70.4±5.3)%升高至16 周后(77.1±4.6)% (见表3)。其中3 例患者FEV1改善量分别为(0.93 L,25.5%)、(0.91 L,51.4%)及(0.72 L,21.2%),肺功能改善明显。FeNO 从基线期(56.0±12.6) L 降低至16 周后(29.0±4.6) L (P<0.05) (表3)。

表3 哮喘患者经奥马珠单抗治疗前后FEV1、FEV1%pred、FVC 及FeNO 变化(n=25)Table 3 Changes of FEV1,FEV1% pred,FVC,and FeNO before/after Omalizumab treatment in asthmatic patients (n=25)
2.3.3 急性发作次数、口服激素用量变化:25例中10 例为口服激素依赖型重症哮喘。这10 例激素依赖型哮喘患者经奥马珠单抗治疗后,急性发作次数从基线期(1.2±0.1) 次/3 个月减少至16 周后(0.5±0.1) 次/3 个月(P<0.01),其中5 例治疗以来无急性发作;口服泼尼松用量从基线期(17.0±2.4) mg/d 减少至16 周后 (4.5±1.6) mg/d (P<0.001),其中4 例已停用口服激素治疗。
2.4 药物安全性分析
49 例患者共进行了208 例次奥马珠单抗皮下注射治疗,2 例出现乏力、嗜睡,均为轻度;1 例每次注射后均发生皮肤瘙痒,在2 h 内出现,均可自行消失;1 例出现双下肢水肿;1 例注射后2 h出现大汗、头晕、恶心,头晕、恶心持续存在1 个月以上,并发生继发性高血压,该例患者后未再使用奥玛珠单抗。未见其他相关不良反应。
2.5 终止治疗原因分析
49 例患者中13 例治疗不足16 周即终止治疗,其中1 例因总IgE 超过1 500 IU/ml,且奥马珠单抗剂量由于经济原因给药剂量不足,预估疗效不佳提早停用;2 例因疗效不确切停用;1 例因不良反应终止治疗;9 例因经济原因停用。
3 讨论
哮喘是最常见的过敏性疾病之一,70%以上哮喘患者存在过敏因素[12]。IgE 在介导过敏反应、哮喘发生中起着重要作用;抗IgE 单抗的临床应用强有力地证实这一点:奥马珠单抗能减轻哮喘症状,减少哮喘急性发作和口服激素量,改善患者生活质量。2003年,美国食品药品管理局(Food and drug Administration,FDA) 批准奥马珠单抗用于治疗重度过敏性哮喘患者,至此打开了哮喘生物靶向治疗的新领域。2017年8月中国FDA 批准奥马珠单抗上市,2018年3月国内哮喘患者开始接受这一生物靶向治疗。本研究纳入了49 例接受奥马珠单抗治疗的中重度过敏性哮喘患者,对其安全性进行观察,对其中25 例完成16 周治疗疗程的患者进行疗效分析,证实奥马珠单抗能够减轻哮喘及相关过敏症状,减少哮喘急性发作和口服激素用量,同时改善肺功能。本研究同时对终止治疗的患者进行原因分析,由于经济原因直接导致终止治疗是主要原因,由于经济原因给药剂量不足导致疗效不佳而终止治疗也是常见原因。本观察研究中继续治疗的患者显示较好的临床疗效,分析这些患者的临床特点,均为过敏性哮喘,血清总IgE 值为30~1 500 IU/ml,且精确计算奥马珠单抗的给药剂量。多项临床研究报道使用奥马珠单抗与安慰剂发生的不良事件相仿,为轻度或中度[13-14]。主要的不良时间包括注射部位局部皮肤反应、上呼吸道感染、恶心、头痛和乏力等。本观察研究中患者治疗期间仅1 例发生较明显不良反应,少数有轻度乏力、嗜睡、皮肤瘙痒、下肢水肿,余无明显不良反应,耐受性好。
奥马珠单抗治疗方案是基于患者基线血清总IgE (30~1 500 IU/ml) 和体重制定的。研究发现,基线总IgE 很难通过治疗前一次检测就能确定。血清中总IgE 的影响因素很多,包括季节性接触过敏原如花粉、草木等导致血清总IgE 升高[15],以及重度哮喘患者因长期口服激素导致血清总IgE 下降,因此如何确定基线血清总IgE 成为确定奥马珠单抗治疗方案一个至关重要的问题。本研究中的1例长期口服泼尼松20 ~50 mg/d,联合布地奈德/福莫特罗吸入治疗的重度激素依赖型过敏性哮喘患者,近1年内多次IgE 检测均小于100 IU/ml,考虑与该患者长期口服激素导致血清总IgE 下降有关。参考该患者1年前曾有一次血清总IgE 大于200 IU/ml 的记录,故取基线的IgE 为100~200 IU/ml 之间,参考患者体重,给予奥马珠单抗每个月300 mg 皮下注射。为期16 周治疗期间,该患者哮喘发作次数减少、口服激素量减少。另外,目前国内不同检测方法所得到的总IgE 值相差很大[16],故在确定基线IgE 水平时应参考多种因素。
Sposato 等[17]通过真实世界观察性研究发现长期使用奥马珠单抗并不影响其疗效(疗效持续60个月以上),长期治疗不仅减少口服激素量,还能减少支气管扩张剂及吸入激素等的使用量。然而尚无指南给出奥马珠单抗的明确疗程[11]。一项长期观察性研究发现奥马珠单抗治疗6年的18 例哮喘患者停药后3年内哮喘仍控制良好[18]。药代动力学和药效学研究预测奥马珠单抗停药后IgE 增加缓慢,可能需要15年时间才能达到基线值[19]。上述研究提示哮喘患者可能不需要长期维持奥马珠单抗治疗,但合适的疗程仍有待进一步研究。也有国内外学者提出监测血清游离IgE 以反映奥马珠单抗的疗效[20],但鉴于目前仍缺乏特异性高、灵敏度好的试剂盒,暂无法用于临床疗效评估[21-22]。本研究20 例患者在16 周观察期后继续应用奥马珠单抗,后续疗效仍在观察中。
本研究中有1 例患者首次用药后,即在注射后2 h 后出现较明显的不良反应,表现为恶心、头晕、大汗淋漓、局部手臂胀痛并发生继发性高血压,且症状持续了1 个月以上[23]。分析原因,除个体差异外,该患者为15 岁少年,肥胖,体重85 kg,总IgE 700 IU/ml,按照常规剂量,给予奥马珠单抗每个月600 mg,并给予一次性注射。对于青少年,可能单次剂量过大,是造成不良反应的原因之一;另外,对于肥胖者,奥马珠单抗注射剂量的确定,是否根据实测的体重是个值得关注的问题。
尽管哮喘生物治疗费用较高,但对于重度过敏性哮喘患者,使用奥马珠单抗治疗后减少了医疗资源的利用,提高了患者生活质量,可以获得较好的药物疗效与经济学效果[24-25]。同时,迫切需要积累该药物在中国哮喘人群中的临床应用经验和数据,以便挖掘获益人群的临床特征和生物标志物,精准定位获益人群。
综上所述,本研究通过真实世界研究随访了接受奥马珠单抗治疗的中重度过敏性哮喘患者,并进行治疗前后对比分析,结果表明奥马珠单抗能够有效控制哮喘症状,减少急性发作和口服激素用量,改善肺功能,且不良反应少,患者耐受性好。本研究尚有以下不足:(1) 研究病例数较少;(2) 观察期偏短,尚不能评价其长期疗效;(3) 部分个例报道需具体分析。后续需扩大病例数,继续随访并总结临床特征,为奥马珠单抗的临床应用和疗效评估提供更科学的实践经验。
