膜芯片技术对牛、羊、牦牛、驴肉源食品的掺伪鉴别
2019-08-14任易婕霍胜楠翟清燕孙潇慧刘菲李文静
任易婕 霍胜楠 翟清燕 孙潇慧 刘菲 李文静


摘 要:采用膜芯片技术,通过对牛、羊、驴、牦牛、鸡、鸭、兔、貂、狐、鼠、猪11 种目标物种的检测,实现对牛、羊、驴、牦牛物种的掺伪鉴别。结果表明:该方法具有良好的特异性和适用性,检测灵敏度和掺伪灵敏度均可达到0.1%,能快速、准确地同时鉴别牛、羊、驴、牦牛、鸡、鸭、兔、貂、狐、鼠、猪11 种动物源性成分,可满足肉类食品样品中对牛、羊、牦牛、驴等掺伪鉴别的检验需求。
关键词:膜芯片技术;高通量;动物源性成分;肉类;掺伪鉴别
Abstract: A membrane chip technology to detect 11 target animal species including cattle, sheep, donkey, yak, chicken, duck, rabbit, mink, fox, mouse and pig was developed in order to identify adulteration in beef, mutton, donkey and yak meat products. Our experimental results showed that the method had good specificity and applicability. The method sensitivity and its sensitivity in detecting adulterated meat samples were both up to 0.1%. This method could quickly and accurately identify 11 animal origin components of cattle, sheep, donkey, yak, chicken, duck, rabbit, mink, fox, mouse and pig, and could meet the requirements for the identification of adulteration in beef, mutton, yak and donkey meat samples.
Keywords: membrane chip technology; high throughput; animal-derived constituents; meat; adulteration identification
DOI:10.7506/rlyj1001-8123-20190417-081
中图分类号:TS251.5 文献标志码:A 文章编号:1001-8123(2019)06-0033-06
引文格式:
任易婕, 霍胜楠, 翟清燕, 等. 膜芯片技术对牛、羊、牦牛、驴肉源食品的掺伪鉴别[J]. 肉类研究, 2019, 33(6): 33-38. DOI:10.7506/rlyj1001-8123-20190417-081. http://www.rlyj.net.cnREN Yijie, HUO Shengnan, ZHAI Qingyan, et al. Application of membrane chip technology in the identification of adulteration in beef, sheep, yak and donkey meat[J]. Meat Research, 2019, 33(6): 33-38. DOI:10.7506/rlyj1001-8123-20190417-081. http://www.rlyj.net.cn
近年来,随着我国经济发展日益迅速,我国食品产业也进入飞速发展的黄金时期,民众对于多种肉类的需求也逐渐上升。然而食品安全问题层出不穷,给整个食品行业和广大消费者造成很大的影响。驴肉因口感好、脂肪含量低、营养价值高等特点,受到越来越多消费者的青睐[1],但其产量低、价格高,时有掺假情况发生[2-3]。牦牛是一种产自西部地區的特色畜类动物,牦牛肉氨基酸比例均衡,脂肪含量很低,可作为优质蛋白质的肉质来源[4],但其市售价格远高于其他肉制品,掺伪现象时有发生[5-6]。常见的市售加工牛肉、羊肉,如羊肉串、肉干、肉丸等,也常有被掺假的可能性,甚至被不法商贩掺入低价的猪肉、鸡肉、鸭肉甚至狐狸肉[7-8]。有文献报道指出,在抽检的预包装与散装牛肉制品中,分别有2 批次和5 批次检出非牛源性成分[9]。北京地区对牛羊肉进行筛查后,发现其存在掺入鸭肉、鸡肉、猪肉的比例高达34.9%[10]。驴肉、牦牛肉、牛肉、羊肉的掺伪时有报道,因此,对上述肉制品进行掺伪鉴别成为广大民众与食品检测的需求。但在对肉制品进行动物源性成分筛查时,同一份样品往往需要同时开展多种可疑掺假动物源性成分的检测,工作量较大,对于大批量的肉制品筛查需要花费较长的时间及较多的人力物力。此外,对于某些由多种肉制品加工而成的肉制品来说,单重鉴别方法显得效率低下。因此,建立一种高通量的针对多种动物源性成分的检测方法迫在眉睫。
目前,动物源性成分检测技术有很多,包括基于代谢组学的检测方法、基于蛋白质的检测方法和基于核酸的检测方法等[11-12]。聚合酶链式反应(polymerase chain reaction,PCR)技术由于其灵敏度高、特异性好,且引物探针设计简单,成为目前应用度最高的动物源性成分检测技术[13-15]。PCR方法包括普通PCR技术、实时荧光PCR技术和数字PCR技术等[16-17]。目前在PCR技术中,荧光PCR方法应用最为广泛[14,18-20],也是很多动物源性成分检测标准中的常用方法。尽管传统的动物源性成分分子生物学检测技术具有很多优点,但在样本量大、高效、快速的检验要求下,不能很好地满足检验需求。且现有分子生物学检测技术对实验室仪器、环境条件、人员技术等要求较高,因此仅适用于实验室检验,不适用于大规模、高通量筛查工作的需求,无法满足当前食品安全监督、监管的要求。因此,需要建立新的方法来进行动物源性成分的高通量、多指标检测。
膜芯片检测方法是核酸杂交技术发展的产物,该方法利用反向斑点杂交原理,将一组寡核苷酸探针顺序排列于支持膜表面,形成一系列低密度膜芯片探针阵列。利用多重PCR技术将待检测目标基因进行扩增后,扩增产物经过变性后形成的单链DNA与膜芯片上的探针杂交,经底物显色形成可视化的检测结果。1992年,膜芯片技术被Fiss等[21]用来检测分枝杆菌,随后被应用到食品微生物检测[22-23]、转基因筛查[24-26]、动物医学[27-28]及生物科学[29-30]等众多领域。由于可视化芯片一般将多个靶位点同时固定在芯片上,因此可同时检测多个目的基因。与传统PCR方法相比,膜芯片检测方法具有检测通量高、检测周期短、成本低廉、结果可靠等技术优势,可作为一种高通量动物源性成分检测方法加以利用。本研究设计了一种膜芯片方法,可快速鉴别驴肉、牦牛肉、牛肉、羊肉中是否有鸡、鸭、兔、貂、狐、鼠、猪等肉源成分的掺伪,为肉源性成分检测提供了良好思路。
1 材料与方法
1.1 材料与试剂
从济南市场及购物网站购买各种肉类样本,包括牛、羊、驴、鸡、鸭、猪等生鲜样本及各种加工肉制品(牛肉干2 份、牦牛肉干1 份、酱驴肉2 份、羊肉串1 份)。牦牛、兔、貂、狐、鼠、貉、马、水牛、狗、鱼等材料为本实验室储存样本。
肉及肉制品核酸提取试剂盒为德国凯杰公司产品;其余化学试剂为生工生物工程(上海)股份有限公司。
1.2 仪器与设备
AB proFlex PCR仪 美国Thermo公司;5424R小型冷冻离心机 德国Eppendorf公司;NanoDrop 2000紫外-可见分光光度计 美国Thermo Fisher Scientific有限公司;QuantStudio7 Flex实时荧光PCR仪 美国ABI公司;HL-2000紫外交联仪 美国思博明科学器材公司。
1.3 方法
1.3.1 引物和探针设计利用Primer Premier 5.0软件设计11 种动物源性成分及内参18S rRNA引物,同时设计可通过碱基互补配对与DNA产物结合的特异性探针。反向引物的5末端用生物素Biotin修饰,引物可扩增出长度为100~200 bp的带有生物素标记的PCR产物。探针5端连接有6 个碳原子作为连接臂的氨基修饰,用来将探针固定在膜芯片上。同时设计对照探针PC及NC,用来监测杂交过程是否正常。设计5端用生物素修饰、可与PC探针互补的阳性寡核苷酸单链(CPC),用于质控膜芯片杂交过程。11 种动物源性成分及内参的引物探针序列如表1所示。
1.3.2 样品制备
取100 g肉源样本,经四分法缩分后,进行冷冻研磨,于-20 ℃保存备用。
1.3.3 DNA提取及浓度测定
取50 mg研磨后的样本,加入1.5 mL离心管中,参照试剂盒方法进行DNA提取。
1.3.4 多重PCR扩增及变性
参照普通PCR反应体系,加入11 种引物,进行多重PCR扩增。多重PCR反应体系中,体系总体积为50 μL,各物质的终浓度分别为:MgCl2 1.5 mmol/L,dATP、dCTP、dGTP、dTTP和dUTP均为0.2 mmol/L,UNG酶1 U/50 μL,Taq酶2 U/50 μL,每条引物终浓度0.2 μmol/L。分别用来自11 种动物的基因组DNA为阳性对照,用不含这11 种动物成分的DNA为阴性对照,水为空白对照,作为PCR扩增系统和膜芯片杂交反应的质量控制。PCR反应参数:37 ℃、10 min,1 个循环;95 ℃、10 min,95 ℃、30 s,55 ℃、30 s,72 ℃、30 s,35 个循环;72 ℃、10 min,1 个循环。产物变性:将多重PCR产物进行退火变性,以保持单链状态。变性过程为95 ℃、5 min,4 ℃、10 min。退火后单链状态的DNA需立即置于低温状态下。
1.3.5 膜芯片检测
1.3.5.1 11 种动物源性成分的膜芯片设计
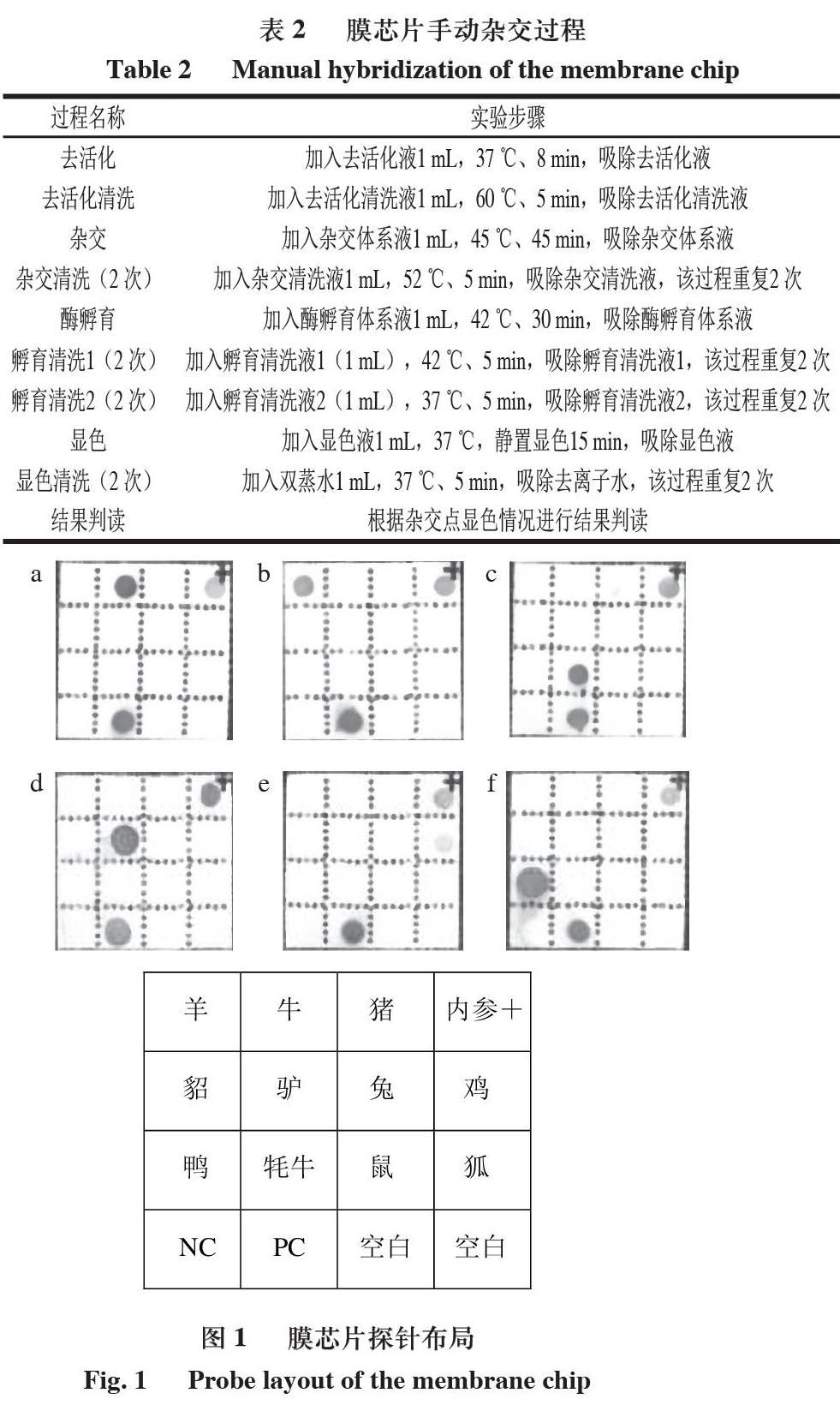
将正方形尼龙薄膜分成16 个小区域,将探针根据图1中的表面設计固定在不同区域。可根据不同点阵的显色情况判断是否有该物种源性成分检出。
1.3.5.2 膜芯片手动杂交过程
手动杂交主要包括去活化、杂交、酶联、显色和读取结果等几个主要步骤:去活化是将没有固定在膜上的探针的活性基团封闭,从而增加膜芯片的特异性;杂交过程是通过已固定在膜上的探针将待测PCR产物中的目的基因片段捕获;酶联中使用的标记是碱性磷酸酶标记的链霉亲和素,而PCR产物中目的基因片段带有生物素标记,如果PCR产物含有目的片段,通过生物素与链霉亲和素的作用可以将碱性磷酸酶连接到膜上;显色是通过酶与对应底物发生的变色反应来指示膜上是否有碱性磷酸酶,从而间接指示待测PCR产物中是否含有目的基因片段,从而判定样品中是否含有目标动物源成分[21-23]。
将膜芯片置于杂交盒内,按表2进行手动杂交。杂交过程在紫外交联仪中进行,可采用同等实验效果的仪器。
由图2可知,牛、羊、驴、牦牛、鸡、鸭、兔、猪、貂、狐、鼠在探针所在位置有特异性杂交斑点,内参和阳性对照位置杂交斑点显色正常,阴性对照及其他位置无杂交显色斑点。a~f分别表示貉、马、水牛、狗、鱼、猫特异性检测结果。
由图3可知,芯片上貉、马、水牛、狗、鱼、猫物种没有异常杂交点显示,且各种对照位置均显色正常,无其他物种的杂交显色斑点。结果表明,该膜芯片对牛、羊、驴、牦牛、鸡、鸭、兔、猪、貂、狐、鼠11 种物种具有良好的特异性,膜芯片上不具有的物种无特异杂交斑点产生。
2.2 11 种肉源成分检测灵敏度实验
本研究以牛、羊、牦牛、驴为例,验证该膜芯片方法的灵敏度。将提取的牛、羊、牦牛、驴的DNA与鸡、鸭混合DNA充分混匀,分别制备质量分数为5.0%、1.0%和0.1%的混合模板。按照方法中的操作,进行多重PCR扩增及杂交实验。
由图4可知,在5.0%、1.0%和0.1%的混合比例下,牛、羊、牦牛和驴与鸡、鸭的混合DNA在膜芯片上均有显色反应,各对照位置均显色正常,在鸡、鸭的显色位点上有杂交显色斑点,说明在质量分数5.0%、1.0%和0.1%条件下,该方法可检出牛、羊、牦牛、驴成分。实验结果表明,该方法对牛、羊、牦牛、驴成分具有良好的检测灵敏度,其检测下限可达到0.1%。a~d分别表示牛、羊、驴、牦牛成分的灵敏度检测结果;下脚标1~3. 质量分数为5.0%、1.0%和0.1%的混合模板。掺伪比例为0.1%;a~e分别表示掺入兔、猪、貂、狐、鼠成分的灵敏度检测结果。
此外,进行掺伪物种灵敏度检测。分别将兔、猪、貂、狐、鼠DNA与鸡、鸭混合DNA充分混匀进行杂交实验。由图5可知,在0.1%掺伪比例下,兔、猪、貂、狐、鼠成分在膜芯片上均有显色反应,各对照位置均显色正常,在鸡、鸭的显色位点上有杂交显色斑点,说明在质量分数5.0%、1.0%和0.1%条件下,该方法可检出兔、猪、貂、狐、鼠成分,表明该方法具有良好的掺伪检测灵敏度,方法检出限可达0.1%。
2.3 牛、羊、牦牛、驴成分检测适用性验证实验
为检验膜芯片法的实际应用效果,从市场上购买6 份加工肉制品样品,包括牛肉干2 份、牦牛肉干1 份、驴肉2 份及羊肉串1 份。各待测样品按照实验方法中所述进行PCR扩增和芯片杂交实验,每种样品重复测定2 次,同时进行荧光方法验证。猪、牛、羊靶点检测采用SN/T 2051—2008《食品、化妆品和饲料中牛羊猪源性成分检测方法 实时PCR法》中的荧光方法进行验证;驴靶点检测采用SN/T 3730.4—2013《食品及饲料中常见畜类品种的鉴定方法 第4部分:驴成分检测 实时荧光PCR法》进行验证,马靶点检测采用N/T 3730.5—2013《食品及饲料中常见畜类品种的鉴定方法 第5部分:马成分检测 实时荧光PCR》进行验证,牦牛成分检测采用SN/T 4397—2015《出口食品中牦牛源性成分的檢测方法 实时荧光PCR法》进行验证。
由表3可知,芯片显色结果为各质控对照检测结果正常,6 份市售样品中有2 份样品与标签不一致,其中牦牛肉干未检出牦牛源性成分,但检出猪成分,一份驴肉样品未检出驴源性成分,但检出马源性成分,剩余4 份样品与产品配料表中标注成分一致。通过荧光验证发现,6 份市场样品膜芯片法检测结果与荧光验证结果一致,表明该方法对于牛、羊、牦牛、驴源性成分的检测具有良好的适用性,可用于包含上述4 种肉源成分的各种肉质样品检测。
3 结 论
本研究设计了一种可以高通量鉴别11 种动物源性成分的膜芯片方法,通过对目的肉源性成分进行DNA提取、多重PCR扩增并杂交后,对牛、羊、牦牛、驴源性成分进行特异性、灵敏度与适用性验证。结果表明,该方法特异性良好,牛、羊、牦牛、驴源性成分的掺伪灵敏度可达到0.1%,且检验结果与荧光PCR结果相一致,可快速检测出牛、羊、牦牛、驴样品中是否含有鸡、鸭、兔、貂、狐、鼠、猪源性成分。生鲜肉和加工肉制品检验结果与国标方法相一致,可满足适用性要求。与荧光PCR方法相比,其高通量、高效率的特点缩短了检验所需时间与人力,能够充分满足市场监管和日常检验的需求。
参考文献:
[1] 李景芳, 王燕, 陆东林. 驴的肉用性能和驴肉的营养价值[J]. 新疆畜牧业, 2018, 33(12): 11-16; 19. DOI:10.16795/j.cnki.xjxmy.2018.12.002.
[2] 海小, 刘国强, 罗建兴, 等. 基于TaqMan实时荧光PCR检测鲜肉及加工肉制品中的驴源性成分[J]. 肉类研究, 2018, 32(4): 62-67. DOI:10.7506/rlyj1001-8123-201804011.
[3] 刘畅, 张奇, 王思颖, 等. 驴肉及其制品真伪鉴别技术研究进展[J]. 食品安全质量检测学报, 2017, 8(7): 2657-2663.
[4] 李维红, 高雅琴, 杨晓玲, 等. 不同牦牛肉氨基酸质量分析[J]. 湖北农业科学, 2018, 57(12): 89-90; 105. DOI:10.14088/j.cnki.issn0439-8114.2018.12.024.
[5] 段庆梓, 尚柯, 张彪, 等. 肉及肉制品中牦牛源性成分的PCR鉴别[J]. 食品研究与开发, 2017, 38(9): 157-160.
[6] 唐善虎, 李雪, 王柳. 用LAMP法快速鉴别熟制牦牛肉饼中的猪肉和鸡肉成分[J]. 西南民族大学学报(自然科学版), 2018, 44(3): 237-242.
[7] 邱翔, 张磊, 文勇立, 等. 四川牦牛、黄牛主要品种肉的营养成分分析[J]. 食品科学, 2010, 31(15): 112-116.
[8] 沙才华, 汪文辉, 黄海超, 等. TaqMan荧光PCR法检测肉制品中牛源性成分及定量研究[J]. 中国动物检疫, 2016, 33(12): 89-93.
[9] 罗绍楠, 戴奕杰, 孙端方. 贵阳市纯牛源性食品真实性鉴定调查[J]. 食品安全导刊, 2018(3): 149-150. DOI:10.16043/j.cnki.cfs.2018.03.104.
[10] 李楠, 王佳慧, 沈青, 等. 北京地区牛、羊肉片中鸭、鸡、猪源性成分调查[J]. 中国食品卫生杂志, 2014, 26(3): 227-232. DOI:10.13590/j.cjfh.2014.03.006.
[11] 王成程, 韩国全, 张琴, 等. 肉及肉制品真伪鉴别技术研究进展[J]. 食品安全质量检测学报, 2018, 9(22): 5930-5935.
[12] 高敬, 魏迪, 张癸荣, 等. 常见肉类鉴别技术研究进展[J]. 食品科学, 2014, 35(11): 356-360.
[13] AL-KAHTANI H A, ISMAIL E A, ASIF AHMED M. Pork detection in binary meat mixtures and some commercial food products using conventional and real-time PCR techniques[J]. Food Chemistry, 2017, 219: 54-60. DOI:10.1016/j.foodchem.2016.09.108.
[14] 陈文炳, 邵碧英, 廖宪彪, 等. 加工食品中若干动物成分的PCR检测技术应用研究[J]. 食品科学, 2005, 26(8): 338-342.
[15] 钱俊平, 郭梁, 海小, 等. 肉制品中羊源性成分的定性和定量检测[J]. 肉类研究, 2018, 32(12): 42-47. DOI:10.7506/rlyj1001-8123-201812008.
[16] REN Junan, DENG Tingting, HUANG Wensheng, et al. A digital PCR method for identifying and quantifying adulteration of meat species in raw and processed food[J]. PLoS One, 2017, 12(3): e0173567. DOI:10.1371/journal.pone.0173567.
[17] SHEHATA H R, LI J, CHEN S, et al. Droplet digital polymerase chain reaction (ddPCR) assays integrated with an internal control for quantification of bovine, porcine, chicken and turkey species in food and feed[J]. PLoS One, 2017, 12(8): e0182872. DOI:10.1371/journal.pone.0182872.
[18] 周李華, 马丽侠, 李怀平, 等. 牛源性成分核酸检测方法研究进展及技术标准分析[J]. 中国测试, 2017, 43(12): 50-57.
[19] 李婷婷, 张桂兰, 赵杰, 等. 肉及肉制品掺假鉴别技术研究进展[J]. 食品安全质量检测学报, 2018, 9(2): 409-415.
[20] 杨冬燕, 李浩, 杨永存. 肉制品掺假鉴别与定量检测[J]. 卫生研究, 2016, 45(2): 324-328.
[21] FISS E H, CHEHAB F F, BROOKS G F. DNA amplification and reverse dot blot hybridization for detection and identification of mycobacteria to the species level in the clinical laboratory[J]. Journal of Clinical Microbiology, 1992, 30(5): 1220-1224.
[22] YUN Zhenyu, ZENG Lian, HUANG Weijian, et al. Detection and categorization of diarrheagenic escherichia coli with auto-microfluidic thin-film chip method[J]. Scientific Reports, 2018, 8(1): 12926. DOI:10.1038/s41598-018-30765-3.
[23] 贺晨, 孙鸿燕, 邵丽筠, 等. 多重PCR结合基因芯片技术检测11 种致病菌方法的建立[J]. 中国实验诊断学, 2011, 15(4): 587-591.
[24] YUN Zhenyu, PENG Liping, HUO Shengnan, et al. Auto-microfluidic thin-film chip for genetically modified maize detection[J]. Food Control, 2017, 80: 360-365.
[25] 李永进, 熊涛, 吴华伟, 等. 利用可视化膜芯片检测9 种转基因玉米[J].湖北农业科学, 2016, 55(11): 2926-2929. DOI:10.14088/j.cnki.issn0439-8114.2016.11.055.
[26] 韦世录, 何敏, 何晓, 等. 结核杆菌耐药基因膜芯片检测[J]. 中国公共卫生, 2012, 28(4): 425-427.
[27] 朱业培, 王玮, 吕青骎, 等. 基于基因芯片技术检测6 种动物源性成分[J]. 南京农业大学学报, 2015, 38(6): 1003-1008.
[28] 范宏伟, 吴鑫, 朱应飞, 等. 膜芯片用于肉制品中动物源性成分检测的研究[J]. 食品安全质量检测学报, 2017, 8(9): 3479-3484.
[29] 苏焕斌, 张燕, 彭宏威. 生物芯片在食品安全检测中的应用研究进展[J]. 食品安全质量检测学报, 2018, 9(11): 2756-2761.
[30] WANG Wei, HAN Jianxun, WU Yajun, et al. Simultaneous detection of eight food allergens using optical thin-film biosensor chips[J]. Journal of Agricultural and Food Chemistry, 2011, 59(13): 6889-6894. DOI:10.1021/jf200933b.
