一氧化氮供体型药物抗肿瘤作用的研究进展
2019-08-13宾雨飞廖端芳
宾雨飞 廖端芳

〔摘要〕 肿瘤已经成为当今社会的重大健康问题,作为抗肿瘤药物的一氧化氮(NO)供体型药物在这方面引人注目。一些NO供体药物已被证明具有良好的抗癌活性,显示出其应用潜力和价值。通过控制NO在适当的部位释放并杀死肿瘤细胞,实现药物的靶向性,是NO供体类药物治疗癌症的一个新领域和重要的发展方向。本文将综述NO供体型药物在抗肿瘤领域的研究进展,以及简要介绍新型NO供体纳米材料。
〔关键词〕 肿瘤;NO供体型药物;新型NO供体纳米材料
〔中图分类号〕R979.1 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2019.05.023
〔Abstract〕 Tumor has become a major health problem in today's society. As an anti-tumor drug, nitric oxide (NO) donor drug has attracted much attention in this field. Some NO donor drugs have shown good anti-cancer activity, showing their potential applications and value. It is a new field and an important development direction for NO donors to treat cancer by controlling the release of NO in appropriate sites and killing tumor cells, and then achieving drug targeting. This paper reviewed the research progress of NO donor drug-based drugs in the field of anti-tumor, and briefly introduce the new NO donor nanoparticle materials.
〔Keywords〕 tumor; nitric oxide donor drugs; new nitric oxide donor nanoparticle materials
一氧化氮(NO)作为一种气体信号分子,具有多种生物学功能[1]。在低浓度下,NO作为许多生理过程中的信号传感器,在血流量的调节、平滑肌的松弛作用、铁平衡、血小板的反应性以及神经传递等生理活动发挥作用。在高浓度下,NO可以激活人体内针对病原体(包括肿瘤)的细胞毒性防御机制。此外,越来越多的证据表明,内源性高浓度的NO涉及一些疾病的发病机制,例如动脉粥样硬化[2]、神经退行性病变[3]。
在肿瘤生物学[4-5]中,NO对于肿瘤的发生和发展有着双重的作用,低浓度的NO是由eNOS(内皮型一氧化氮合酶)和nNOS(神经型一氧化氮合酶)合成的,它通过促进肿瘤血管生成,细胞侵袭和转移促进肿瘤的生长[6]。此时,NO发挥抗凋亡的作用。而由iNOS(诱导型一氧化氮合酶)合成的NO则可以通过促进肿瘤细胞凋亡抗肿瘤[7]。由此说明,这3种一氧化氮合酶亚型对于肿瘤的效应是双重的,也就是说,NO浓度的高低可以决定其对于肿瘤的效应是促进还是抑制[8]。高浓度的NO可以通过以下几种机制发挥它的抗肿瘤作用:(1)通过上调p53基因诱导细胞凋亡[9];(2)抗细胞凋亡蛋白酶分子的下调[10];(3)通过增加细胞色素c的释放[11];(4)通过形成过氧亚硝酸离子影响p53基因的表达[12];(5)影响肿瘤细胞周期停滞,肿瘤细胞坏死,抑制肿瘤环境微血管生成以及肿瘤细胞毒性[13-14]等。由于NO是气体分子,在体内半衰期较短,在水溶液中不稳定,不方便利用等特点,近年来越来越多的研究集中于NO供体[15]。现综述NO供体型抗肿瘤药物的研究进展,报道如下。
1 有机硝酸酯类NO供体
有机硝酸酯类NO供体已经在临床上用于肿瘤的防治。该类化合物通过提高肿瘤的氧合能力以及提高肿瘤灌注从而抑制肿瘤血管生成来抗肿瘤[16]。其中,缩水甘油硝酸酯(GLYN)(图1)可以激活NO在M21黑色素瘤细胞系的释放,提高SCC Ⅶ移植瘤模型对于γ放射线以及顺铂的敏感性,增加肿瘤组织内血流量,这对于肿瘤的低氧微环境特别有意义[17]。Wang等[18]发现,单硝酸异山梨酯(ISMN)联合阿司匹林用药能有效抑制结肠癌。其体外实验表明,IMSN与阿司匹林联合用药可以有效抑制HCT116和SW620结肠癌细胞,而且对正常的人脐静脉内皮细胞株(ea.hy926)没有影响。随后,将HCT-116细胞接种至裸鼠形成移植瘤模型,发现ISMN与阿司匹林联合用药可以诱导HCT-116细胞凋亡。并且,体内释放的NO越多,荧光素酶启动子活性以及HCT-116细胞内的细胞周期蛋白(cyclin D1)和c-myc基因的表达越少。
2 金属-NO复合物
硝普钠(SNP)(图2)是金属-NO复合物的代表,其在20世纪70年代就用于高血压的急救。SNP是典型的铁复合物,通过侵袭抑制、HIF-1干扰和放射增敏显示其具有一系列肿瘤模型的治疗潜力[19]。最近报道,SNP致敏AGS、SGC7901、MKN45和MKN28胃癌细胞株与肿瘤坏死因子(TNF)相关的凋亡诱导配体(TRAIL)诱导细胞凋亡。然而,由于其非选择性的NO释放,SNP的体内实验一直是空白[20]。Valerio等[21]研发了一种新型的金属-NO复合物NO供体:Ni-(SalPipNONO)并以人肺癌A549细胞为模型探讨其抗癌作用机制。该化合物可以抑制肿瘤细胞克隆形成和细胞侵袭,同时促进细胞凋亡。其抗肿瘤活性一部分是由于NO-cGMP依赖途径有助于肿瘤细胞坏死。另一部分原因是其水杨醛片段和活性氧(ROS)激活ERK1/2信号,由此激活capase-3介导的细胞凋亡通路。NO配位的钌络合物构成另一类NO供体,该类供体可以被热源或者光源活化释放NO。钌亚硝基配合物与其它金属亚硝基配合物相比,具有更高的水溶性、对空气氧化性和对宿主细胞的低毒性等优点。近期已經发表了一些钌亚硝基配合物对癌细胞的细胞毒性研究,比如,Maroto-Diaz等[22]基于芳烃钌(Ⅱ)配合物合成了一系列的碳硅烷类金属树枝化合物,并测试了其对几种癌细胞的毒性,发现该类化合物绝大部分对HeLa、MCF-7、HT-29以及MDA-MB-231的IC50在10 μM以内。
3 氧化呋咱类NO供体
氧化呋咱类化合物(图3)是一种巯基依赖性的杂环类NO供体,它的衍生物如苯并氧化呋咱(图4)、嘧啶并氧化呋咱(图5)同样具有NO供体性质[23]。其结构中的巯基首先进攻氧化呋咱环的3或4位,然后脱芳异构化开环释放NO[24]。外源性NO可以逆转肿瘤细胞的多药耐药性,使得肿瘤细胞对化疗药物的敏感性增加[25]。基于此,Tang等[26]合成了以呋咱为母核的一系列化合物,其能显著逆转MCF-7/ADR细胞对阿霉素的耐药性。Farias等[27]合成了苯并呋咱衍生物N-Br和N-Ⅰ并测试其对人和小鼠黑色素瘤细胞的活性,发现这2种化合物可以诱导黑色素瘤细胞的凋亡。Zhang等[28]设计的氧化呋咱NO供体拼合化合物对于耐药性的结肠癌细胞有很强的抑制活性,其机制与抑制H1F-1α,Stat3,AKT,ERK信号通路有关。
4 新型偶氮二醇烯鎓盐类供体药物
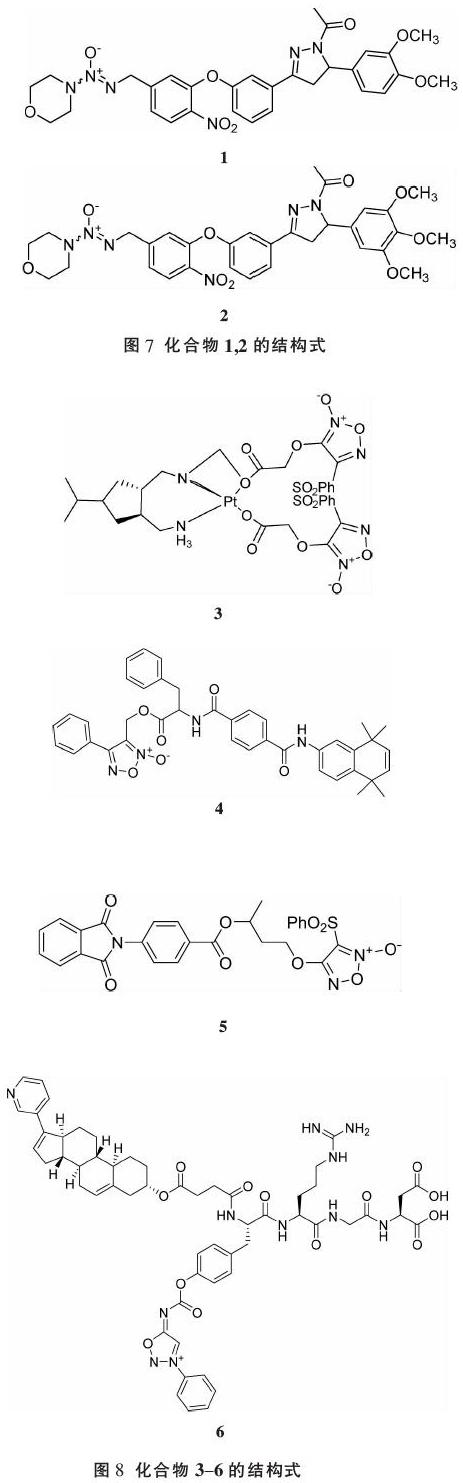
偶氮二醇烯鎓盐(DETANONOates) 是典型的离子型偶氮鎓二醇盐,每摩尔化合物能在pH 7.4条件下自动释放NO。DETANONOate具有较长的半衰期(37 ℃下半衰期为20 h),能作为长效NO供体型化合物使用[29]。Bonavida等[30]发现,DETA-NONOates通过预防或者逆转抗癌药的耐药性,抑制上皮细胞-间充质细胞转化,并且还能干扰NF-κB/Snail/YY1/RKIP等级联反应。JS-K(图6)是这类化合物的代表,它由美国国立癌症研究所(national cancer institute,NCI)研发,作为NO的前体药,其主要作用机制是和人体内的谷胱甘肽-S-转移酶(GSTs)结合并被其催化生成NO,进而发挥抗肿瘤作用。Heckler等[31]发现JS-K可以诱导神經胶质瘤细胞凋亡。但是这种细胞毒性并未在小鼠移植瘤模型上得到证实,这可能和颅内药物传递不足有关。然而,JS-K的应用受到其对GSTπ的低选择性的阻碍。据了解,JS-K与GSH的反应十分迅速,在GSH存在的情况下,JS-K稳定性较差,从而导致NO的释放不受控制,最终导致不必要的副作用[32]。此外,JS-K确实可以比GST更有效地代谢GST。相反,GST主要存在于许多正常组织中,特别是肝脏[33]。这就意味着JS-K对癌细胞的选择性并不高,甚至会损伤正常细胞。所以,很多科研工作者尝试修饰DETA-NONOates结构来改进这些缺点。Li等[34]通过把α,β-不饱和羰基查尔酮或查尔酮衍生物分别引入2,4-二硝基苯基环的5位,得到一系列02-(2,4-二硝基苯基)二氮杂环戊二酸衍生物。经活性实验验证,这些化合物绝大多数与JS-K相比,都有着更加显著的抗肿瘤细胞增殖活性。其中,化合物1和2(图7)的IC50在1 μM以下。并且,这些化合物的抗HCT-116细胞增殖活性与细胞内NO的释放水平正相关。另外,化合物2还可以逆转MCF-7/ADR细胞的耐药性,使其对阿霉素的IC50耐药率从84.94 μM下降到1.13 μM。
5 新型NO供体纳米粒子
作为一种微型NO供体替代品, NO供体纳米粒子抗癌剂的研发最近引起了广大科研工作者的关注。与传统NO供体药物相比NO供体纳米粒子抗癌剂有其独特优势。首先,与游离体相比,纳米颗粒可以增强NO在纳米体系中的稳定性。其次,由于其高表面积,NO纳米颗粒可以装载大量的NO,并通过提高渗透及潴留(EPR)效应对实体肿瘤进行被动靶向治疗[35]。再者,通过调节光输入、温度、pH和磁场,NO可以直接从纳米材料释放到肿瘤部位。这样一来,NO供体纳米系统能够以持续的方式将高浓度的NO定位到肿瘤部位,而不是循环至其他身体器官,从而避免了全身毒性。Kudo等[36]基于一种新设计的纳米粒子体系,提出了新的NO触发免疫疗法。他们合成了合成了3种PEG多肽嵌段共聚物:PEG-B-P(L-精氨酸)、PEG-B-P(D-ARG)和PEG-B-P(L-赖氨酸-G),并测试了其对iNOS的反应能力。当RAW264.7巨噬细胞与PEG-B-P(L-精氨酸)/M一起孵育时,观察到了NO浓度的显著增加,这一发现与NO细胞的酶促反应实验一致。Zhang等[37]合成了名为NaYbF4的纳米材料,让其与光敏NO供体(Roussin黑盐)结合,构建了一种新型的NO供体平台,这种纳米化合物可以吸收980 nm的近红外光子,将其转换成更高能量的光子,然后将能量转移至NO供体,从而达成NO的有效释放。释放的NO浓度高可以直接杀死肿瘤细胞,低浓度的NO则可以作为一种有效的P-糖蛋白(P-gp)调节剂,与化疗药联用以克服多药耐药性。NO纳米材料系统在使用时应该仔细考虑其利与弊,一些NO-供体纳米粒子系统的成分是十分复杂的,包含一些非生物适应性和非易降解成分,从而降低了纳米材料的重复性或药物性。因此,科研工作者正在研究一个更加完善的NO供体纳米平台。
NO供体纳米颗粒的另一个优良特性是它提供了一种简单易行的方法,将NO-供体和细胞毒性剂结合在一起。例如,一种携带抗肿瘤药物伊利替康和DETA/NO的中空微球(HM)系统被用于治疗肿瘤的多药耐药性(MDR)[38]。在将该系统注射至微酸性的肿瘤组织中时,环境质子渗透进HM的外壳,与封装的DETA/NO反应,产生NO气泡,这样可以增加NO在体内的利用效率。
6 NO供体与抗癌药物杂合体
考虑到NO参与了很多生物学过程,并且NO对于肿瘤细胞有双重作用(抑制作用和促进作用),因此,具有选择性并且有效的将NO传递至肿瘤组织至关重要。所以,“杂合体”策略应运而生,并且“杂合体”已经取得了长足的进展。这个策略的核心理念是利用在正常组织里低表达或不表达而在肿瘤组织中异常表达的酶,生物还原环境,酸性微环境以及低氧等条件,设计一种靶向化合物,该化合物是由NO供体与抗癌药物,抗癌制剂和片段相结合,优先通过癌症靶向连接器,直达肿瘤靶点。
6.1 NO供体与已知的细胞毒性药物杂交
利用NO的抗癌活性的最直接的方法是将NO供体与已知的细胞毒性药物杂交。最早尝试的这类杂合体是将NO供体与核苷类似物杂交设计化合物,但是最近该类杂合体又有了新的发展。Li等[39]以苯砜基呋咱和吉西他滨为原料,通过不同的二醇或醇胺连接物,设计合成了一系列新型杂交化合物,其活性与吉西他滨相当,有些还强于吉西他滨。铂类化合物是化疗药物中最重要的一类[40]。Gou和他的同事研发了NO供体与铂基部分的复合物,以改善其细胞毒性。化合物3对人HCT-116细胞和SGC-7901细胞具有很高毒性[41]。这类杂交化合物还包括NO/他米巴罗汀[42],NO/沙利度胺[43]和NO/阿比特龙[44]等。化合物3-6结构式见图8。
6.2 NO供体与酶抑制剂杂交
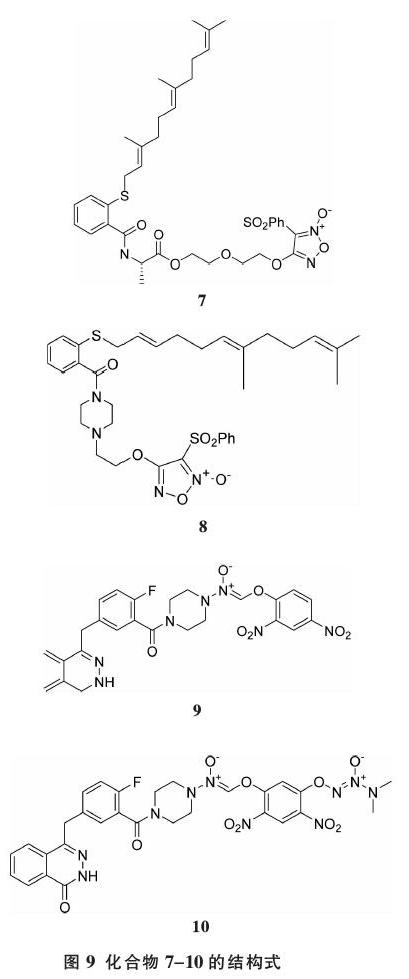
酶抑制剂是一类重要的抗癌药物,它可以通过阻断酶来调节肿瘤相关的信号。当NO供体与酶抑制剂相结合,其母体分子的抗癌能力和靶点容量增强。并且,NO本身可以通过S-修饰作为某些酶的抑制剂。法呢基硫代水杨酸(FTS)作为一种RAS蛋白拮抗剂发挥抑制肿瘤细胞增殖的作用。Ling等[45-46]合成了FTS/呋咱杂合体并检测了其抗肝癌的活性,其中化合物7和8(图9)可以显著抑制人肝癌细胞(HCC)的增殖,且优于FTS和呋咱部分,提示其高水平的NO和Ras参与的信号的抑制作用可以产生协同抗癌效应。Maciag等[47]将O2-arylated diazenni-umdiolate与奥拉帕尼结合得到化合物9和10(图9),解决了PARP-1的靶向抑制剂的传递问题。GST-π在多个肿瘤细胞系过度表达,当其被激活时,杂交分子中的NO和PARP-1抑制剂也随之产生,这种结合解决了其传递问题。而后,其异种移植瘤模型已经证实化合物9和10在体内具有抗癌作用,并且未观察到明显的毒副作用。
6.3 NO供體与活性天然产物杂交
天然产物是抗癌先导化合物的重要来源。Xu等通过将二氮杂二烯类化合物与冬凌草甲素及其半合成物类似物偶联,合成了一系列NO供体型冬凌草甲素衍生物并测试其在体外抗肿瘤活性,发现这些化合物都具有较强的抗肿瘤细胞增殖活性,其IC50值在1.84与17.01 μM之间。此外观察到在大多数情况下,这些化合物的抗肿瘤活性与NO的释放量相关,更有趣的是最强的化合物11(图10)在Bel-7402细胞中阻滞S期的细胞周期,这与母体化合物冬凌草甲素不同[48]。Na等[49]人将白花丹素与呋咱类NO供体结合合成杂合体化合物,该杂合体与母体化合物相比,有更加优越的抗癌活性,其对MDA-MB-231细胞系,HepG2细胞系以及A549细胞系均有一定的抑制活性,其中MDA-MB-231对该类杂合体化合物最敏感,其IC50值范围从1.24 μM到5.20 μM。此外,对该一系列化合物进行NO释放检测,在大多数情况下,其抗肿瘤细胞增殖活性与MDA-MB-231细胞内NO的释放水平成正相关。其中,化合物12(图10)的活性最好,并且其在不同PH值(6.0、7.4和8.0)的稳定性高于白花丹素。Chen等[50]合成了一系列NO/小檗碱杂合体,并初步测定了其抗肝癌活性。大多数化合物对HepG2细胞表现出比亲本化合物小檗碱和巴马汀更有效的活性。其中,化合物13(图10)的活性最强,其对HepG2细胞的IC50为1.36 μM。此外,化合物13具有广谱的抗癌功效,对HepG2、SMMC-7721、HCT-116、HL-60均有抑制作用,对正常肝细胞(LO-2)没有毒性,显示其良好的选择性。
7 结语
基于NO供体的治疗主要包括iNOS基因治疗和NO单独与抗癌药物/片段组合或杂交制备NO供体型药物的药物治疗。iNOS基因治疗可以提高癌症的治疗效果,但在取得突破性进展之前,必须克服两大障碍。一个是用于基因治疗的病毒载体,另一个是iNOS转染物的早期死亡[51-52]。然而,NO供体单独或与抗癌药物/片段组合或杂交制备的药物可以诱导多种抗肿瘤活性,包括诱导肿瘤细胞凋亡,提高放疗、化疗和免疫治疗的敏感性,抑制细胞转移,肿瘤微血管形成以及肿瘤低氧环境。因此,这些治疗方法的应用有着光明的前景。将来,发现和研究新一代的NO供体药物,需要在癌症部位释放适当水平的NO以期达到治疗效果,从而打破癌细胞的存活率,诱导癌细胞死亡,这是一个尚待解决的医学问题,这种以NO供体为研究方向的癌症研究策略会在临床上有着光明的前景。
参考文献
[1] TALADRIZ-BLANCO P, P REZ-JUSTE J, KANDOTH N, et al. Layer-by-layer assembled gold nanoparticles with a tunable payload of a nitric oxide photocage[J]. Journal of Colloid and Interface Science, 2013, 407(10): 524-528.
[2] FORSTERMANN U, XIA N, LI H. Roles of Vascular Oxidative Stress and Nitric Oxide in the Pathogenesis of Atherosclerosis[J]. Circulation Research, 2017, 120(4): 713-735.
[3] HANNIBAL L. Nitric Oxide Homeostasis in Neurodegenerative Diseases[J]. Current Alzheimer Research, 2016, 13(2): 135-149.
[4] FIONDA C, ABRUZZESE M P, SANTONI A, et al. Immunoregulatory and Effector Activities of Nitric Oxide and Reactive Nitrogen Species in Cancer[J]. Current Medicinal Chemistry, 2016, 23(24): 2618-2636.
[5] MANKE A, LUANPITPONG S, WANG L, et al. Chapter 11– Role of Nitric Oxide in Cancer Stem Cell Regulation and Metastasis[J]. Nitric Oxide in Chemosensitizing, 2017: 179-189.
[6] JHA T, SAHA A, ADHIKARI N, et al. Nitric Oxide Synthase (NOS) Inhibitors in Cancer Angiogenesis[J]. Current Enzyme Inhibition, 2016, 12(1): 49-66.
[7] GARRIDO P, SHALABY A, WALSH E M, et al. Impact of inducible nitric oxide synthase (iNOS) expression on triple negative breast cancer outcome and activation of EGFR and ERK signaling pathways[J]. Oncotarget, 2017, 8(46): 80568-80588.
[8] BURKE A J, SULLIVAN F J, GILES F J, et al. The yin and yang of nitric oxide in cancer progression[J]. Carcinogenesis, 2013, 34(3): 503-512.
[9] HO Y S, WANG Y J, LIN J K. Induction of p53 and p21/WAF1/CIP1 expression by nitric oxide and their association with apoptosis in human cancer cells[J]. Molecular Carcinogenesis, 2015, 16(1): 20-31.
[10] TAN G, QIU M, CHEN L, et al. JS-K, a nitric oxide pro-drug, regulates growth and apoptosis through the ubiquitin-proteasome pathway in prostate cancer cells[J]. Bmc Cancer, 2017,17(1):376.
[11] ZHANG Y Z, ZHANG Y Z, WANG C F, et al. Cucurbitacin D impedes gastric cancer cell survival via activation of the iNOS/NO and inhibition of the Akt signalling pathway[J]. Oncology Reports, 2018, 39(6): 2595-2603.
[12] BONAVIDA B, KHINECHE S, HUERTA-YEPEZ S, et al. Therapeutic potential of nitric oxide in cancer[J]. Drug Resistance Updates, 2006, 9(3): 157-173.
[13] HUERTA S. Nitric oxide for cancer therapy[J]. Future Science Oa, 2015, 1(1): 1-9.
[14] MUNTAN J, BONAVIDA B. Special collection: Nitric oxide in cancer[J]. Redox Biology, 2015, 6(12):505-506.
[15] HUANG Z, FU J, ZHANG Y. Nitric Oxide Donor-Based Cancer Therapy: Advances and Prospect[J]. Journal of Medicinal Chemistry, 2017,60(18): 7617-7635.
[16] YASUDA H. Solid tumor physiology and hypoxia-induced chemo/radio-resistance: Novel strategy for cancer therapy: Nitric oxide donor as a therapeutic enhancer[J]. Nitric Oxide, 2008,19(2):205-216.
[17] NING S, BEDNARSKI M, ORONSKY B, et al. Novel nitric oxide generating compound glycidyl nitrate enhances the therapeutic efficacy of chemotherapy and radiotherapy[J]. Biochemical & Biophysical Research Communications, 2014, 447(3): 537-542.
[18] WANG X, DIAO Y, LIU Y, et al. Synergistic apoptosis-inducing effect of aspirin and isosorbide mononitrate on human colon cancer cells[J]. Molecular Medicine Reports, 2015, 12(3): 4750.
[19] HUERTA S, CHILKA S, BONAVIDA B. Nitric oxide donors: novel cancer therapeutics (review)[J]. International Journal of Oncology, 2008, 33(5): 909-927.
[20] YANG L, LAN C, FANG Y, et al. Sodium nitroprusside (SNP) sensitizes human gastric cancer cells to TRAIL-induced apoptosis[J]. International Immunopharmacology, 2013,17(2):383-389.
[21] CICCONE V, MONTI M, MONZANI E, et al. The metal-nonoate Ni(SalPipNONO) inhibits in vitro tumor growth, invasiveness and angiogenesis[J]. Oncotarget, 2018, 9(17): 13353-13365.
[22] MAROTO-D AZ M, ELIE B T, G MEZ-SAL P, et al. Synthesis and anticancer activity of carbosilane metallodendrimers based on arene ruthenium(ii) complexes[J]. Dalton Transactions, 2016, 45(16): 7049-7066.
[23] 李泽民,李文赟,凌 静,等.氧化呋咱类一氧化氮供体药物研究进展[J].中国抗生素杂志,2016,41(11):801-809.
[24] MEDANA C, ERMONDI G, FRUTTERO R, et al. Furoxans as nitric oxide donors. 4-Phenyl-3-furoxancarbonitrile: thiol-mediated nitric oxide release and biological evaluation[J]. Journal of Medicinal Chemistry, 1994, 37(25): 4412.
[25] RIGANTI C, MIRAGLIA E, VIARISIO D, et al. Nitric oxide reverts the resistance to doxorubicin in human colon cancer cells by inhibiting the drug efflux[J]. Cancer Research,2005,65(2): 516-525.
[26] TANG X, GU X, AI H, et al. doxorubicin, Pgp[J]. Bioorganic & Medicinal Chemistry Letters, 2011, 22(2): 801-805.
[27] FARIAS C F, MASSAOKA M H, GIROLA N, et al. Benzofuroxan derivatives N-Br and N-I induce intrinsic apoptosis in melanoma cells by regulating AKT/BIM signaling and display anti metastatic activity in vivo[J]. BMC Cancer, 2015,15(1):807.
[28] AI Y, KANG F, HUANG Z, et al. Synthesis of CDDO-Amino Acid-Nitric Oxide Donor Trihybrids as Potential Antitumor Agents against Both Drug-Sensitive and Drug-Resistant Colon Cancer[J]. Journal of Medicinal Chemistry, 2015, 58(5): 2452-2464.
[29] 張彩霞,刘阳云.一氧化氮供体型化合物化疗增敏效应[J].国际肿瘤学杂志,2016,43(9):684-687.
[30] HUERTA S, GAO X, BONAVIDA B. DETANONOate Is a Potent Chemo\ Radio-Sensitizing Agent in Colon and Colorectal Cancers as Assessed in In Vitro and In Vivo Established Tumor Xenografts[J]. Forum on Immunopathological Diseases & Therapeutics, 2015,1(4): 281-295.
[31] HECKLER M, OSTERBERG N, GUENZLE J, et al. The nitric oxide donor JS-K sensitizes U87 glioma cells to repetitive irradiation[J]. Tumour Biology the Journal of the International Society for Oncodevelopmental Biology & Medicine, 2017,39(6):1-11.
[32] LIU Z, YANG Z, XU S, et al. Preliminary safety studies on nitric oxide donors JS-K[J]. Journal of Zunyi Medical University, 2016, 39(5):464-469.
[33] SCHULTZ M, DUTTA S, TEW K D. Inhibitors of glutathione S-transferases as therapeutic agents[J]. Advanced Drug Delivery Reviews, 1997,26(2-3): 91-104.
[34] LI Q, ZOU P, SUN J, et al. O2-(2,4-dinitrophenyl)diazeniumdiolates derivatives: Design, synthesis, cytotoxic evaluation and reversing MDR in MCF-7/ADR cells[J]. European Journal of Medicinal Chemistry, 2018,143:732-744.
[35] SEABRA A B, LIMA R, CALDER N M. Nitric Oxide Releasing Nanomaterials for Cancer Treatment: Current Status and Perspectives[J]. Current Topics in Medicinal Chemistry, 2015, 15(4): 298-308.
[36] KUDO S, NAGASAKI Y. A novel nitric oxide-based anticancer therapeutics by macrophage-targeted poly(l-arginine)-basednanoparticles[J]. Journal of Controlled Release, 2015, 217(11):256-262.
[37] ZHANG X, TIAN G, YIN W, et al. Controllable Generation of Nitric Oxide by Near-Infrared-Sensitized Upconversion Nanoparticles for Tumor Therapy[J]. Advanced Functional Materials, 2015,25(20): 3049-3056.
[38] CHUNG M F, LIU H Y, LIN K J, et al. A pH-Responsive Carrier System that Generates NO Bubbles to Trigger Drug Release and Reverse P-Glycoprotein-Mediated Multidrug Resistance[J]. Angewandte Chemie International Edition, 2015, 54(34): 9890-9893.
[39] LI X, WANG X, XU C, et al. Synthesis and biological evaluation of nitric oxide-releasing hybrids from gemcitabine and phenylsulfonyl furoxans as anti-tumor agents[J]. Medchemcommun, 2015, 6(6): 1130-1136.
[40] ZHAO J, GOU S, SUN Y, et al. Nitric oxide donor-based platinum complexes as potential anticancer agents[J]. Chemistry, 2015, 18(45): 14276-14281.
[41] ZHAO J, GOU S, SUN Y, et al. Antitumor platinum(II) complexes containing platinum-based moieties of present platinum drugs and furoxan groups as nitric oxide donors: synthesis, DNA interaction, and cytotoxicity[J]. Inorganic Chemistry, 2012, 51(19): 10317-10324.
[42] BIAN H, FENG J, LI M, et al. Novel antileukemic agents derived from tamibarotene and nitric oxide donors[J]. Bioorganic & Medicinal Chemistry Letters, 2012, 43(12): 7025-7029.
[43] WANG T, ZHANG Y H, KONG X W, et al. Synthesis and biological evaluation of nitric oxide-donating thalidomide analogues as anticancer agents[J]. Chemistry & Biodiversity, 2009,6(4):466.
[44] NORTCLIFFE A, FLEMING I N, BOTTING N P, et al. Synthesis and anticancer properties of RGD peptides conjugated to nitric oxide releasing functional groups and abiraterone[J]. Tetrahedron, 2014, 70(44): 8343-8347.
[45] LING Y, YE X, ZHANG Z, et al. Novel Nitric Oxide-Releasing Derivatives of Farnesylthiosalicylic Acid: Synthesis and Evaluation of Antihepatocellular Carcinoma Activity[J]. Journal of Medicinal Chemistry, 2011, 54(9): 3251-3259.
[46] LING Y, YE X, JI H, et al. Synthesis and evaluation of nitric oxide-releasing derivatives of farnesylthiosalicylic acid as anti-tumor agents[J]. Bioorganic & Medicinal Chemistry, 2010, 18(10): 3448.
[47] MACIAG A E, HOLLAND R J, KIM Y, et al. Nitric Oxide (NO) ReleasingPoly ADP-ribose Polymerase1 (PARP-1) Inhibitors Targeted to Glutathione S-TransferaseP1-Overexpressing Cancer Cells[J]. Journal of Medicinal Chemistry, 2014,57(6): 2292-2302.
[48] XU S, WANG G, YAN L, et al. Novel anticancer oridonin derivatives possessing a diazen-1-ium-1,2-diolate nitric oxide donor moiety: Design, synthesis, biological evaluation and nitric oxide release studies[J]. Bioorganic & Medicinal Chemistry Letters, 2016, 26(12): 2795-2800.
[49] NA B, OU J, XU M, et al. Novel NO-releasing plumbagin derivatives: Design, synthesis and evaluation of antiproliferative activity[J]. European Journal of Medicinal Chemistry, 2017,137(9):88-95.
[50] CHEN J, WANG T, XU S, et al. Design, synthesis and biological evaluation of novel nitric oxide-donating protoberberine derivatives as antitumor agents[J]. European Journal of Medicinal Chemistry, 2017, 132(5):173-183.
[51] LEHRMAN S. Virus treatment questioned after gene therapy death[J]. Nature, 1999, 401(6753): 517-518.
[52] MOCELLIN S, BRONTE V, NITTI D. Nitric oxide, a double edged sword in cancer biology: Searching for therapeutic opportunities[J]. Medicinal Research Reviews, 2007,27(3):317-352.
