泽泻汤加味方通过AT1R通路抑制高盐和AngII诱导HBZY-1中NOX4表达的研究
2019-08-13刘凯赵娟刘玉玲崔海鹏董雅洁卢锴锋孙晓旭王途张树峰
刘凯 赵娟 刘玉玲 崔海鹏 董雅洁 卢锴锋 孙晓旭 王途 张树峰
〔摘要〕 目的 探討泽泻汤加味方通过AT1R通路抑制高盐和AngⅡ诱导的肾小球系膜细胞(HBZY-1)中NOX4表达并初探其作用机制。方法 将HBZY-1细胞随机分为正常组,高盐和AngII诱导模型组,缬沙坦组,泽泻汤加味方中药高、中、低剂量组。造模结束后,缬沙坦组采用缬沙坦(1 μmol/L)刺激,中药组分别用泽泻汤加味方中药高(2 mg/L)、中(1 mg/L)、低(0.5 mg/L)剂量组刺激,正常组正常培养。24 h后收集样本,RT-qPCR方法检测细胞中AT1R、NOX4的mRNA表达水平,MTT法测定细胞活性,Western blot方法检测细胞中AT1R、NOX4的蛋白质表达水平,采用AT1R抑制剂验证中药下调NOX4具体作用通路。结果 与正常组比较,各给药组细胞生长受到明显抑制,RT-qPCR及Western blot结果显示,AT1R、NOX4的mRNA与蛋白表达水平显著降低(P<0.05),中药组与AT1R抑制剂组NOX4表达均下调。结论 泽泻汤加味方可通过下调AT1R、NOX4 mRNA及AT1R、NOX4蛋白水平来保护盐敏感性高血压肾损伤,进而达到延缓肾纤维化的作用,具体作用机制是通过抑制AT1R信号通路进而下调NOX4蛋白表达水平。
〔关键词〕 盐敏感性高血压;肾纤维化;泽泻汤;血管紧张素Ⅱ;AT1R通路;NOX4
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2019.05.006
〔Abstract〕 Objective To investigate the inhibitory effects of modified Zexie Decoction on NOX4 expression in glomerular mesangial cells (HBZY-1) induced by high salt and AngII through AT1R pathway and to explore its mechanism. Methods HBZY-1 was randomly divided into a normal group, a high salt and AngII induced model group, a Valsartan group, a Zexie Decoction modified Chinese herbal medicine high, medium and low dose group. After modeling, the Valsartan group was stimulated by Valsartan (1 1 μmol/L), and the administration group was stimulated by Zexie Decoction with high (2 mg/L), medium (1 mg/L) and low (0.5 mg/L) doses of traditional Chinese medicine respectively. The normal group was cultured normally. After 24 hours, samples were collected. The mRNA expression of AT1R and NOX4 in cells were detected by RT-q PCR, and cell viability was measured by MTT. The protein expression levels of AT1R and NOX4 were detected by Western blot, and specific pathways of NOX4 down-regulation were verified by AT1R inhibitors. Results Compared with the normal group, the growth of cells in each group was inhibited significantly. RT-qPCR and western blot showed that the mRNA expression and the protein expression of AT1R and NOX4 were significantly decreased (P<0.05), while the expression of NOX4 was down-regulated in both Chinese herbal medicine and AT1R inhibited group. Conclusion Modified Zexie Decoction can protect salt-sensitive hypertensive kidney injury by down-regulating AT1R, NOX4, mRNA, AT1R, NOX4 protein levels, and then delay renal fibrosis. The specific mechanism is to down-regulate NOX4 protein expression by inhibiting AT1R signaling pathway.
〔Keywords〕 salt-sensitive hypertension; renal fibrosis; Zexie Decoction; angiotension Ⅱ; ATIR pathway; NOX4
由于饮食结构变化,盐敏感性高血压已成为当下最常见的继发性高血压,严重威胁人类健康[1]。研究表明[2-4],肾素-血管紧张素-醛固酮系统(renin angiotensin aldosterone system, RAAS)相关的信号通路转导分子(AngII-NADPH-ROS信号通路)异常被认为是盐敏感性高血压发生的重要机制之一。越来越多的研究表明[5],中医药治疗盐敏感性高血压,具有独特优势。本项目前期研究证实,泽泻汤加味方在临床治疗盐敏感性高血压效果明显[6],体内实验证明,泽泻汤加味方对高盐高血压大鼠肾脏有明显的保护作用[7-8]。尽管如此,仍缺少运用科学系统的实验方法对泽泻汤加味方治疗盐敏感性高血压作用及其详细作用机制展开研究。本研究以高盐和AngII诱导肾小球系膜细胞模型作为研究对象,初步研究了泽泻汤加味方对RAAS相关信号通路AngII-NADPH-ROS的影响,为临床进一步将泽泻汤加味方研发成有效、安全的新型降压药物提供可靠的实验依据与理论基础。
1 材料与方法
1.1 药物
泽泻汤加味方组成:泽泻21 g(批号0171422112),白术9 g(批号160180101),泽兰15 g(批号512150401),石菖蒲15 g(批号170630);泽泻汤加味方制备工艺:按比例配备,加8倍体积蒸馏水浸泡4 h,煎煮1 h,过滤取滤液,药渣中再加6倍体积蒸馏水,煎煮1 h,过滤取滤液,将2次滤液合并,浓缩制成5 mg/mL水煎剂,保存于-20 ℃冰箱中备用;缬沙坦胶囊(北京诺华制药有限公司,批号X0796)。
1.2 细胞
大鼠肾小球系膜细胞株:HBZY-1(购自武汉大学中国典型培养物保藏中心,编号:BNCC341790)。
1.3 试剂
DMEM-H培养基(美国Hyclone公司);胎牛血清(美国Sigma公司);Trizol裂解液(R0016)、RIPA裂解液(P0013B)、Bradford蛋白浓度测定试剂盒(P0006)、超敏ECL化学发光试剂盒(P0018S)均购于碧云天生物技术有限公司;TIANScript cDNA第一链合成试剂盒(KR104)、SuperReal PreMix SYBR Green(FP204)均购于天根生化科技有限公司;兔抗大鼠AT1R(ab18801)、NOX4(ab129068)均購于Abcam公司;兔抗大鼠β-actin抗体、HRP标记山羊抗兔、兔抗小鼠二抗均购于Bioworlde公司。PCR引物由大连宝生物工程有限公司合成,引物序列见表1。
1.4 主要仪器
T100 RT-qPCR仪、Mini-PROTEAN Tetra小型垂直电泳仪、半干转膜仪均购自美国Bio-Rad公司。
1.5 方法
1.5.1 体外实验蛋白样本收集 将HBZY-1细胞放入加有10%胎牛血清、1%青链霉素的MEM-H培养基中,置于37 ℃、5%CO2孵箱中培养。待细胞长至培养皿85%开始传代,取5~9代对数生长期的细胞接种于6孔板内继续培养,采用NaCl 137 mmol/L和AngⅡ 1×10-6 mmol/L刺激大鼠肾小球系膜细胞24 h诱导高盐细胞模型,正常组正常培养。随后将细胞分为正常组,模型组,缬沙坦(1 μmol/L)组,中药高、中、低剂量组,中药剂量由高到低分别为2、1、0.5 mg/L,药物干预24 h后,收集细胞,分别提取总RNA及蛋白质,以备后续实验。
1.5.2 细胞增殖抑制实验 采用MTT法,取对数增长期的细胞均匀接种于96孔板内,每孔密度大约为1×105个/mL,每组设5个复孔,待细胞贴壁后加入含NaCl 137 mmol/L和AngⅡ 1×10-6 mmol/L培养基继续培养24 h。实验分为正常组,模型组,泽泻汤加味方组,浓度由低到高分别为:0.2、0.5、1、2、3、5 mg/L,置于37 ℃、5%CO2培养箱培养24 h,每孔加入10 μL的5 g/L的MTT液,置于培养箱内孵育4 h,于酶标仪460 nm波长处测各孔OD值。计算公式如下:
存活率=(泽泻汤加味方组OD值-空白对照组OD值)/(模型组OD值-空白对照组OD值)×100%
1.5.3 RT-qPCR法检测mRNA的表达 Trizol法提取各组细胞总RNA,紫外分光光度计进行定量,TIANScript cDNA第一链合成试剂盒合成cDNA,SuperReal PreMix SYBR Green荧光定量检测试剂盒分别检测NOX4、β-actin mRNA的ct值,扩增条件:94 ℃ 5 min;94 ℃ 30 s,60 ℃ 34 s,40个循环;做溶解曲线。以各目的基因ct值与β-actin mRNA的ct值的差值为△ct,采用2-△△ct法计算各基因mRNA的相对表达水平。
1.5.4 Western blot法检测蛋白质的表达 采用RIPA裂解液处理提取各组细胞的总蛋白,Bradford蛋白浓度测定试剂盒蛋白定量。45 μg蛋白于SDS-PAGE 12%分离胶分离并转膜,常温封闭1 h,NOX4(1∶5000)、β-actin(1∶10 000)一抗4 ℃孵育过夜,洗膜后,加入HRP标记山羊抗兔二抗、兔抗小鼠二抗(1∶5 000),常温孵育2 h,洗膜后用超敏ECL化学发光试剂盒显影。各蛋白目的条带灰度值与β-actin条带灰度值的比值作为各蛋白质的相对表达水平。
1.5.5 抑制剂对于对各组细胞AT1R、NOX4蛋白表达的影响 在分析细胞抑制率结果实验中我们得出了中药最佳抑制浓度,为进一步探究泽泻汤是否通过AT1R通路抑制高盐和AngⅡ诱导的HBZY-1中NOX4的蛋白表达,我们设计了AT1R抑制剂组,通过中药组与抑制剂组中NOX4蛋白表达来验证中药泽泻汤加味方治疗高血压具体作用机制。
1.6 统计学分析方法
用SPSS 21.0统计软件进行分析。数据均采用“x±s”表示,组间两两比较采用LDS-t法。以P<0.05为差异具有统计学意义。
2 结果
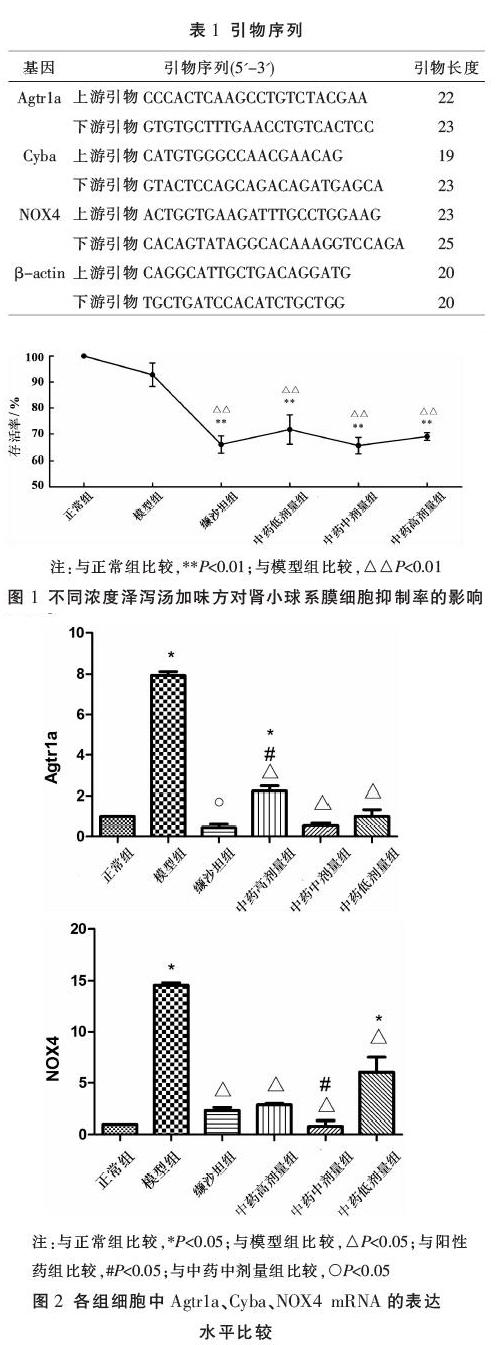
2.1 泽泻汤加味方对盐敏感性高血压细胞抑制率的影响
检测结果发现,与正常相比,各实验组细胞增殖均受到抑制,其中缬沙坦组与各给药组与正常组相比均具有显著性差异(P<0.01),模型组虽受抑制但差异不明显。与模型组相比,缬沙坦组及各给药组细胞增殖抑制作用明显,其中尤以泽泻汤中剂量组抑制作用最为明显(P<0.01),已趋近于阳性药组,正常组与模型组相比无显著性差异,具体结果见图1。
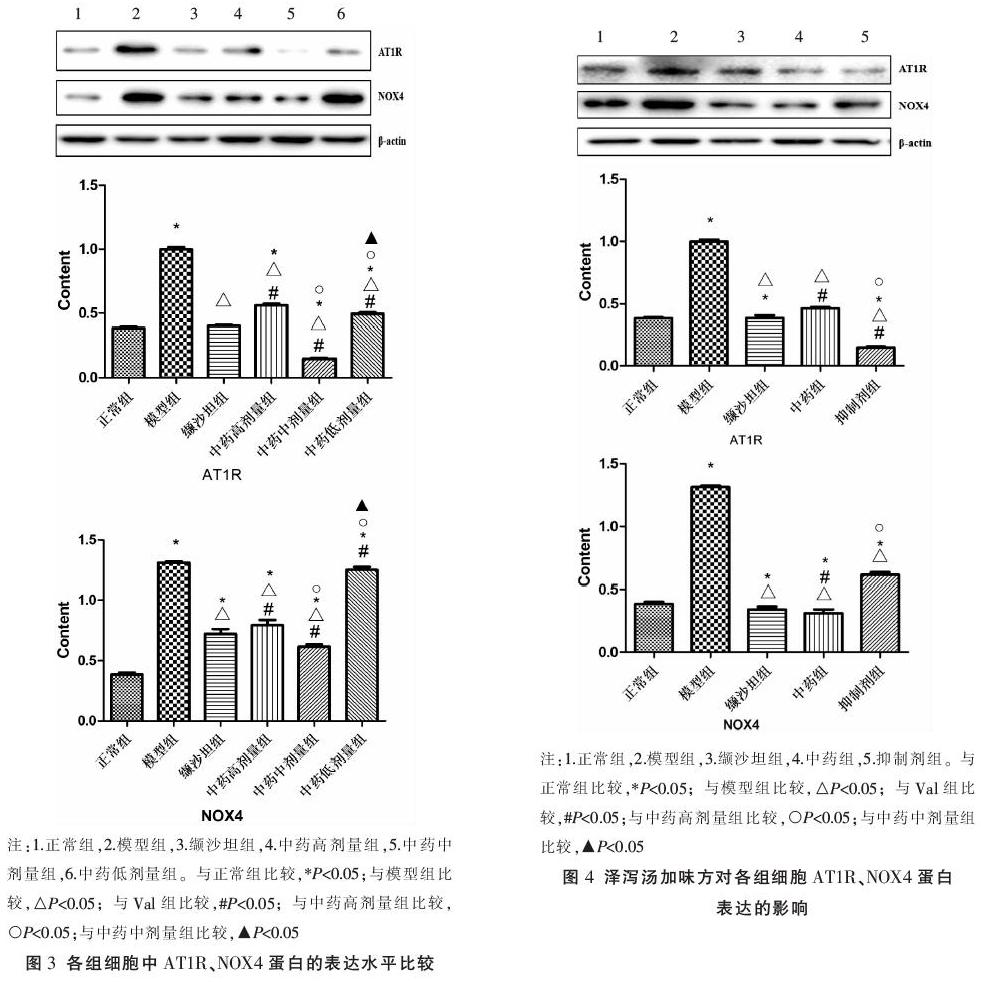
2.2 泽泻汤加味方对各组细胞AT1R、NOX4 mRNA表达的影响
RT-qPCR结果显示,与正常组比较,模型组、中药高剂量组细胞中AT1R的mRNA表达水平显著升高(P<0.05),模型组、中药低组细胞中NOX4的mRNA表达水平显著升高(P<0.05)。与模型组比较,缬沙坦组及中药高、中、低组AT1R、NOX4的mRNA表达水平显著降低(P<0.05)。各给药组中,中药中剂量组AT1R、NOX4的mRNA表达水平最接近正常组水平,组间无显著性差异(P>0.05)。与缬沙坦组比较,中药高剂量组AT1R的mRNA及中药中剂量组NOX4的mRNA表达水平显著升高(P<0.05),结果见图2。
2.3 泽泻汤加味方对各组细胞AT1R、NOX4蛋白表达的影响
Western blot结果显示,与正常组比较,模型组细胞中AT1R、NOX4蛋白表达水平显著升高(P<0.05)。与模型组比较,缬沙坦组及中药中剂量组AT1R、NOX4蛋白表达水平显著降低(P<0.05)。与缬沙坦组比较,中药高、低剂量组AT1R、NOX4蛋白表达水平显著升高(P<0.05),中药中剂量组AT1R、NOX4蛋白表达水平显著降低(P<0.05)。各剂量给药组中,中药中剂量组对AngII-NADPH-ROS信号通路的下调作用最为明显,所得结果与RT-qPCR结果一致,见图3。
2.4 抑制剂对各组细胞AT1R、NOX4蛋白表达的影响
AT1R抑制组与泽泻汤中剂量中NOX4表达明显降低(P<0.05),提示泽泻汤可通过AT1R通路抑制高盐和AngⅡ诱导的HBZY-1中NOX4的蛋白表达,其余各组相比无显著性差异。见图4。
3 讨论
原发性高血压是一种多基因遗传和多种环境相互作用的结果[9],在基因和环境共同作用下,我国高血压患者已达到2亿人[10]。盐作为高血压发病的主要因素之一,以往流行病学的研究和大量临床试验都证明食盐的摄入量与高血压的发病有着密切联系[11]。20世纪70年代Kawasaki和Luft先后提出了盐敏感性高血压概念,针对高盐与高血压的发生发展关系及其机制研究进入到新的阶段[12-13]。
当前,对于盐敏感性高血压的发病机制的研究主要集中在以下几个方面:遗传机制、离子转运机制、交感神经机制以及(RAAS)机制,其中,RAAS相关的信号通路转导分子(AngⅡ-NADPH-ROS信号通路)异常被认为是盐敏感性高血压发生的重要机制之一[14-15]。研究表明[16],血管紧张素Ⅱ(angiotensionⅡ,AngⅡ)是RAAS中最重要的效应因子。正常情况下,AngⅡ通过与其受体AT1R结合,使交感神经末梢释放递质增多来维持体液稳态,起到调节血压作用。然而在各种致病因素的损害下,这种体液稳态被破坏,则可导致盐敏感性高血压的发生[17-18]。研究发现,RAAS激活不仅在心脏纤维化中扮演重要角色,而且可能在高血压的发病中发挥重要作用[19]。AngⅡ是RAAS的主要效应成分,通过与肾脏细胞AT1R结合产生一系列联机反应,共同诱导高血压患者肾纤维化的发生。还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶(NOX)是一种有多中蛋白质亚基组成的复合体,现已证实NOX介导的氧化应激反应与器官纤维化的发生密切相关,而NOX的亚基NOX4在其中发挥了至关重要中的作用[20]。本研究以肾小球系膜细胞为研究对象,以高盐和AngⅡ诱导高血压细胞模型,从RAAS负反馈调节异常变化着手,试图从体外实验探究中药泽泻汤与盐敏感性高血压发病过程中典型蛋白NOX4的关系并初步探讨其作用机制。
目前临床上应用降压药物种类繁多,但大多数只能缓解高血压的症状,较少针对盐敏感性高血压病因治疗,且作用靶点单一、持久性差,使患者终身用药。缬沙坦可阻断AngⅡ与其受体AT1R结合而治疗盐敏感性高血压。但长期服用缬沙坦等药物,患者会出现头痛、头晕、病毒感染、上呼吸道感染、咳嗽、腹泻、疲劳、鼻炎、背痛、恶心、咽炎及關节痛等副作用,对患者机体造成新的损害。鉴于中药泽泻汤加味方在治疗盐敏感性高血压方面的独特优势,本研究力图找到能够替代传统药物缬沙坦且毒副作用较小的有效治疗盐敏感性高血压药物。泽泻汤加味方由汉·张仲景《金匮要略》泽泻汤加泽兰、石菖蒲组成,具有利水泄浊、健脾化痰、活血化瘀之功效。本项目前期研究证实,该方在临床治疗盐敏感性高血压效果明显,但缺少运用科学实验方法对该方治疗盐敏感性高血压作用及机制的实验研究[21-22],所以在下一步实验研究中,应把重点放在细胞模型复制的标准以及引入合理蛋白抑制剂,将细胞实验与基因敲除动物实验相结合共同验证实验结论。
本研究结果显示,应用高盐与AngⅡ诱导的模型组细胞出现明显增殖,这可能与肾小球系膜细胞过度增殖引起肾纤维化有关,缬沙坦组与各给药组能明显降低HBZY-1的增殖,其中以泽泻汤中剂量组最为明显。RT-qPCR与Western blot结果显示,模型组中AT1R与NOX4 mRNA与蛋白水平均出现上调,提示模型组可通过上调AT1R与NOX4的水平进而与AngⅡ发生联机反应共同引发盐敏感性高血压的肾纤维化。实验结果证实,给予中加家味方泽泻汤后,各剂量组AT1R与NOX4的水平均出现明显下调,由此我们可以推测泽泻汤加味方可以有效抑制盐敏感性高血压患者肾纤维化的发生。除此之外,为了确实泽泻汤是否通过AT1R通路调控NOX4蛋白表达,我们采用AT1R抑制剂缬沙坦和泽泻汤中剂量组预先处理细胞24 h,再用高盐和Ang Ⅱ诱导HBZY-1细胞,图4结果亦证实了我们的猜想。
综上所述,泽泻汤加味方可以有效抑制盐敏感性高血压患者HBZY-1细胞的过度增殖而引发的肾纤维化,盐敏感性高血压患者肾纤维化主要与AT1R及NOX4蛋白上调有关,泽泻汤加味方可以通过抑制AT1R信号通路进而下调NOX4蛋白水平进而起到延缓或减轻盐敏感性高血压患者肾脏功能下降的效果。NOX4基因是如何保护肾小球系膜细胞功能尚待进一步研究。
参考文献
[1] MARQUES F Z, NELSON E M, CHU P Y, et al. High fibre diet and acetate supplementation change the gut microbiota and prevent the development of hypertension and heart failure in DOCA-Salt hypertensive mice[J]. Circulation, 2016, 135(10):964-977.
[2] 王礼琳,范 洁,张 进,等.经导管去肾脏交感神经术对顽固性高血压患者肾素血管紧张素系统活性的影响[J].中国处方药,2018,16(7):126-127.
[3] LUEDER T G V, KRUM H. RAAS inhibitors and cardiovascular protection in large scale trials[J]. Cardiovascular Drugs and Therapy, 2013, 27(2):171-179.
[4] PRAJAPATI H, MCCALLUM A, FINLAY E. Hypertension, secondary to a renal artery aneurysm, treated by ex vivo aneurysm repair and autotrans plantation[J]. BMJ Case Rep, 2012,19(6):73-62.
[5] 刘 妍,王瑞雪,张树峰.中医药治疗盐敏感性高血压的现状及进展[J].中国煤炭工业医学杂志,2017,20(2):240-243.
[6] 范洪亮,张树峰,张连和,等.泽泻汤加味方治疗高血压80例降压效果临床观察.中国医药导刊,2011,13(1):74-76.
[7] 陈景彦,范洪亮,张树峰,等.泽泻汤加味方对高盐致高血压大鼠肾损害的预防作用[J].中医杂志,2012,53(3):234-237.
[8] 陈景彦,陈炳宏,张树峰,等.泽泻汤加味方对高盐高血压大鼠的降压疗效及对肾功能的保护作用[J].中国老年学杂志,2012,32(24):5467-5469.
[9] SINGH M, SINGH A K, PANDEY P, et al. Molecular genetics of essential hypertension.[J]. Clinical & Experimental Hypertension, 2016, 38(3):268-277.
[10] LI G, YONG Y, RUI B. Mitochondrial DNA mutation m.5512A>G in the acceptor-stem of mitochondrial tRNA Trp, causing maternally inherited essential hypertension[J]. Biochem Biophys Res Commun, 2016, 479(4):800-807.
[11] LI Q, CUI Y, JIN R, et al. Enjoyment of spicy flavor enhances central salty-taste perception and reduces salt intake and blood pressure[J]. Hypertension, 2017:HYPERTENSIONAHA.117.09950.
[12] KJELDSEN S E, NARKIEWICZ K, BURNIER M, et al. The INTERSALT study and the complex relationship between salt intake and blood pressure[J]. Blood Pressure, 2017, 26(2):65-66.
[13] GUO C P, WEI Z, HUANG F, et al. High salt induced hypertension leads to cognitive defect[J]. Oncotarget, 2017,8(56):95780-95790.
[14] 王 麗,卢成志,张 欣,等.经皮肾脏交感神经射频消融术对顽固性高血压患者肾素血管紧张系统的影响[J].中华高血压杂志,2013,21(5):5-7.
[15] PRAJAPATI H, MCCALLUM A, FINLAY E. Hypertension, secondary to a renal artery aneurysm, treated by ex vivo aneurysm repair and autotrans plantation[J]. British Medical Journal Case Reports, 2012;19(6):73-62.
[16] MATTHEW M E, FLETCHER J A, THYFAULT J P, et al. The role of angiotensin II in nonalcoholic steatohepatitis.[J]. Molecular & Cellular Endocrinology, 2013, 378(1/2):29-40.
[17] WOLAK T, ALIEV E, ROGACHEV B, et al. Renal safety and angiogenesis II blockade medications in patients undergoing non-emergent coronary angiography: A randomized controlled study[J]. The Israel Medical Association Journal, 2013,5(11):682-687.
[18] TUCKER S, CHEN Y, ABELL R. In patients with chronic diabetic nephropathy, do angiotensin converting enzyme inhibitors (ACEI) have greater renal protective effect as compared to angiotensin receptor blockers (ARB)?[J]. Journal of the Oklahoma State Medical Association, 2013,106(7):294-295.
[19] KURDI M, BOOZ G W. New take on the role of angiotensin II in cardiac hypertrophy and fibrosis[J]. Hypertension, 2011, 57(6):1034-1038.
[20] LI T B, ZHANG Y Z, LIU W Q, et al. Correlation between NADPH oxidase-mediated oxidative stress and dysfunction of endothelial progenitor cell in hyperlipidemic patients[J]. Korean Journal of Internal Medicine, 2017, 33(2):313-322.
[21] 陳景彦,陈炳宏,张树峰,等.泽泻汤加味方对高盐高血压大鼠的降压疗效及对肾功能的保护作用[J].中国老年学杂志,2012,32(24):5467-5469.
[22] TASHIRO Y, YOGO K, SERIZAWA K, et al. Nicorandil suppresses urinary protein excretion and activates eNOS in Dahl salt-sensitive hypertensive rats[J]. Clinical & Experimental Nephrology, 2015, 19(3):343-349.
