补阳还五汤联合BMSCs移植对脊髓损伤气虚血瘀证红核神经元的影响
2019-08-13周彬范瑜洁聂颖夏帅帅张伟李亮
周彬 范瑜洁 聂颖 夏帅帅 张伟 李亮

〔摘要〕 目的 探討补阳还五汤(Buyang Huanwu Decoction, BYHWD)联合骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)移植对保护脊髓损伤(sipnal cord injury, SCI)气虚血瘀证红核神经元是否能产生协同增效作用。方法 将30只雄性SD大鼠随机分为5组:正常组、气虚血瘀组、BYHWD组、BMSCs组、BYHWD+BMSCs组,每组6只。采用游泳力竭法联合红核脊髓束(rubrospinal tract, RST)横断手术制备气虚血瘀证大鼠模型,并予以相应干预。通过斜板实验观察运动功能恢复情况,尼氏染色观察红核神经元胞体形态及数量,在RST横断点上方注射荧光金(FG)进行神经束路示踪,观察红核神经元胞体形态及数量。结果 术后14 d、28 d,BYHWD+BMSCs组斜板实验评分高于气虚血瘀组、BYHWD组及BMSCs组(P<0.05或P<0.01)。尼氏染色显示与正常组相比,气虚血瘀组尼氏体体积及数量减少,胞浆染色较浅;BYHWD组、BYHWD+BMSCs组的情况优于气虚血瘀组,尤其是BYHWD+BMSCs组。FG逆行示踪显示气虚血瘀组胞体荧光强度减弱、形态不规则、边缘模糊不清,且红核正常神经元数目较正常组明显减少(P<0.01),BYHWD 组、BMSCs组、BYHWD+BMSCs组较模型组增加(P<0.01),特别是BYHWD+BMSCs组(P<0.01)。结论 BYHWD联合BMSCs移植对保护SCI气虚血瘀证逆行性溃变的红核神经元能产生协同增效作用。
〔关键词〕 补阳还五汤;骨髓间充质干细胞;脊髓损伤;气虚血瘀证;红核脊髓束
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2019.05.002
〔Abstract〕 Objective To observe whether Buyang Huanwu Decoction (BYHWD) combined with bone marrow mesenchymal stem cells (BMSCs) transplantation could be cooperative remarkably for protection to red nucleus neurons in spinal cord injury (SCI) with Qi-deficiency and blood-stasis syndrome. Methods Totally 30 male rats were randomly divided into the following 5 groups: a normal group, a Qi-deficiency and blood-stasis group, a BYHWD group, a BMSCs group, a BYHWD+BMSCs group, with 6 rats in each group. The rat model of Qi-deficiency and blood-stasis syndrome was established by swimming exhaustion combined with the transection of rubrospinal tract (RST), and giving corresponding intervenes. The recovery of motor function was observed by inclined plate test, and the morphology and number of red nucleus neurons were observed by Nissl staining. The nerve tract was traced by injection of fluorescent gold (FG) above the RST transection point, and the morphology and number of red nucleus neurons were observed. Results At 14 d and 28 d after operation, the oblique plate test scores of the BYHWD + BMSCs group were higher than those of the Qi-deficiency and blood-stasis group, the BYHWD group and the BMSCs group (P<0.05 or P<0.01). Compared with the normal group, Nissl staining showed that the volume and quantity of Nissl body in the Qi-deficiency and blood-stasis group was decreased, and the cytoplasmic staining was shallow; the situation of the BYHWD group and the BYHWD + BMSCs group was better than that of the Qi-deficiency and blood-stasis group, especially the BYHWD + BMSCs group. FG retrograde tracing showed that the fluorescence intensity was weakened, the shape was irregular and the edge was blurred in the the Qi-deficiency and blood-stasis group, and the number of normal neurons in the red nucleus was significantly decreased compared with the normal group (P<0.01), while the number of normal neurons in the BYHWD group, the BMSCs group and the BYHWD+BMSCs group was increased compared with the model group (P<0.01), especially in the BYHWD + BMSCs group (P<0.01). Conclusions BYHWD combined with BMSCs transplantation can cooperate remarkably to protect red nucleus neurons in retrograde degeneration of SCI with Qi-deficiency and blood-stasis syndrome.
〔Keywords〕 Buyang Huanwu Decoction; bone marrow mesenchymal stem cells; spinal cord injury; Qi-deficiency and blood-stasis syndrome; red nucleus spinal tract
脊髓损伤(spinal cord injury, SCI)后受损轴突可通过继发逆行性溃变导致神经元胞体发生死亡与萎缩,因此挽救神经元胞体,維持其正常生理功能,是轴突修复与再生的前提[1]。历代医家认为补阳还五汤(Buyang Huanwu Decoction, BYHWD)可以用来治疗偏瘫、截瘫或肢体痿软等症,中医学认为SCI属于督脉受损,瘀血阻络,加之患者元气大伤且久卧伤气,多见气虚血瘀之证[2]。我们前期研究发现[3-4],BYHWD不仅提高了SCI大鼠轴突横断后红核神经元的存活率,还明显降低气虚血瘀型SCI大鼠脊髓冠状切片伤侧面积比率。有研究发现,骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)分化成神经元样细胞后,通过分泌相关因子等改善中枢神经受损区域的微环境,促进SCI修复[5]。那么BYHWD联合BMSCs移植对气虚血瘀型SCI大鼠红核神经元能否发生协同效应,发挥神经保护作用?因此,首先建立SCI气虚血瘀证大鼠的病证结合模型,在此基础上,采用行为学检测、神经示踪、尼氏染色方法观察BYHWD联合BMSCs移植对SCI气虚血瘀证红核神经元的保护能否产生协同增效作用。
1 材料与方法
1.1 材料
1.1.1 动物 成年雄性健康Sprague-Dawley大鼠30只,体质量200~220 g(合格证编号:43004700014842),由湖南中医药大学实验动物中心提供(许可证编号:SYXK[湘]2013-0005),自由饮食进水,分笼喂养,饲养环境温度22~25 ℃,相对湿度50%~70%。
1.1.2 药物及细胞 BYHWD(《医林改错》)处方:黄芪120 g,当归尾9 g,赤芍4.5 g,川芎3 g,地龙3 g,桃仁3 g,红花3 g[6]。中药饮片购于老百姓大药房连锁股份有限公司,加水回流提取2次,第一次加10倍水提取2 h,第二次加8倍水提取1.5 h,药液过滤、合并浓缩成每克浸膏含生药2 g,蒸馏水溶解成浓度1 g/mL,置4 ℃冰箱保存备用。BMSCs购于湖南省长沙市盈润生物技术有限公司(YRBio PC059),细胞浓度为1×106/mL。
1.1.3 主要试剂及仪器 DMEM/F12培养基(美国Gibco公司),BrdU(美国SIGMA公司),荧光金(Fluoro-Gold,美国Fluorochrome公司),ECL发光试剂盒(美国Pierce公司),BX43型双目生物摄像显微镜(日本OLYMPUS)。
1.2 方法
1.2.1 SCI气虚血瘀证复合动物模型造模 气虚血瘀证负荷动物造模参考文献[4],采用“游泳力竭法”,力竭指征为游泳动作失调、水淹没鼻尖、身体下沉超过10 s不能浮出水面。刚从水中捞出的大鼠呈疲惫无力状,表现为目微闭,以后肢撑地慢慢抬起前肢以立身,大喘,摇晃甚至后倒,多不动或挪步蹒跚,无力抵抗、一触即倒,时间持续21 d。21 d在脊髓颈椎C3-C4之间横断右侧红核脊髓束(rubrospinal tract, RST),建立局部“血瘀”状态。动物苏醒后右侧前肢屈曲,紧贴躯干,运动不协调,右前爪不能张开,表明造模成功。
1.2.2 动物分组及干预 将造模成功的24只大鼠随机分为4组:气虚血瘀组、BYHWD组、BMSCs组、BYHWD+BMSCs组,每组6只。另取6只正常大鼠为对照。BYHWD组、BYHWD+BMSCs组以BYHWD 1 mL灌胃,1次/d,连续28 d,其余各组均以等容量生理盐水灌胃。BMSCs组和BYHWD+BMSCs组在造模2 d后在脊髓损伤点注射10 μL被BrdU标记的BMSCs,其余3组在相同的部位注射等容量的生理盐水。药物干预28 d处死所有动物。
1.2.3 肢体行为学检测 以RST横断术前、术后1 d、14 d、28 d观察大鼠前肢功能恢复情况。运用改良的Rivlin和Tator法,行斜板实验[7]。具体方法是将大鼠身体轴线垂直与斜板纵轴放置,检测停留时间,5 s后增加斜板角度,每次升高5°,以大鼠能够停留5 s的最大角度为其对应的功能值。每只大鼠测量3次,记录分数最高者。
1.2.4 动物处理与轴突逆行示踪 药物干预25 d,每组大鼠麻醉,用微量注射器将0.5 μL特异性轴突示踪剂2%荧光金(FG)缓慢注入RST横断点上方1 mm处,进行RST轴突逆行示踪。存活3 d后将动物再次麻醉,心脏灌注固定,取脑,去首尾两端,保留中脑和脑桥部分,4 ℃下再用4%多聚甲醛固定2 h,依次使用10%、20%、30%蔗糖梯度浸泡沉底。做连续冰冻切片,片厚20 μm,倒置荧光显微镜下观察红核神经元形态,100×镜下用图像分析系统计数被FG标记红核阳性神经元的个数。荧光淬灭后继续将切片用于尼氏染色。
1.2.5 尼氏染色 上述切片分别用氯仿1 min、90%酒精l min、70%酒精1 min、自来水洗2 min,10%硫堇染色10 min、自来水洗3 min,85%乙醇脱水20 s、90%乙醇30 s、95%乙醇1 min×2、100%乙醇2 min×2、二甲苯2 min×2,中性树胶封片。显微镜下观察红核神经元的形状,400×镜下计数每个视野神经元数目。
1.2.6 统计学处理 使用SPSS 19.0软件进行统计分析,实验结果以“x±s”表示,采用One-Way ANOVA。所有数据均进行正态性、方差齐性检验,方差齐采用LSD法,若方差不齐采用Dunnett T3。不满足正态检验则使用秩和检验。以P<0.05为差异有统计学意义。
2 结果
2.1 动物一般情况
气虚血瘀组、BYHWD组、BMSCs组、BYHWD+BMSCs组造模后大鼠出现体质量减轻、摄食量减少,毛发暗淡,倦怠嗜睡,口唇、爪甲顏色浅淡,双目无神,喜欠伸等。伴发右侧前肢屈曲,紧贴躯干,运动不协调,右前爪不能张开,说明SCI气虚血瘀证造模成功。在造模及干预过程中无动物死亡。
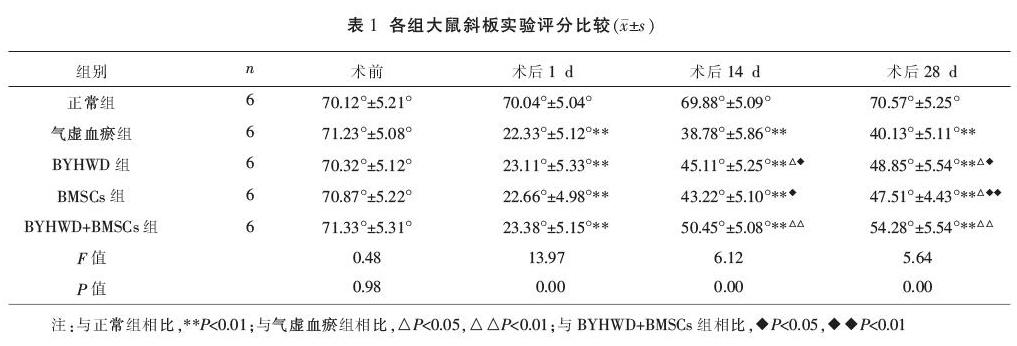
2.2 斜板实验结果比较
RST术后1 d,与正常组相比,其它4组评分大幅下降(P<0.01)。术后14 d、28 d,BYHWD+BMSCs组评分高于气虚血瘀组、BYHWD组、BMSCs组(P<0.05或P<0.01)。见表1。
2.3 FG标记的红核神经元比较
FG的注射区为RST横断点上方,注射3 d后观察中脑红核FG标记神经元,阳性标记神经元在荧光显微镜下通过紫外激发呈蓝白色光。正常组红核处可见大量FG标记的阳性神经元,神经元形态规则,轮廓清晰,胞体饱满,突起明显;气虚血瘀组红核仅见少量的阳性神经元,荧光强度减弱,且细胞形态不规则,边缘模糊不清,胞体萎缩甚至变性,突起不清晰,与正常组相比有统计学意义(P<0.01);BYHWD组、BMSCs组、BYHWD+BMSCs组阳性神经元较气虚血瘀组增多(P<0.01),但前两组低于正常组(P<0.01);BYHWD组、BMSCs组阳性神经元数明显低于BYHWD+BMSCs组(P<0.01)。见表2,图1。
2.4 中脑红核尼氏染色比较
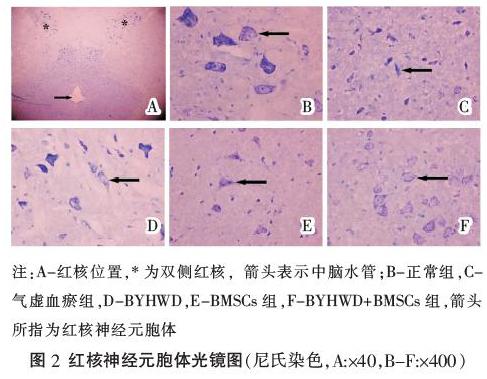
正常组可见中脑红核区细胞密集,细胞形态正常,胞体和突起轮廓清晰,尼氏体较大而多,胞浆染色深,着色均一,呈现虎斑样;气虚血瘀组细胞密度稀疏,细胞皱缩明显,部分细胞胞浆空泡样改变,尼氏体模糊,胞浆染色浅;BYHWD组、BMSCs组、BYHWD+BMSCs组细胞较气虚血瘀组密集,许多细胞均有明显的突起,偶见细胞皱缩,尼氏体体积及数量减少,胞浆染色较浅,而BYHWD+BMSCs组优于BYHWD组、BMSCs组。气虚血瘀组红核神经元数目低于正常组(P<0.01)。BYHWD、BYHWD+BMSCs组红核神经元数目增多,与气虚血瘀组相比较有统计学意义(P<0.01),但仍低于正常组(P<0.01),BYHWD+BMSCs组红核神经元数量高于BMSCs组(P<0.01)。见表2,图2。
3 讨论
大鼠RST起自中脑红核,RST纤维交叉到对侧,脊髓外侧索后部下行,投射到V-Ⅶ板层的中间神经元,负责支配前肢的精细运动[8]。因RST束路清晰,造模简便易行,创伤小,故RST横断模型常用于SCI修复的研究。本研究在病证结合的研究指导思想下,首先以气虚为切入点,根据中医学“劳则气耗”理论,采用“游泳力竭法”,通过强迫游泳使大鼠达到力竭程度,持续力竭导致气虚,久之“因虚致瘀”达到全身性气虚血瘀状态[9];随后联合RST横断手术损伤脊髓局部,造成明确的局部血瘀状态,成功复制了SCI气虚血瘀证复合模型。
研究发现,SCI后轴突的再生情况并不乐观,因为轴突的损伤可能通过逆行性溃变,导致远处的神经元胞体发生死亡与萎缩[10]。我们前期研究已证实黄芪注射液可改善轴浆运输能力,提高胞体的存活率,对逆行溃变的红核神经元具有保护作用[11]; BYHWD拮抗SCI大鼠运动区皮质神经元凋亡改善SCI 大鼠后肢运动作用[12]。目前BMSCs移植成为治疗SCI的理想选择,但移植的BMSCs活力低,在体内不容易存活、增殖和分化。故本研究运用BYHWD+BMSCs对气虚血瘀型SCI大鼠进行干预,发现斜板实验评分明显高于气虚血瘀组、BYHWD组、BMSCs组,证明BYHWD+BMSCs可以改善其运动功能。
Li C等[13]认为有足够数量的神经元存活,是SCI后轴突修复的先决条件,因为轴突再生所需的物质只能在神经元胞体内合成,一旦神经元胞体死亡,轴突就难以再生,即神经元胞体存活越多,轴突再生的希望也就越大[14]。本实验中通过FG逆行示踪标记神经元及尼氏染色反映神经元胞体恢复情况。FG是一种特异性轴突逆行示踪剂,当被注射到轴突周围后,可被轴突缓慢摄取,通过轴浆运输逐渐流向胞体,因而可以在胞体检测到FG的存在。实验结果显示,正常组可见大量FG标记的红核阳性神经元,形态规则,轮廓清晰,胞体饱满,突起明显,说明正常组轴突的轴浆运输能力正常,可将大量FG运输到胞体;气虚血瘀组红核仅见少量的阳性神经元,荧光强度减弱,且细胞形态不规则,边缘模糊不清,说明RST横断后轴突发生了一定程度的崩解,影响轴浆运输能力,使得仅有少量FG被输送到胞体,而细胞形态的不规则又进一步说明胞体发生了逆行性溃变,出现萎缩或坏死;BYHWD组、BMSCs组、BYHWD+BMSCs组的情况优于气虚血瘀组,尤其是BYHWD+BMSCs组,这说明BYHWD或BMSCs的单独使用可以改善轴突的轴浆运输能力,挽救逆行性溃变的红核神经元胞体,而二者的联合使用则产生了一定的协同增效作用。
尼氏体是神经元内特有的物质之一,分布在核周体和树突内,是细胞内一种呈斑块状或颗粒状的噬碱性物质,能与碱性染液结合并染色。尼氏体的主要功能是合成蛋白质。在正常情况下,尼氏体体积大且数量多,这反应神经元合成蛋白质的功能较强。一旦神经元受损,其体积缩小,数量可减少甚至消失[15]。因此尼氏体的形态及数量可以提示神经元功能正常与否。尼氏染色结果显示,正常组可见中脑红核区细胞密集,细胞形态正常,胞体和突起轮廓清晰,尼氏体较大而多,胞浆染色深,着色均一,呈现虎斑样,说明红核神经元胞体的形态和功能均正常;气虚血瘀组细胞密度稀疏,细胞皱缩明显,部分细胞胞浆空泡样改变,尼氏体模糊,胞浆染色浅,说明神经元胞体形态和功能受损严重;BYHWD组、BYHWD+BMSCs组的情况优于气虚血瘀组,特别是BYHWD+BMSCs组,说明BYHWD或BMSCs的单独使用能保护RST横断后的红核神经元胞体,维持其正常功能,而二者的联合使用则产生了一定的协同增效作用。
由此可见,BYHWD联合BMSCs移植对保护SCI气虚血瘀证逆行性溃变的红核神经元能产生协同增效作用,其更深层次的机制还需进一步深入研究。
参考文献
[1] MAZZONE G L, VEERARAGHAVAN P, GONZALEZ-INCHAUSPE C, et al. ASIC channel inhibition enhances excitotoxic neuronal death in an in vitro model of spinal cord injury[J]. Neuroscience, 2017,
343:398-410.
[2] 宋汉秋.补阳还五汤治疗急性缺血性脑梗塞46例[J].陕西中医, 2013,34(2):158-160.
[3] 陈 安,王 慧,伍校琼,等.补阳还五汤对大鼠脊髓损伤后红核脊髓束再生及功能修复的影响[J].神经解剖学杂志,2007,23(6):587-590.
[4] LIANG LI, FENG LI, JIAN YIN, et al. Establishment and evaluation of a rat model of spinal cord injury with the pathopattern of Qi-deficiency and blood-stasisin traditional chinese medicine[J]. Digital Chinese Medicine, 2018,1(1):102-112.
[5] 孙经淞,周雪颖,曲淑贤,等.骨髓间充质干细胞移植对脊髓损伤的修复作用[J].中国组织工程研究,2018,22(1): 59-64.
[6] YU P, GUAN L, ZHOU L, et al. Upregulation of glutamate metabolism by BYHWD in cultured astrocytes following oxygen-glucose deprivation/reoxygenation in part depends on the activation of p38 MAPK[J]. Experimental and Therapeutic Medicine, 2017,13(6): 3089-3096.
[7] 陳 萌,马 泉,郑小影,等.大鼠脊髓横断模型的建立及米诺环素对胶质纤维酸性蛋白表达的影响[J].解剖学杂志,2014,37(3):352-355.
[8] MARTINEZ-LOPEZ J E, MORENO-BRAVO J A, MADRIGAL MP, et al. Red nucleus and rubrospinal tract disorganization in the absence of Pou4f1[J]. Frontiers in Neuroanatomy, 2015,9:8.
[9] 扈新刚,张允岭,柳洪胜,等.气虚血瘀大鼠模型表征及血液流变学研究[J].天津中医药,2007,24(2):138-141.
[10] ZANGERL B, WHATHAM A, KIM J, et al. Reconciling visual field defects and retinal nerve fibre layer asymmetric patterns in retrograde degeneration: an extended case series[J]. Clinical and Experimental Optometry, 2017,100(3): 214-226.
[11] 李 亮,杨 萍,张 薇,等.黄芪注射液对大鼠红核神经元逆行溃变的影响[J].临床神经病学杂志,2014,27(6):446-449.
[12] 黄 胜,袁 莉,陈 安,等.补阳还五汤及其四类有效部位对脊髓损伤大鼠大脑运动皮质的神经保护作用[J].湖南中医药大学学报,2016,36(9):36-39.
[13] LI C, ZHANG X, CAO R, et al. Allografts of the acellular sciatic nerve and brain-derived neurotrophic factor repair spinal cord injury in adult rats[J]. PLoS ONE, 2012,7(8):e42813.
[14] 王亚康,朱 超,罗卓荆.NRG-1参与髓鞘再生及修复的研究进展[J].神经解剖学杂志,2015,31(3):382-386.
[15] JING L, WANG J G, ZHANG J Z, et al. Upregulation of ICAM-1 in diabetic rats after transient forebrain ischemia and reperfusion injury[J]. Journal of Inflammation (London),2014,11(1):35.
