Cu-Fe3O4磁性纳米复合材料的制备与催化性能研究
2019-08-13蒋恺迪杨艳婷
蒋恺迪,杨艳婷
(中国计量大学 材料科学与工程学院,浙江 杭州 310018)
随着工业的飞速发展,大量工业废水被排放到环境水体中,导致水体质量严重下降,对我们的生产生活造成了巨大的影响,威胁着我们的生命健康。根据我国水中优先控制污染物黑名单[1],4-硝基苯酚(4-nitrophenol,4-NP)是一种主要的水体污染物。4-NP主要来源于石化、冶金、染料等产业,是一种毒性较大的污染物,具有三致效应。现有的污水处理手段主要有物理法[2]、化学法[3]和生物法[4]。物理法成本较高且易造成二次污染,生物法可处理的污染物种类与浓度都受到一定的限制。因此,化学法往往被作为一种主要的处理和预处理的手段,其中化学催化法因为近代各类纳米催化剂的发现而受到越来越多的关注。
近年来,纳米催化剂受到了人们的广泛关注。因为纳米材料的比表面积大,表面能高,所以纳米催化剂具有比一般催化剂更高的催化活性。但正是由于纳米催化剂尺寸小,表面能高的特点,在使用时往往会产生严重团聚现象,导致催化性能降低乃至催化剂失活。并且,极小的尺寸也导致纳米催化剂难以从反应体系中分离。这一方面造成了催化剂大量损失,成本提高;另一方面,产物的纯化也是一个昂贵且耗时的过程。因此这也成为了制约纳米催化剂发展的重要因素,于是制备一种易分离且回收率高的可循环使用的催化剂就具有很大的研究价值。
在研究中,将纳米催化剂负载在支撑材料上制备成纳米复合材料是一种常见且有效的方法[5]。常用的支撑材料有石墨烯[6]、碳纳米管[7]、二氧化硅[8]、氧化锌[9]等。这类非磁性支撑材料制得的复合催化剂多用离心、过滤的方式分离。这种分离的办法耗时相对较长,且往往会在离心管、滤膜上残留催化剂,回收率较低。相比较而言,Fe3O4磁性纳米颗粒作为一种新型的支撑材料,因为其优秀的磁分离能力而受到了广泛关注。通过磁分离回收催化剂,耗时短且回收率高,几乎无损失且清洗方便。Fe3O4磁性纳米颗粒具有超顺磁性、磁化率高、磁分离效果好,且无剩磁和矫顽力,撤去磁场后不会产生团聚问题。据报道[10]Fe3O4磁性纳米颗粒本身也具有一定的催化效果。同时,许多研究[11-13]证明非均相纳米催化剂往往比他们各自的单相催化剂具有更高的催化活性。因为它们之间存在协同作用,不同组分的催化剂之间可以在表面稳定性,电子交换,电荷转移等方面产生互补,从而得到远超均相催化剂的催化性能。
催化4-NP还原反应中,4-NP被催化还原为4-氨基苯酚(4-aminophenol,4-AP),Au、Pt等贵金属催化剂[14-15]往往是优先的选择。虽然此类贵金属催化剂的催化效果出色,但是在实际应用中,贵金属的价格高昂,在大规模的工业应用中不具有可行性。鉴于Cu催化剂在乌尔曼偶联反应中对芳香族化合物的高催化性[16],可以考虑用纳米Cu代替贵金属催化剂用于催化4-NP还原。
综上所述,本实验用Cu作为催化剂,Fe3O4磁性纳米颗粒作为载体,使用水热法[10]一步制备Cu-Fe3O4磁性复合纳米催化剂。通过改变投料比,制备不同Cu负载量的催化剂并表征。将催化剂研究了Cu负载量对催化性能的影响,并分析了催化机理。
1 实验部分
1.1 实验主要试剂
六水合氯化铁(FeCl3·6H2O)购自国药集团化学试剂有限公司,二水柠檬酸钠(Na3C6H5O7·2H2O)购自无锡市展望化工试剂有限公司,尿素(CO(NH2)2)购自上海凌峰化学试剂有限公司,硼氢化钠(NaBH4)购自上海展云化工有限公司,三水硝酸铜(Cu(NO3)2·3H2O),4-硝基苯酚(C6H5NO3)购自上海麦克林生化科技有限公司。所有试剂均为分析纯,水为去离子水。
1.2 样品的制备
分别称取1 g FeCl3·6H2O,2.411 6 g柠檬酸钠,0.6 g尿素和一定摩尔量的Cu(NO3)2·3H2O,将上述药品溶解在80 mL去离子水中,磁力搅拌30 min至完全溶解。然后将溶液转移至100 mL反应釜,在200 ℃保持4 h,自然冷却至室温。取出产物后,利用磁分离洗涤并获取样品。最后在40 ℃的真空干燥箱中干燥12 h获得最终产物Cu-Fe3O4。通过改变硝酸铜的添加量(0,0.2,0.4,0.6,0.8,1.0 mmol),制得不同Cu负载量的样品(Cu0-Fe3O4,Cu0.2-Fe3O4,Cu0.4-Fe3O4,Cu0.6-Fe3O4,Cu0.8-Fe3O4,Cu1.0-Fe3O4)。
1.3 催化还原4-NP
分别配置浓度为0.000 5 mol/L的4-NP溶液和浓度为0.2 mol/L的NaBH4溶液。称取1 mg Cu-Fe3O4催化剂,浸泡在1 mL NaBH4溶液中1 h后,用去离子水清洗并分散在1 mL去离子水中。取1 mL 4-NP溶液和1 mL NaBH4溶液混合,加入1 mL催化剂分散液中进行催化反应。
1.4 样品的表征
样品的XRD表征采用丹东浩元仪器有限公司的DX-2700型X射线衍射仪(Cu靶Kα射线,波长1.540 56,管电压40 kV,管电流30 mA,扫描角度20°~80°,步进角度0.02°,采样时间0.5 s)测得,样品的磁性能表征采用美国Lake Shore公司的7407型振动样品磁强计(室温,最大磁场强度2 T)测得,采用上海舜宇公司的UV2600型紫外-分光光度计(测量波长200~500 nm范围)测量不同浓度的4-NP溶液以表征催化过程。
2 结果与讨论
2.1 物相与磁性能分析
图1是不同Cu负载量的Cu-Fe3O4磁性纳米复合材料的XRD图谱。Fe3O4和Cu的峰位有两个重叠,但不影响对最强主衍射峰的判断。对比Cu位于43.3°的最强峰和Fe3O4位于35.5°的最强峰的衍射峰强度可见。随着Cu负载量的增加,单质Cu的衍射峰强度不断增强,与此同时Fe3O4的衍射峰强度不断减弱。复合材料中各相的含量会影响对应的衍射峰强度。由此可以证明,我们通过调整硝酸铜的添加量,成功对Cu-Fe3O4磁性纳米复合材料中的Cu的负载量做到了有效调控,两种纳米粒子结合力良好,不存在其他杂相。
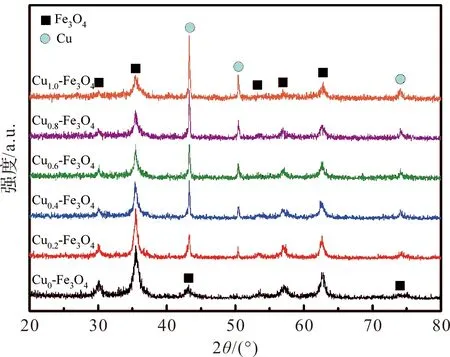
图1 不同Cu负载量的Cu-Fe3O4的XRD图谱Figure 1 XRD pattern of Cu-Fe3o4 with different Cu loadings
图2是不同Cu负载量的Cu-Fe3O4磁性纳米复合材料的VSM测试图谱。所有的样品均呈现良好的超顺磁性。Cu0-Fe3O4到Cu1.0-Fe3O4的饱和磁化强度依次为68.8 emu/g,60.9 emu/g,51.9 emu/g,43.5 emu/g,38.9 emu/g,28.0 emu/g。催着Cu负载量增加,饱和磁化强度出现一定程度的降低。这与XRD的测试结果相符,Cu负载量越多,单位质量的Cu纳米颗粒占比越多,因Cu具有抗磁性,因此Cu-Fe3O4的饱和磁化强度随着Cu占比的增加而降低。其中Cu1.0-Fe3O4的饱和磁化强度最低,为28.0 emu/g。但在外磁场的作用下,依然足以做到十分有效的磁分离,如图2中右下角的插图所示。

图2 不同Cu负载量的Cu-Fe3O4的VSM图谱Figure 2 VSM pattern of Cu-Fe3O4 with different Cu loading
2.2 催化性能分析
图3是整个催化反应过程中UV-vis谱线的变化和溶液颜色的变化。催化过程是在过量NaBH4存在下,使用Cu-Fe3O4纳米复合催化剂催化4-NP还原为4-AP。催化过程中采用紫外-分光光度计检测不同时间溶液的吸光度从而表征反应进程。图3中分别显示了4-NP,4-NP离子和4-AP的紫外-可见吸收光谱。首先,可以看到4-NP的水溶液呈现淡黄色,在317 nm处存在一个吸收峰。随着NaBH4溶液的加入,溶液的吸收峰从317 nm移动到400 nm,并且溶液的颜色从淡黄色变为亮黄色,表明4-NP被转变为4-NP离子。但是,在没有合适的催化剂的情况下,仅有NaBH4并不能使4-NP被还原。然后将催化剂加入反应体系,催化反应开始进行,随着越来越多的4-NP被转化为4-AP,UV-vis谱线表现为400 nm处的吸收峰不断降低,与此同时在232 nm和300 nm处出现两个新的吸收峰并不断增强,溶液的颜色缓慢变淡。最后400 nm处的吸收峰完全消失,232 nm和300 nm处的吸收峰达到最强,且溶液颜色从亮黄色变为无色透明,表明4-NP被完全转化为4-AP,硝基被还原为氨基。

图3 催化过程的UV-vis吸收光谱变化Figure 3 UV-vis absorption spectrum changes in the catalytic process
一般来说,4-NP被还原为4-AP的机理可能存在两种途径[17],直接反应途径和缩合反应途径,如图4。直接反应中,硝基首先被还原为亚硝基,亚硝基被进一步加氢还原为羟胺衍生物,最后羟胺衍生物被迅速还原为氨基,4-NP被还原为4-AP。缩合反应中,硝基被逐步还原得到的亚硝基和羟胺发生缩合反应,脱水缩合为偶氮化合物,随着持续的加氢还原最后被还原为4-AP。在本实验中,较高的催化速率说明更可能的途径是直接还原反应而不是缩合反应。

图4 催化4-NP还原的机理分析Figure 4 Mechanism analysis of catalytic 4-NP reduction
图5是硼氢化钠溶液浸泡预处理的方法对催化性能的影响,我们选用Cu0.2-Fe3O4催化剂样品进行实验。图5(a)是未预处理的催化情况,图5(b)是预处理之后的催化情况。未预处理时,整个催化过程耗时3 min。经过预处理后催化时长缩短到20 s。催化总时长的大幅度减少证明了催化性能的大幅提高,进一步证明了本文中硼氢化钠溶液浸泡的预处理方法的创新性。
图6中是不同Cu负载量的催化剂的催化性能表征。依次为(a)Cu0-Fe3O4;(b)Cu0.2-Fe3O4;(c)Cu0.4-Fe3O4;(d)Cu0.6-Fe3O4;(e)Cu0.8-Fe3O4;(f)Cu1.0-Fe3O4。首先,根据实验结果可得,制得的Fe3O4纳米颗粒也具有一定的催化性能。随着样品Cu负载量的增加,催化所需总时长不断减少,Cu1.0-Fe3O4的从催化开始至催化完成仅需5 s。
由于反应中NaBH4为过量,浓度远大于4-NP,因此本反应可以认为是一级动力学反应,吸光度与反应速率常数成正比。根据一级动力学方程,我们可以得到ln(A/A0)和t之间存在的线性关系。
(1)
式(1)中A和A0分别是在时间t和0分钟时400 nm处4-NP的吸光度;C和C0分别是对应于A和A0的溶液中的4-NP浓度;得到的k即为表观速率常数,即斜率。斜率越大则表观速率常数越大,催化速率越高。
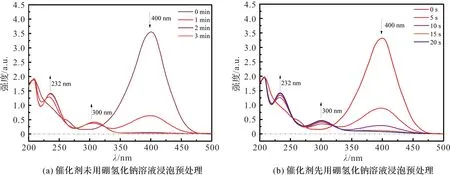
图5 催化剂是否用硼氢化钠溶液浸泡预处理对催化性能的影响Figure 5 Effect of soaking behavior with sodium borohydride solution on catalytic performance of catalyst

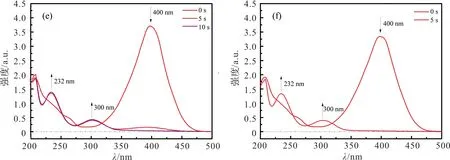
图6 不同Cu负载量催化剂的催化性能表征Figure 6 Characterization of catalytic performance of catalysts with different Cu loadings
由此,我们依据溶液在400 nm处的吸光度得到了对应的催化速率图,如图7。尽管Fe3O4纳米颗粒也存在一定的催化性能,但是Cu的引入使催化速率显著提高,Cu的催化效果大于Fe3O4且二者之间可能存在一定的协同作用,多相纳米催化剂中不同组分间的协同作用已有相关报道[18-19]。对比不同Cu负载量的样品可知,Cu负载量越多,催化速率越高,Cu的含量与催化速率成正相关。
表1列出了多种催化剂的催化4-NP性能参数。对比本实验中不同Cu负载量的催化剂,Cu1.0-Fe3O4表现出远高于其他Cu负载量催化剂的催化速率,表观速率常数达到57.760 0 min-1。同时,对比其他催化剂的报道,本实验测得的催化速率也普遍高于报道中的样品。通过对比发现,相比于已报道的实验,本实验中,对催化剂在催化前先用硼氢化钠溶液浸泡的预处理方法是独一无二的。该预处理方式对催化剂起到了非常明显的活化作用,显著提高了催化剂的催化性能。
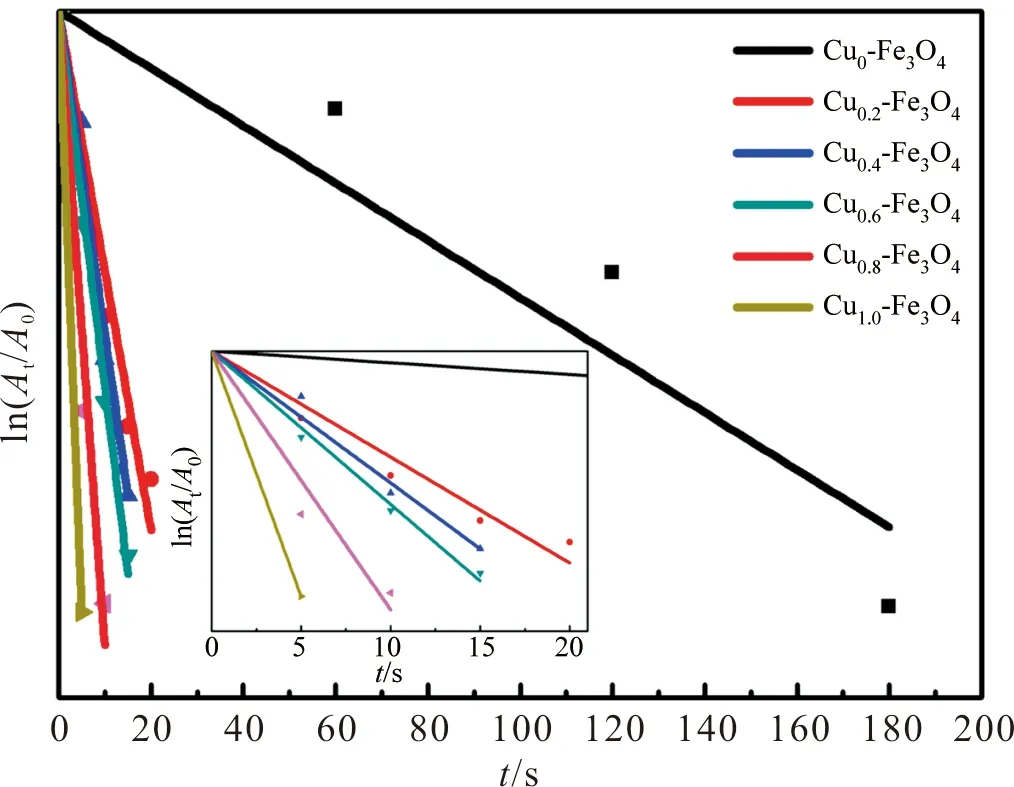
图7 不同Cu负载量催化剂的催化速率图Figure 7 Catalytic rate plots for different Cu loading catalysts

表1 各种纳米催化剂催化还原4-NP性能对比
我们对催化性能最优的Cu1.0-Fe3O4进行了8次的磁分离回收循环使用以测试它的循环使用稳定性,测试结果如图8。Cu1.0-Fe3O4催化剂经过多达8次循环催化都没有发现催化效果有明显的下降,且转化率始终高于98%。可见,该催化剂在催化4-NP还原反应中,是一种可回收利用的高效催化剂,具有较大的应用价值。
3 结 论
本文使用“一锅煮”的水热法直接合成Cu-Fe3O4纳米复合颗粒。通过改变制备中硝酸铜的添加量成功调控了Cu-Fe3O4中Cu的负载量,制备了不同Cu负载量的Cu-Fe3O4催化剂。发现Cu负载量与催化速率成正比。且由于对催化剂的创新的预处理方法(硼氢化钠溶液浸泡),测得的催化速率远高于已有的报道。催化剂的循环使用8次以内都无明显的性能降低,转化率高于98%。故Cu-FeO4是一种可回收利用的高效催化剂,有巨大的应用前景。

图8 Cu1.0-Fe3O4的可循环催化性能Figure 8 Cyclic catalytic performance of Cu1.0-Fe3O4
