桧木醇通过mTOR通路抑制自噬诱导卵巢癌SKOV3细胞凋亡①
2019-08-13瞿小玲
瞿小玲 曾 仪 姚 利 蔡 政
(南阳市中心医院产二科,南阳473000)
卵巢癌是导致女性癌症死亡的第四主要原因,也是死亡率最高的一类女性生殖肿瘤[1]。研究表明,卵巢癌好发于绝经后的女性。但近年来,随着我国人口老龄化,卵巢癌的发病率呈逐年上升的趋势,并且其好发人群趋于年轻化[2]。目前,卵巢癌的治疗仍以化疗为主,但化疗仅对早期卵巢癌具有较好疗效,化疗抵抗性使化疗的应用进一步受限[3]。大量研究表明,自噬是癌细胞化疗抵抗性形成的主要机制[4]。抑制自噬可降低卵巢癌细胞的化疗抵抗性,促进癌细胞死亡,从而减缓癌症的发展[5]。近年来研究发现草本药物尤其是植物挥发油在治疗癌症方面具有较大的优势[6]。桧木醇是提取自台湾扁柏的一类单贴类化合物,是扁柏精油的主要有效成分,具有抗菌及抗肿瘤活性[7]。Wang等[8]研究发现,桧木醇能诱导乳腺癌和结肠癌细胞自噬性死亡,抑制癌细胞增殖,提示桧木醇能调控癌细胞自噬。但桧木醇对卵巢癌细胞自噬的作用尚未见报道。因此,本文以卵巢癌SKOV3细胞为研究对象,探究桧木醇对卵巢癌细胞自噬的作用及机制,以期为卵巢癌的治疗提供新的潜力药物。
1 材料与方法
1.1材料 DMEM细胞培养液、胎牛血清和0.25%胰蛋白酶购自美国Hyclone公司。桧木醇购自美国Sigma公司,纯度 ≥ 99%。RIPA裂解液、CCK8试剂盒和BCA试剂盒购自北京索莱宝生物科技公司。Annexin-FITC/PI试剂盒购自上海锐赛生物技术有限公司。Beclin1、P62、LC3、雷帕霉素靶蛋白 (mammalian target of rapamycin,mTOR) 和UNC-51样激酶(UNC-51 like kinase 1,Ulk1)一抗购自美国Millipore公司,山羊抗小鼠和山羊抗兔二抗购自北京康为生物科技公司。人卵巢癌细胞株SKOV3来源于中国科学院上海细胞库。
1.2方法
1.2.1细胞培养 用含有10%胎牛血清的DMEM培养液培养SKOV3细胞,隔天换液,2~3 d进行传代。
1.2.2细胞分组及处理 将细胞以3×104个/ml的密度接种于培养板中,分为SKOV3组、Hinokitiol (5 μmol/L) 组、Hinokitiol (10 μmol/L) 组和Hinokitiol (20 μmol/L) 组,每组至少3个复孔。培养24 h后,并分别用0、5、10、20 μmol/L的桧木醇处理细胞24 h后进行检测。
1.2.3CCK8检测细胞活性 将细胞以1×104个/ml的密度接种于96孔板中,并分为SKOV3组、Hinokitiol (5 μmol/L) 组、Hinokitiol (10 μmol/L) 组和Hinokitiol (20 μmol/L) 组,每组6个复孔。待细胞贴壁后,用不同浓度的桧木醇分别处理细胞0、1、2、3、4 d。每孔加入10 μl的CCK8溶液,2 h后用酶标仪检测各组细胞吸光度,计算细胞增殖倍数 (增殖倍数=细胞吸光度/0 h细胞吸光度)。
1.2.4克隆实验检测细胞增殖 收集细胞,将细胞分为SKOV3组、Hinokitiol (5 μmol/L) 组、Hinokitiol (10 μmol/L) 组和Hinokitiol (20 μmol/L) 组,用含有不同浓度桧木醇的培养液将细胞重悬后接种于培养皿中,使每个培养皿的细胞数为200个。将细胞置于培养箱中培养2~3周,有集落形成后终止培养,用甲醇固定细胞,用结晶紫对细胞染色,统计形成集落细胞数。
1.2.5流式细胞术检测细胞凋亡 将细胞用不同浓度桧木醇处理后,用0.25%胰酶收集细胞,将细胞密度调整为1×106个/ml,随后根据Annexin-FITC/PI细胞凋亡试剂盒说明书检测各组细胞凋亡率。
1.2.6免疫印迹检测蛋白表达 用RIPA裂解液提取各组细胞蛋白,并用BCA试剂盒检测各组细胞蛋白浓度。每组各取30 μg蛋白用10% SDS-PAGE进行分离,用半干法转移蛋白质到PVDF膜。用缓冲液清洗PVDF膜3次,加入5%脱脂牛奶室温封闭2 h。2 h后加入适宜浓度一抗4℃封闭过夜。第2天洗去未结合一抗,加入二抗室温孵育1 h后,加入化学发光显色液曝光显影。Image J软件对蛋白质条带灰度值进行定量分析。
1.2.7免疫荧光检测LC3表达 将细胞用不同浓度桧木醇处理后,加入磷酸盐缓冲液清洗3次。随后加入4%多聚甲醛室温固定30 min,用0.5% TritonX-100对细胞膜穿孔。用磷酸盐缓冲液洗去TritonX-100后,加入10%的封闭用山羊血清室温封闭2 h,随后滴加LC3一抗 (1∶300) 于4℃封闭过夜。第2天洗去细胞表面一抗,加入GFP标记山羊抗兔二抗(1∶250) 室温避光孵育1 h后洗净,滴加DAPI染色液对细胞核染色。于荧光显微镜下观察LC3表达情况。
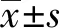
2 结果
2.1桧木醇对卵巢癌细胞增殖的影响 CCK8实验结果 (图1) 表明,桧木醇处理细胞4 d后,Hinokitol (5、10、20 μmol/L) 组细胞增殖倍数与SKOV3组比较明显降低 (P<0.05,P<0.01);同时,Hinokitol (5、10、20 μmol/L) 组克隆形成细胞数明显减少(P<0.05,P<0.01,图2),与SKOV3组比较差异有统计学意义,表明桧木醇能抑制卵巢癌SKOV3细胞增殖。
2.2桧木醇对卵巢癌细胞凋亡的影响 与SKOV3组比较,Hinokitiol(5、10、20 μmol/L)组细胞凋亡率均显著升高 (P<0.05,P<0.01,图3),并具有量效关系,表明桧木醇能诱导卵巢癌SKOV3细胞凋亡。
2.3桧木醇对卵巢癌细胞自噬的影响 如图4所示,与SKOV3组比较,Hinokitol(5、10、20 μmol/L) 组细胞自噬相关蛋白Beclin1的表达水平和LC3Ⅱ/LC3Ⅰ的比值明显降低 (P<0.05,P<0.01),P62蛋白表达明显水平明显升高(P<0.05,P<0.01);同时,Hinokitol(5、10、20 μmol/L) 还能显著减少LC3在细胞质中的阳性表达(P<0.01,图5),表明桧木醇能抑制卵巢癌SKOV3细胞自噬。
2.4桧木醇对卵巢癌细胞mTOR信号通路的影响 免疫印迹实验结果 (图6) 表明,桧木醇浓度为5、10、20 μmol/L时均能显著促进SKOV3细胞mTOR蛋白表达 (P<0.01),降低Ulk1的蛋白表达水平 (P<0.05,P<0.01),并随浓度升高,作用逐渐增强,表明桧木醇能诱导mTOR信号通路激活。
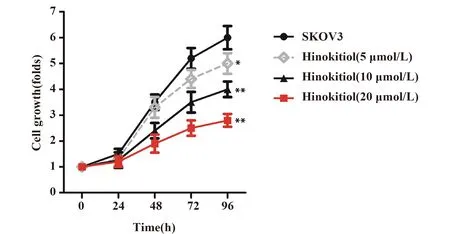
图1 桧木醇对SKOV3细胞增殖的影响Fig.1 Cell proliferation was detected by CCK8 assay after treated by hinokitiol in SKOV3 cellsNote: Cell viability was measured by CCK8 assay.Data are expressed as the vs SKOV3 group.

图2 桧木醇对SKOV3细胞克隆形成的影响Fig.2 Cell colon formation was detected by crystal violet staining after treated by hinokitiol in SKOV3 cellsNote: The proliferation of SKOV3 cells was determined by colon formation assay.Data are expressed as the vs SKOV3 group.
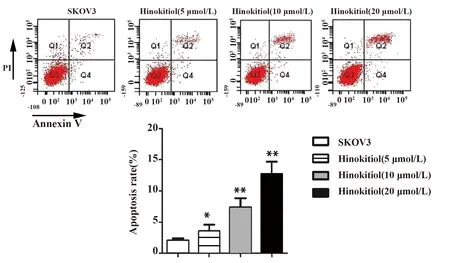
图3 桧木醇对SKVO3细胞凋亡的影响Fig.3 Cell apoptosis was detected by flow cytometry after treated by hinokitiol in SKOV3 cellsNote: Cell apoptosis was measured by flow cytometry.Data are expressed as the vs SKOV3 group.

图4 桧木醇对LC3、Beclin1和P62表达的影响Fig.4 Expression of autophagy factors were detected after treated by hinokitiol in SKOV3 cellsNote: LC3,Beclin1 and P62 were detected using Western blot analysis.Data are expressed as vs SKOV3 group.

图5 桧木醇对LC3在细胞质中表达的影响Fig.5 Distribution of LC3 in SKOV3 cells after treated by hinokitiolNote: Immunofluorescence was performed for expression of LC3.Data are expressed as the vs SKOV3 group.
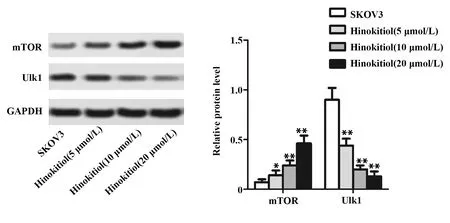
图6 桧木醇对mTOR信号通路的影响Fig.6 Activation of mTOR signaling pathway factors were detected by Western blotNote: mTOR and Ulk1 were measured by Western blot.Data are expressed as the vs SKOV3 group.
3 讨论
卵巢癌是女性常见的恶性肿瘤之一,由于早期的无症状表现、化疗抵抗性和高复发率导致卵巢癌患者死亡率居高不下[9]。桧木醇是一类天然产物提取物。研究表明,桧木醇在抗炎、抗菌、抗真菌和抗病毒方面具有较强活性,同时还能抑制多种癌细胞细胞系增殖,如黑色素瘤、前列腺癌、口腔癌和结肠癌等[10]。大量研究表明,桧木醇对癌细胞生长抑制的有效浓度为5~800 μmol/L[11,12]。考虑到桧木醇的生物利用率和抑癌活性,本研究选择了5、10、20 μmol/L 3个浓度进行试验。结果表明,桧木醇还能明显抑制卵巢癌细胞生长,降低卵巢癌细胞SKOV3的增殖倍数,减少集落形成细胞数。同时,桧木醇还能升高卵巢癌SKOV3细胞凋亡率。癌细胞凋亡抑制是癌症发生和发展的机制之一,通过诱导癌细胞凋亡以减缓癌症的病理进程[13]。提示桧木醇能通过抑制卵巢癌SKOV3细胞增殖、诱导癌细胞凋亡来抑制卵巢癌的发展。
自噬是真核细胞内的降解自身受损细胞器及细胞质蛋白质的过程,在维持体内环境稳定过程中发挥着重要作用[14]。在营养缺乏等应激条件下,机体可通过自噬重新利用蛋白质和脂肪降解后的营养物维持细胞存活[15]。研究表明,自噬在癌症的发生发展过程中具有重要调控作用。在癌症发生初期,自噬能通过抑制癌变基因的表达抑制肿瘤形成[16]。但在癌症发生发展过程中,自噬可通过为肿瘤组织血管新生提供营养物质和抵抗药物对癌细胞的毒性促进癌症发展[17,18]。诱导自噬可促进卵巢癌对药物顺铂化疗抵抗的形成[19]。因此,近年来自噬被认为是癌症治疗的靶标之一。自噬始于自噬小体的形成,LC3是自噬小体双膜形成和延伸的重要蛋白,因此其在细胞膜上的表达被作为自噬小体形成的标志[20]。Beclin1也是自噬小体形成的重要蛋白之一,主要负责自噬小体形成相关蛋白的招募,同时还能通过诱导抗凋亡蛋白Bcl-2表达抑制癌细胞凋亡,敲除Beclin1基因能增加小鼠卵巢癌的发病率[21]。自噬小体形成后会与溶酶体结合,形成自溶酶体,在P62等蛋白质的参与下被溶酶体催化酶催化降解[22]。本文采用免疫印迹及免疫荧光检测LC3、Beclin1和P62在卵巢癌SKOV3细胞中的表达,探究桧木醇对卵巢癌细胞自噬的影响。结果表明,桧木醇能显著降低SKOV3细胞LC3Ⅱ/LC3Ⅰ和 Beclin1的蛋白表达水平,并诱导P62表达。同时,免疫荧光结果表明,LC3在细胞膜的阳性表达明显减少。以上结果均表明,桧木醇能抑制卵巢癌SKOV3细胞自噬,从而抑制癌细胞增殖、诱导细胞凋亡。
mTOR信号通路是调控自噬的经典通路之一,自噬激活依赖于mTOR表达抑制。mTOR活性抑制可诱导ULK1蛋白磷酸化,促进LC3、Beclin1等自噬蛋白的招募,诱导自噬的发生[23]。研究表明,顺铂和氯喹联合用药可通过抑制腺苷酸激活的蛋白激酶(AMP-activated protein kinase,AMPK)活化促进mTOR磷酸化,从而抑制自噬,增强癌细胞对顺铂敏感性,减缓癌症发展[24];此外赵敏等[25]研究者也证明丹酚酸B可以通过mTOR/Ulk1信号通路诱导胶质瘤细胞自噬性死亡;詹慧芳等[26]也证明雷帕霉素可通过抑制mTOR/4E结合蛋白1(4E binding protein 1,4EBP1)激活自噬以改善过氧乙酰硝酸酯(Peroxyacetyl nitrate,PAN)诱导的足细胞损伤。本文研究发现,桧木醇能显著升高mTOR表达水平,降低Ulk1表达水平,表明桧木醇可调控卵巢癌SKOV3细胞mTOR信号通路的激活。
综上所述,桧木醇能降低卵巢癌SKOV3细胞增殖倍数,抑制细胞克隆形成并诱导细胞凋亡,同时,桧木醇还能降低LC3Ⅱ/LC3Ⅰ和 Beclin1的蛋白表达水平,促进P62表达,并诱导LC3在细胞膜表达;此外,桧木醇还能升高mTOR表达水平,降低Ulk1表达水平,表明桧木醇能抑制卵巢癌SKOV3细胞自噬,从而抑制细胞增殖、诱导细胞凋亡,作用机制与调控mTOR通路激活有关。本文研究首次探究了桧木醇对卵巢癌细胞增殖、凋亡及自噬的作用,为卵巢癌的治疗提供了新的潜力药物。
