贵州省辣椒品种辣椒素含量控制基因克隆研究
2019-08-12韩畅蒋琪高智席吕朝燕胡海军古荣斌
韩畅 蒋琪 高智席 吕朝燕 胡海军 古荣斌

摘 要 对16份贵州省主要辣椒品种的辣椒素含量进行鉴定,并成功克隆了导致辣椒素含量差异性状的PUN1(AT3)基因的2个等位基因(AT3-D1和AT3-D2)。实验结果表明:在16个辣椒品种中,辣椒素含量最高的是单生理想和正椒12号,分别达到3 323.11 ng·mL-1和3 160.52 ng·mL-1;最低的是干椒3号和辛香15号,分别只有759.3 ng·mL-1和583.28 ng·mL-1。选取单生理想和辛香15号作为材料克隆控制辣椒素含量的关键基因(AT3-D1和AT3-D2),AT3-D1比AT3-D2在蛋白质的N端少了100个氨基酸,但是在此后序列中具有较高的同源性,整体一致性达到67.35%;二者的蛋白分子量分别为37.79 kD和49.68 kD,等电点(pI)分别为6.95和7.09,均属于稳定蛋白和非分泌蛋白,且都不属于跨膜蛋白。
关键词 辣椒素;高效液相色谱;pun1基因;基因克隆
中图分类号:S641.3 文献标志码:B DOI:10.19415/j.cnki.1673-890x.2019.08.078
辣椒(Capsicum annuum L.)在我国拥有较大的种植面积,其辛辣刺激的口味深受广大消费者喜爱,且其本身具有丰富的维生素C,因此具有较高的营养价值和经济价值。辣椒辣味程度的高低主要由辣椒素(Capsaicin)[(反式)8-甲基-N-香草基-6-壬烯酰胺]含量的高低决定[1],而辣椒素在医疗上被用于消炎、止痛以及治疗肌肉酸痛等。目前已发现的辣椒素类物质有20多种,其中占辣椒果实中总辣椒素类物质含量的80%以上的主要成分是辣椒素(Capsaicin)和二氢辣椒素(Dihydrocapsaicin)[2],超过50个基因家族参与了辣椒素类物质的生物合成[3]。辣椒辣味的有无为质量性状,由显性Pun1(最早用C表示)基因位点控制。该基因编码辣椒酰基转移酶(Acyltransferase,AT),亦即辣椒素合成酶(Capsaicin synthase,CS)[4]。辣椒辣味的强弱呈数量性状特征,并受栽培环境等因素的影响[5],目前已经通过重组自交系构建的物理图谱得到了多个与辣椒素含量相关的基因位点[6]。辣椒辣味的强弱即辣椒素类物质含量的多少,目前主要通过高效液相色谱(HPLC)进行检
测[7]。基于辣椒素含量对辣椒品质影响及辣椒产业对贵州省农业经济的重要性,本研究主要对贵州省的主要的辣椒品种的辣椒素含量开展调查以及对合成辣椒素的关键基因Pun1基因进行克隆,为今后通过分子育种手段提高辣椒品种中辣椒素含量奠定基础。
1 材料与方法
1.1 材料
本实验分别选取大方辣椒、辣丰8号、辛香15号、干椒3号、卓香908和花溪辣椒等线椒品种,成都8号、遵辣1号、遵辣6号、遵椒4号、单生理想、正椒12号、艳椒425、卓椒18号、朝阳1号、珠子椒等朝天椒品种共16个辣椒品种作为供试材料。
1.2 方法
1.2.1 辣椒素含量的测定
根据韩晓岚等[8]的方法对供试辣椒品种中的辣椒素和二氢辣椒素进行提取,提取后的样品通过过滤处理,使用高效液相色谱(HPLC)对其辣椒素类物质进行含量测定。
1.2.2 辣椒素含量控制关键基因Pun1的克隆
1.2.2.1取样
通過辣椒素含量测定从16份供试材料中鉴定出高辣椒素含量和低辣椒素含量品种,并将其种植于遵义市农业科学研究院试验基地中,待开花后开始取样。
1.2.2.2辣椒素合成酶Pun1基因克隆
以开花后25天的辣椒果实为材料提取总RNA,通过试剂盒逆转录合成cDNA链,依据NCBI中遵辣1号基因组中辣椒素合成酶基因(AT3基因)mRNA序列设计引物,Pun1F:ATGGCTTTTGCATTACCATC,Pun1R:TTAATTAGGCAATGAACTCAAGG。以cDNA链为模板进行扩增。PCR反应体系为:5 μL 10×buffer,6 μL dNTPs,0.5 μL Extaq DNA聚合酶,2 μL Pun1F,2 μL Pun1R(各25 pmol·μL-1),1 μL DNA模板链,加水至50 μL。PCR反应程序为:95 ℃ 3 min预变性,95 ℃ 1 min,50 ℃ 50 s,72 ℃ 75 s,30个循环,最后72 ℃ 5 min延伸。PCR扩增产物经1%凝胶电泳回收后连接到pUC19载体上,转化大肠杆菌,挑选3个重组子检测并送到华大基因公司测序。序列拼接采用DNAMAN8.0,序列比对采用Blast进行。
2 结果与分析
2.1 辣椒素含量的测定
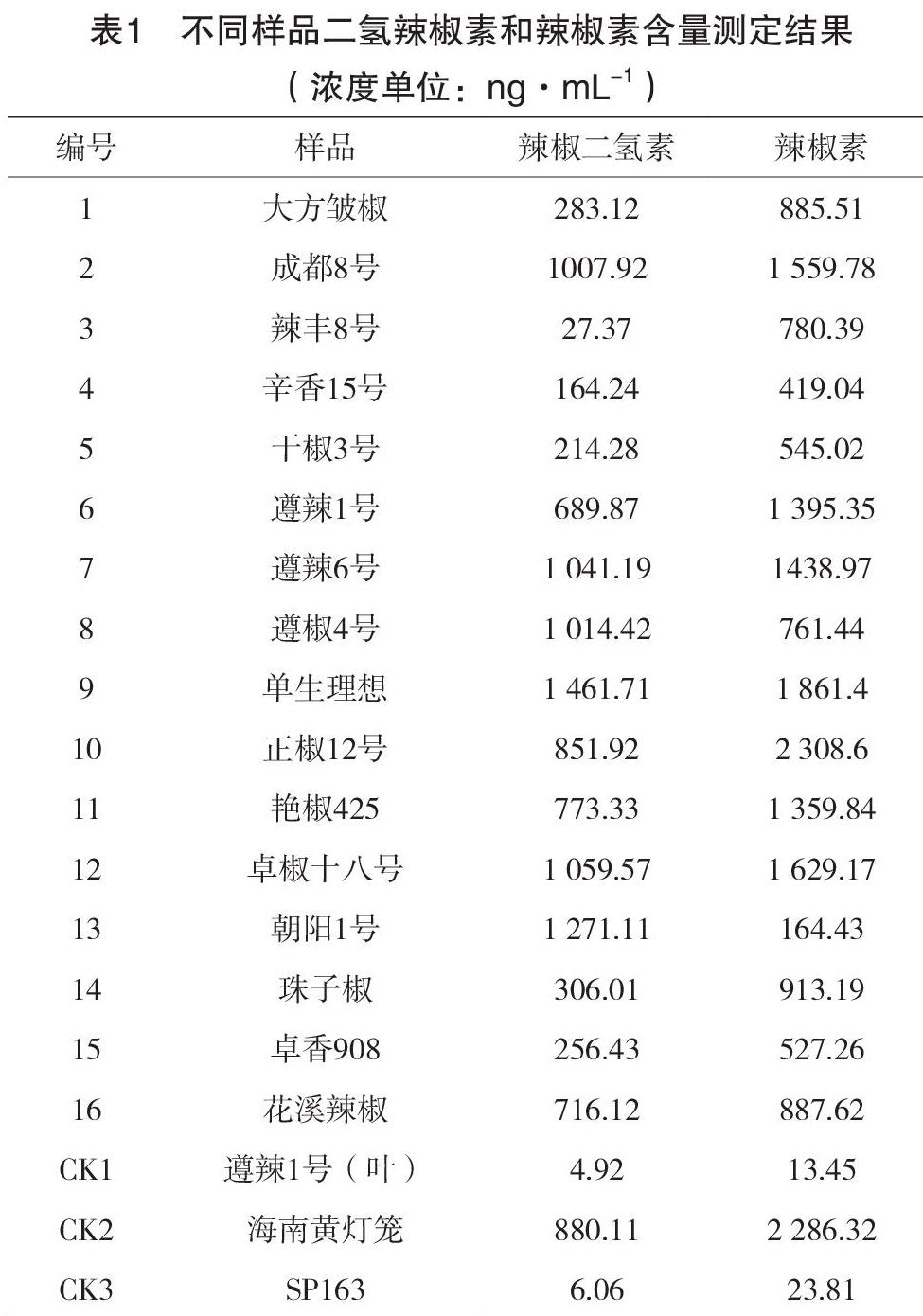
利用高效液相色谱法对16份辣椒品种进行辣椒素含量测定,测定过程中加入遵辣1号的叶片、海南黄灯笼果实和SP163(甜椒品种)果实等3个对照,由表1可知,遵辣1号的叶片辣椒二氢素+辣椒素浓度最低,其次是SP163果实,最高的是海南黄灯笼果实。三个对照检测的结果皆与实际辣味程度相符,故该方法适用于检测辣椒素含量。在检测的16个品种中,朝天椒类型品种果实中的二氢辣椒素+辣椒素浓度较线椒高,其中单生理想和正椒12号较高,分别达到3 323.11 ng·mL-1和3 160.52 ng·mL-1;线椒中干椒3号和卓香908较低,分别只有759.3 ng·mL-1和783.69 ng·mL-1。
2.2 辣椒素含量控制关键基因Pun1的克隆
根据上述辣椒品种辣椒素含量测定的结果,分别选取单生理想和辛香15号两种辣椒素含量表现极端差异的辣椒品种作为克隆Pun1基因的供试材料。
2.2.1 辣椒果实总RNA的提取
本实验使用QIAGEN公司生产的柱式RNA提取试剂盒分别提取单生理想和辛香15号辣椒果实总RNA。随后用TAKARA公司的cDNA第一链合成试剂盒进行反转录生成cDNA。
2.2.2 基因全长cDNA序列获得
参考已发布的遵辣1号辣椒基因组中的辣椒素合成相关基因Pun1基因(AT3基因)的两个等位基因(AT3-D1和AT3-D2)序列信息,以此设计引物,以获得的cDNA为模板进行PCR扩增,在两个辣椒素含量表现极端差异的辣椒品种中均扩增得到2个目标条带,其大小分别为1 400 bp和1 100 bp,利用DNAMAN软件对两个序列进行分析,结果表明两条序列各自含有一段1 326 bp和1 017 bp的编码区(见图1)。
2.2.3 Pun1蛋白生物信息学分析
经生物学软件分析发现AT3-D1和AT3-D2基因编码的肽链长度分别为338和441个氨基酸,AT3-D1比AT3-D2在蛋白质的N端少了100个氨基酸,但是在此后具有较高的同源性,一致性达到67.35%。用ExPASy ProtParam tool在线工具对上述两个蛋白进行生物信息学分析,结果表明其分子量分别为37.79 kD和49.68 kD,等电点(pI)分别为6.95和7.09,元素组成分别为C1677H2670N452O499S20和C2227H2484N590O655S21,不稳定系数分别为32.28和39.34,均属于稳定蛋白。
利用在线工具TMHMM对AT3-D1和AT3-D2蛋白进行跨膜区在线分析发现,AT3-D1和AT3-D2蛋白不是一个跨膜蛋白。应用SignalP 4.1在线软件对AT3-D1和AT3-D2蛋白的信号肽进行分析,结果表明该蛋白不存在信号肽,推测其为一个非分泌蛋白。
3 结论与讨论
3.1 PUN1基因在辣椒素合成途径中的重要作用
辣椒辣味的有无为质量性状,由显性Pun1基因位点控制,该基因编码辣椒酰基转移酶,亦即辣椒素合成酶,在辣椒素合成酶(CS)催化作用下,香草基胺(苯丙氨酸途径合成)和8-甲基-6-癸烯酰(支链脂肪酸途径合成)缩合形成辣椒素,Pun1基因的突变导致辣椒辣味的丢失。因此,Pun1基因控制的辣椒素合成酶是整个辣椒素合成的最后一个步骤,也是一个限速步骤,该基因功能的发挥直接影响到辣椒素合成的数量和质量,因此其在辣椒素合成途径中发挥着重要作用。
3.2 Pun1基因在调控辣椒素含量差异上的具体作用机制
覃成等发现在没有辣味或者辣度极低的辣椒中AT3-D1基因有长度不等的片段缺失,但是AT3-D2基因却正常表达,并且这些辣椒果实中仍然存在痕量的辣椒素,这可能是由AT3-D2基因负责合成的,因此推测这两个基因通过它们的协同作用合成并积累不同含量的辣椒素,进而决定不同品种辣椒的辣度。本实验中,在辣椒素含量高和含量低的辣椒品种中均克隆到AT3-D1和AT3-D2基因,证实了覃成等人的推测,但是AT3-D1中未发现有缺失的片段,该现象可能与本次所选的辣椒品种仍具有一定的辣度有关,应进一步选择甜椒品种加入实验作为阴性对照,来验证相关假说。辨明辣椒素合成的生物机制以及在整个合成机制中参与的重要基因及其生物功能是一个具有重要理论价值兼具重大应用价值的课题。在诸多辣椒科研工作者的共同努力下,现已初步辨明其作用机制,但是由于其整个系统的复杂性,该项工作还将在今后很长的一段时期作为研究的重点。
参考文献:
[1] Caterina M J,Schumacher M A.The Capsaicin Receptor:A Heat-activated Ion Channel in the Pain Pathway[J].Nature,1997,389(6653):816-824.
[2] Bosland P W,Votava E J.Peppers:Vegetable and Spice Capsicums[J].Cabi Bookshop,2000(2):14-39.
[3] Qin C,Yu C,Shen Y,et al.Whole-genome Sequencing of Cultivated and Wild Peppers Provides Insights into Capsicum Domestication and Specialization[J].Proc Natl Acad Sci U S A,2014,111(14):5135-5140.
[4] Blum E,Liu K,Mazourek M,et al.Molecular Mapping of the C Locus for Presence of Pungency in Capsicum[J].Genome,2002,45(4):702-705.
[5] Blum E,Mazourek M,OConnell M A,et al.Molecular Mapping of Capsaicinoid Biosynthesis Genes and Quantitative Trait Loci Analysis for Capsaicinoid Content in Capsicum[J].Theoretical and Applied Genetics,2003,108(1):79-86.
[6] Ben-Chaim A,Borovsky Y,Falise M,et al.QTL Analysis for Capsaicinoid Content in Capsicum[J].Theoretical and Applied Genetics,2006,113(8):1481-1490.
[7] Collins M D,Wasmund L M,Bosland P W.Improved Method for Quantifying Capsaicinoids in Capsicum Using High-performance Liquid Chromatography[J].Hort Science,1995(30):137-139.
[8] 韓晓岚,胡云峰,赵学志,等.高效液相色谱法测定辣椒素及二氢辣椒素[J].中国食物与营养,2009(11):43-46.
(责任编辑:赵中正)
