AR和SKP2在三阴性乳腺癌中的表达及临床意义
2019-08-12郑唯强
刘 娟 郑唯强
三阴性乳腺癌(triple-negative breast cancer,TNBC)是ER、PR、HER-2均阴性表达的一组乳腺癌亚型,约占浸润性乳腺癌的10%~20%,属于高度异质性肿瘤,具有发病年龄小、侵袭性强、复发率高、临床分期高、组织学级别高等临床病理特征,在完成联合化疗后的前3~5年复发转移风险高,主要为肺、肝、脑等重要器官的转移[1]。由于缺乏受体的表达,内分泌治疗及靶向治疗对TNBC均无明显疗效,相对于其他类型的浸润性乳腺癌,TNBC具有更差的预后,因此成为乳腺癌研究领域的热点和难点。
雄激素受体(androgen receptor,AR)在正常乳腺组织和乳腺癌组织均广泛表达,在ER阳性的乳腺癌,AR阳性表达显示较好的预后;但在ER阴性乳腺癌组,AR表达与预后的关系存在争议。S期激酶相关蛋白2(S-phase kinase-associated protein2,SKP2)在浸润性乳腺癌中高表达,且与较差的预后相关,但在TNBC中研究甚少。雄激素双氢睾酮和SKP2的结合与增加P27的降解有关,这说明了SKP2与性激素存在一定的关系,但是否与AR表达状态有关还不清楚。基于以上原因,本研究旨在分析TNBC中AR、SKP2表达与不同临床病理特征的关系,同时对两者进行相关性分析,以期为寻找TNBC的治疗新靶点提供理论基础。
材料与方法
1.标本来源:收集笔者医院2010~2015年病理确诊为TNBC并具有完整临床病理资料的石蜡标本96例,同时选取35例乳腺良性病变(乳腺腺病、纤维腺瘤)做为对照。所有病例均重新调阅档案资料,由高年资病理医师复核切片。所有标本均经4%甲醛固定,石蜡包埋,连续切片并HE染色。在纳入本实验的TNBC样本中,随机选取20例对应的新鲜肿瘤组织及5例距肿瘤组织>5cm的癌旁乳腺组织。所有新鲜标本均在病变组织离体30min内取材,冻存于-80℃冰箱备用。纳入本实验的TNBC具体标准如下:①所有病例都需具有完整的临床病理资料;②所有患者均为初诊手术;③术后病理确诊为TNBC;④术前未行任何内分泌治疗或新辅助化疗。
2.主要试剂:组织芯片预铸蜡块购于UNITMA公司;鼠抗人单克隆抗体AR(克隆号AR441)购于基因公司,兔抗人单克隆抗体SKP2[克隆号EPR3305(2)]购于英国Abcam公司,PrimeScriptTM RT reagent Kit(for real-time)反转录试剂盒、SYBR®Premix Ex TaqTMⅡ PCR试剂盒购自日本TaKaRa公司。
3.方法:(1)免疫组织化学(immunohistochemistry,IHC)技术是利用抗原抗体特异性结合的原理对组织细胞内的蛋白进行定性、定位或半定量的研究,该技术组织形态学保存完整,蛋白定位直观清晰,在进行形态与功能相结合的研究时具有重要意义;石蜡包埋标本能长期保存,连续切片。因此笔者对96例TNBC及35例良性乳腺病变的石蜡包埋标本采用了IHC法检测AR、SKP2的蛋白表达情况:1)为避免传统石蜡切片进行IHC时出现的费时费力、染色结果存在批次时间误差等缺点,本实验将所有纳入的石蜡包埋标本制成组织芯片。根据HE切片选取1~2个典型的肿瘤区域,在原始蜡块上标记相应的打孔位置。构建10×6的微阵列设计图,在原始蜡块的标记位置钻取直径2mm的组织芯1~2 条,严格按照微阵列设计图包埋组织芯。将组织芯片以3μm厚度连续切片,裱于涂胶玻片备用。2)按照IHC中的Envision两步法检测AR、SKP2。用PBS代替一抗作为阴性对照,用已知AR阳性的睾丸组织和Skp2阳性的肾透明细胞癌作阳性对照。(2)Western blot法是对组织细胞内提取的蛋白凝胶电泳处理后,用特异性的抗体检测某特定抗原的一种蛋白质定量检测技术。本实验对20例新鲜TNBC及5例对照癌旁组织采用Western blot法检测组织内AR、SKP2蛋白的表达情况:①取50mg冻存组织剪细后RIPA冰浴下匀浆,低温高速离心后取上清液,BCA法测定蛋白浓度;②取等量蛋白水煮变性后依次恒压电泳、转膜;③脱脂奶粉封闭,滴加一抗(AR 1∶200; SKP2 1∶1000)、二抗,摇床孵育,ECL显色;④暗室曝光,扫描成像。内参为GAPDH。(3)RT-PCR是以mRNA反转录产生的cDNA为模板进行实时荧光PCR扩增以检测目的基因表达水平的一种分子定量技术。本实验拟采用该技术对20例新鲜TNBC及5例对照癌旁组织检测AR、SKP2的mRNA表达情况:①根据NCBI网站公布人类AR、SKP2基因序列设计引物(表1),引物由上海轶沤生物科技公司合成;②取50mg冻存组织剪细后相继加入TRIzol、氯仿、异丙醇抽离总RNA,洗涤干燥后溶解RNA并测定浓度;③按照反转录试剂盒说明合成cDNA;④以cDNA为模板根据PCR试剂盒说明进行扩增。所有样本均设3个复孔,结果取3次平均值,每次反应均设空白对照,内参为GAPDH。该实验重复3次。

表1 RT-PCR实验AR、SKP2引物序列
4.结果判读:(1)免疫组化结果判读:AR、SKP2阳性表达为定位于细胞核的棕黄色或棕褐色信号。采用H-score对染色结果进行半定量分析,总分>2分为阳性表达[2]。(2)Western blot法检测结果判读:根据蛋白条带灰度显色结果比较样本AR、SKP2的表达。(3)RT-PCR结果判读:根据2-△Ct观察样本AR、SKP2的相对表达。
5.统计学方法:实验结果采用SPSS 20.0统计学软件进行统计分析。AR和SKP2的组间比较采用χ2检验,两者相关性分析采用Spearman等级相关分析检验,以P<0.05为差异有统计学意义。
结 果
1.AR、SKP2蛋白在TNBC及乳腺良性病变中的表达:96例TNBC组织中AR阳性表达为18例,SKP2阳性表达为42例;35例良性乳腺病变中AR阳性表达为14例,SKP2均阴性表达(图1、图2)。

图1 TNBC癌组织中AR的表达(IHC Envision法,×200)
A.阴性表达;B.阳性信号定位于胞质,为阴性表达;C.阳性信号定位于胞核和胞质,为阳性表达;D.AR弱阳性表达;E.AR中等强度表达;F.AR强阳性表达
2.AR、SKP2表达与TNBC不同临床病理因素的相关性:在TNBC中,AR的阳性表达与淋巴结转移状态显著相关(P<0.05),无淋巴结转移的肿瘤组AR的阳性表达率较高。AR的表达与发病年龄、肿瘤直径、组织学级别以及脉管/神经侵犯状态无显著相关性(P>0.05)。SKP2的阳性表达与组织学级别、神经/脉管侵犯状态显著相关(P<0.05),组织学级别较高的肿瘤组其SKP2的阳性表达率较高,有神经/脉管受累的肿瘤组SKP2的阳性表达率也较高。SKP2的表达情况与年龄、肿瘤直径、淋巴结转移状态无相关性(P>0.05,表2)。

图2 TNBC癌组织中SKP2的表达(IHC Envision法,×200)
A.阴性表达;B.阳性信号定位于胞质,为阴性表达;C.阳性信号定位于胞核和胞质,为阳性表达;D.SKP2弱阳性表达;E.SKP2中等强度表达;F.SKP2强阳性表达
表2 AR、SKP2表达在TNBC中与各组临床病理因素的关系[n(%)]
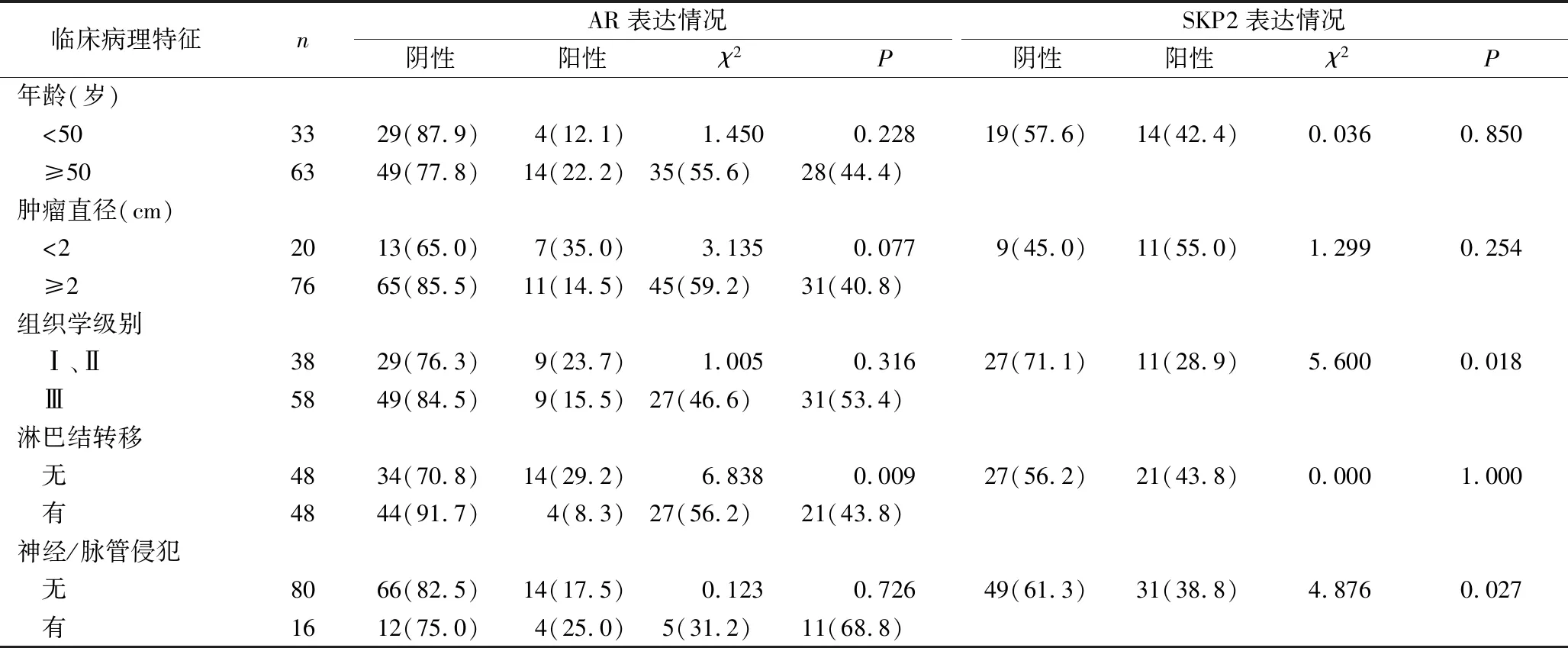
临床病理特征nAR表达情况SKP2表达情况阴性阳性χ2P阴性阳性χ2P年龄(岁) <503329(87.9)4(12.1)1.4500.22819(57.6)14(42.4)0.0360.850 ≥506349(77.8)14(22.2)35(55.6)28(44.4)肿瘤直径(cm) <22013(65.0)7(35.0)3.1350.0779(45.0)11(55.0)1.2990.254 ≥27665(85.5)11(14.5)45(59.2)31(40.8)组织学级别 Ⅰ、Ⅱ3829(76.3)9(23.7)1.0050.31627(71.1)11(28.9)5.6000.018 Ⅲ5849(84.5)9(15.5)27(46.6)31(53.4)淋巴结转移 无4834(70.8)14(29.2)6.8380.00927(56.2)21(43.8)0.0001.000 有4844(91.7)4(8.3)27(56.2)21(43.8)神经/脉管侵犯 无8066(82.5)14(17.5)0.1230.72649(61.3)31(38.8)4.8760.027 有1612(75.0)4(25.0)5(31.2)11(68.8)
3.AR、SKP2在TNBC及良性乳腺病的表达:在35例良性乳腺病变组织中AR的阳性率为40.0%,在96例TNBC组织中AR的阳性率为18.8%,其阳性表达率相对较低(P<0.05)。SKP2在35例良性乳腺病变组织中均阴性表达,在96例TNBC中的阳性率为43.8%,其阳性表达率差异有统计学意义(P<0.05,表3)。
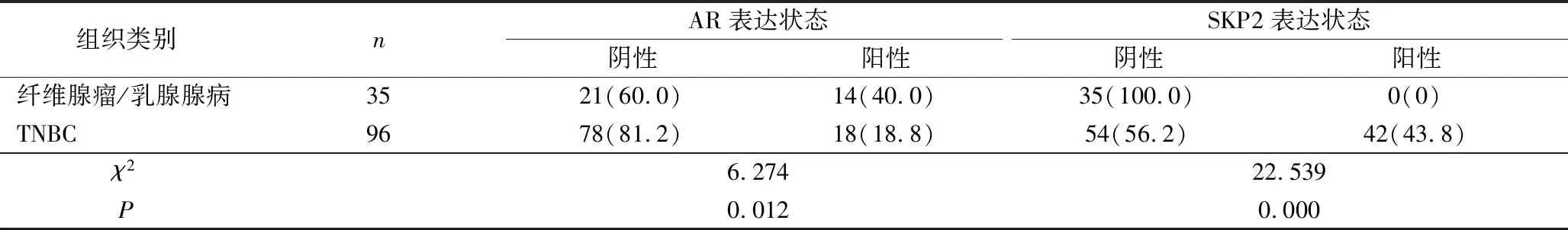
表3 AR、SKP2表达在TNBC和纤维腺瘤/腺病的关系[n(%)]
4.对AR、SKP2表达在TNBC中的相关性分析:经Spearman相关性分析,AR与SKP2在TNBC中显著相关(r=0.222,P=0.030,表4)。
5.Western blot法检测AR、SKP2蛋白在TNBC及癌旁乳腺组织的表达:20例TNBC中AR、SKP2高表达的各8例,AR、SKP2共同高表达的为3例;5例癌旁乳腺组织有3例AR高表达,SKP2 均弱表达或不表达(图3)。

表4 AR、SKP2表达在TNBC中相关性分析[n(%)]

图3 Western blot法检测显示TNBC癌旁乳腺组织及癌组织AR、SKP2蛋白表达
样本编号48P、90P、97P、11P、74P为对照组癌旁乳腺组织,其余为实验组TNBC癌组织
6.RT-PCR检测AR、SKP2 mRNA在TNBC及癌旁乳腺组织的表达:20例TNBC中AR、SKP2高水平表达的组织均为8例,其中AR、SKP2共同高表达的组织有3例;5例癌旁乳腺组织有3例AR高水平表达,SKP2均低水平表达(图4、图5)。
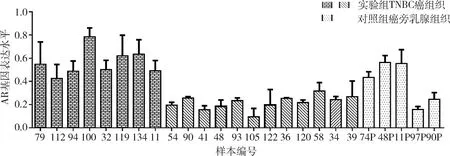
图4 RT-PCR显示AR基因在TNBC癌旁乳腺组织及癌组织的相对表达

图5 RT-PCR显示SKP2基因在TNBC癌旁乳腺组织及癌组织的相对表达
经检验上述3种不同实验方法从蛋白水平、分子水平对TNBC组织的AR、SKP2检测结果基本一致。
讨 论
在过去的几十年里,TNBC的治疗方案进展甚微,目前主要的治疗方案仍为常规化疗,但疗效常常不佳,仍易发生早期复发和远处转移,针对TNBC进行更精准的个性化治疗至关重要,因此寻找新的治疗靶点也成为TNBC研究领域的热点和难点。
AR属于类固醇激素受体家族的成员,是配体依赖性的反式转录调节蛋白,基因编码位于Xq11.12,相对分子质量为110000,具有4个独特功能域:① 与转录激活相关的氨基末端结构域(NTD),即配体独立激活功能域;②DNA结合域(DBD),由2个Zn2+和8个半胱氨酸形成一对与雄激素反应元件相互作用的锌指构成;③配体结合域(LBD),为受体与激素结合的区域;④铰链区(flexible hinge),为连接DNA结合域与配体结合域,调控核定位。未结合配体的AR以非激活形式存在于细胞质,与热休克蛋白HSP70与90形成复合物;与配体结合的AR则发生构象变化而活化,与热休克蛋白解离,转位至细胞核,与雄激素反应元件(ARE)相结合,同时与其他转录因子相互作用,调控下游靶基因的转录与翻译,从而实现雄激素对靶细胞的调控。若AR缺失,则雄激素对组织无刺激反应。
在ER阳性的乳腺癌,AR的阳性表达常常显示更好的预后[3]。但在ER阴性的乳腺癌,尤其是TNBC,AR与预后的关系存在较大的争议。有研究表明,AR的阳性表达显示更差的预后[4];也有研究提示AR表达与预后无明显相关,各临床病理特征在AR的差异性表达下并没有明显区别,多数研究认为,AR阳性表达与更好的预后相关[5~7]。本研究中,AR在TNBC中的阳性表达率为18.8%,与大多数文献报道的10%~36%相近,同时也证实了AR的阳性表达在TNBC中显示更好的预后相关,无淋巴结转移的TNBC中AR更易阳性表达[4,8]。
关于AR在TNBC中表达及意义,部分统计结果出现差异性的原因可能与以下几个方面有关:①研究的样本量相对较少;②研究对象存在差异:不同实验室对ERα、PR、HER-2的人工判读可能存在差异,进而导致对TNBC的筛选出现差异;③肿瘤的异质性:同一个例乳腺癌组织不同区域可能出现不同的免疫表型;④AR检测中存在差异:测定AR存在实验室环境、抗体种类及技术操作的不同;⑤AR阳性的cut-off值不同:不同研究对AR阳性细胞所占比例的统计数值选取不同。
在TNBC中,AR可能会模仿ERα效应成为致癌因子,刺激肿瘤的增殖[9]; AR阳性的TNBC通常携带PI3KCA突变,对PI3K/mTOR抑制敏感,促进乳腺癌细胞的增殖[10];同时通过磷酸化AKT作用的AR磷酸化可以消除AR诱导的凋亡效应,促进肿瘤的发展。以上可能是AR在TNBC阳性表达显示更差预后的原因,为采用AR作为TNBC治疗新靶位提供了理论依据。也有研究表明,AR的阳性表达可诱导PTEN抑制PI3KCA的激活,同时PTEN与蛋白killing作用可诱导P53、P73表达增加,导致乳腺癌细胞生长抑制和凋亡增加,因此AR在TNBC中的抗增殖作用可能是AR阳性的TNBC患者显示较好预后的原因[11]。总体说来,由于TNBC发病机制的复杂性,AR信号通路与其他信号通路在TNBC中存在复杂的交互作用,这些都可能是AR在TNBC的表达与预后关系的研究出现差异性结果的原因。
由于TNBC缺乏明确的内分泌或靶向治疗的受体,但却有约1/3的TNBC患者显示AR的阳性表达,且在不同亚型的TNBC中AR的表达与预后存在明显差异,因此参照AR抑制剂应用于前列腺癌的治疗研究,在乳腺癌研究领域涌现了大量关于AR抑制剂应用于TNBC的研究。其中研究较多的是比卡鲁胺、恩杂鲁胺、阿比特龙,多项实验证明AR抑制剂在AR+的TNBC中能有效地抑制肿瘤细胞的增殖,增加细胞凋亡,减缓疾病进程[12]。总之这些研究都不同程度地指出了针对AR的靶向药物在改善TNBC预后方面的积极意义,因此AR也可能成为TNBC的潜在治疗靶点,虽然AR在TNBC中的具体作用机制还有待进一步研究,但这仍为寻找治疗TNBC新途径提供了新思路。
S期激酶相关蛋白2(S-phase kinase-associated protein2,SKP2)是泛素蛋白连接酶复合物SCF(SKP1-Cullin1-F-box)中的一种F-box蛋白亚基,其基因编码位于5p13,相对分子质量约为47000。SKP2作为泛素-蛋白酶体途径(ubiquitin-proteasome pathway,UPP)中是一种重要的调节因子,介导泛素连接酶(E3)对磷酸化的底物(主要是CKI,如P21、P27、P57等多种细胞周期蛋白)进行特异性识别,进而底物被蛋白酶体迅速降解。SKP2在细胞周期的G0/G1期几乎不表达,S期表达增加,在细胞的增殖、凋亡以及细胞正常周期进程中发挥关键调控作用。SKP2的过表达会引发泛素蛋白酶途径对CKI的降解增强,导致P27、P57等周期抑制蛋白的降低,进而对G1/S调控点的抑制作用减弱,细胞增殖加速及分化紊乱,因此SKP2属于一种原癌基因,它的激活能够导致肿瘤的发生。
SKP2高表达与许多恶性肿瘤的发生、进展密切相关。Fagan-Solis等[13]发现SKP2在浸润性乳腺癌中显著高表达,ERα阴性的乳腺癌中SKP2阳性率高于ERα阳性的乳腺癌;ERα阴性的乳腺癌中,TNBC中SKP2的表达率比非TNBC的表达率更高。Meta分析提示SKP2的表达与预后呈负相关,SKP2的高表达使肿瘤更具侵袭性,是乳腺癌不良预后的独立因素[14]。研究指出SKP2在乳腺上皮细胞中具有致癌潜能,在ERα阴性的乳腺癌中的表达与肿瘤的分级、细胞周期调控基因的表达呈正相关[15]。在浸润性乳腺癌中细胞系实验也证实了SKP2能抑制细胞凋亡,改变细胞周期分布状态,诱导S期细胞增多,从而促进乳腺癌细胞的增殖[16]。关于SKP2在TNBC中表达的研究较少,笔者的研究结果显示SKP2在TNBC的阳性表达率为43.8%,显著高于良性对照组,SKP2的表达与预后呈负相关,在组织学级别较高、有脉管/神经累犯的TNBC中SKP2的阳性表达率较高。体外细胞系实验证实SKP2抑制剂可诱导乳腺癌细胞的凋亡,抑制其增殖、侵袭及迁移,因此SKP2在TNBC中的高表达使其有可能成为TNBC的潜在治疗新靶点及评价预后新指标[17]。
在乳腺癌和卵巢癌中,SKP2可扮演雄激素双氢睾酮受体的角色,两者结合后直接作用于P27,导致P27降解增加,这一过程与底物P27是否磷酸化的状态无关。在去势抵抗的前列腺癌中,SKP2与AR显示正相关,SKP2的高表达可增加AR的转录及表达活性[18]。以上研究都表明SKP2与雄激素、AR存在一定的关系,在TNBC中关于AR、SKP2关系的研究甚少,笔者的实验结果显示AR和SKP2在TNBC中存在正相关,提示AR、SKP2在TNBC中的表达可能同受某因素的影响,但两者在TNBC中的具体关系仍需更多研究证实。
笔者采用免疫组化法、Western blot法及RT-PCR法 3种不同的实验方法分别对AR、SKP2从基因到蛋白水平进行检测,经验证3种实验方法结果基本一致;通过免疫组化对收集的所有TNBC及对照组织的检测结果进行分析,揭示AR、SKP2在TNBC表达与各临床病理特征的意义,同时AR、SKP2在TNBC的较高表达提示它们有可能成为评价TNBC预后的潜在新指标、治疗TNBC的潜在新靶点。当然由于TNBC发病机制的复杂性,AR、SKP2在TNBC中的具体信号通路还不是很清楚,两者在TNBC中的关系和表达特点还需要更深入的研究,相信随着TNBC研究领域的深入拓展,会为这类患者的治疗及预后带来新希望。
