不同花源蜂蜜蛋白质组分及提取方法的比较
2019-08-12张颖张光艳王宇翔曹炜
张颖,张光艳,王宇翔,曹炜
(西北大学 食品科学与工程学院,陕西 西安,710069)
蜂蜜是大自然赐予人类的珍贵礼品,富含葡萄糖、果糖、蛋白质、氨基酸、维生素、微量元素及酚类等多种营养物质,在抑菌、抗氧化、提高免疫力、抗突变和消炎等方面具有独特的生理功能[1-3]。我国是世界蜂蜜生产大国,洋槐蜜、荆条蜜、油菜蜜、枣花蜜、龙眼蜜等大宗单花种蜂蜜深受国内外消费者青睐。然而,现行蜂蜜标准中缺乏有效区分蜂蜜花源的内在质量指标,受利益因素驱使,在商品价值较高蜂蜜品种中掺入廉价蜂蜜的现象普遍存在[4-5]。因此,亟需加强对蜂蜜花源鉴别技术和方法的研究开发。
蜂蜜中约含有0.02%~0.5%蛋白质,近年来国内外一些研究表明,蛋白质可以作为蜂蜜中的特征内标成分,用来鉴别蜂蜜的花源、蜂种以及地理源[6-11]。IGLESIAS等采用快速蛋白质液相色谱分析西班牙花蜜和甘露蜜,发现两类蜂蜜中存在特有的蛋白色谱峰[7]。SONG等通过研究枇杷蜜与油菜蜜中植物源几丁质酶活性的差异,认为植物源几丁质酶可作为潜在的蛋白标志分子来识别枇杷蜜[9]。邓建军等分析了荞麦蜜和掺假荞麦蜜SDS-PAGE图谱的差异,认为从蛋白质角度可为鉴别蜂蜜真伪开辟一条新途径[11]。然而目前相关研究主要针对国外蜂蜜品种,有关中国各种特色蜂蜜中的蛋白质组成差异以及特征标识蛋白研究尚处于起步阶段。
因此,本文以枣花蜜、荆条蜜、龙眼蜜、土蜂蜜、洋槐蜜和油菜蜜为研究对象,首先通过考马斯亮蓝和银氨2种染色方法比较不同花源蜂蜜蛋白质电泳行为的差异;然后采用超滤法和硫酸-钨酸钠沉淀法提取蜂蜜蛋白质,利用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)和反相高效液相色谱(reversed-phase high performance liquid chromatography,RP-HPLC)分析2种蛋白质提取方法的适用性和分离效果,以期为探寻中国特色蜂蜜中蛋白质标识物、构建蜂蜜花源溯源和质量评价技术奠定理论基础。
1 材料与方法
1.1 材料与试剂
6种蜂蜜样品信息:枣花蜜采自陕西佳县(2016年)、荆条蜜采自河南辉县(2013年)、龙眼蜜采自广东茂名(2012年)、土蜂蜜采自陕西汉中(2015年)、洋槐蜜采自甘肃清水(2017年)、油菜蜜采自陕西汉中(2014年),所有蜂蜜从蜂场采集、运至实验室后于4 ℃保存待用。
低分子质量蛋白质Marker(14.4~97.4kDa),北京索莱宝科技有限公司;牛血清蛋白(纯度≥99%),美国Amresco公司;考马斯亮蓝G-250和R-250、丙烯酰胺、N,N-亚甲叉双丙烯酰胺、十二烷基硫酸钠、三羟甲基甲烷、甘氨酸,西安科昊生物工程有限公司;钨酸钠、三氟乙酸(色谱级)、乙腈(色谱级)、AgNO3、Na2CO3、乙二胺四乙酸二钠,天津科密欧化学试剂有限公司。
1.2 仪器与设备
BSA224S电子分析天平(精度0.1 mg),北京赛多利斯科学仪器有限公司;HH-S4电热恒温水浴锅,北京科伟永兴仪器有限公司;TGL-16G高速冷冻离机,上海安亭科学仪器厂;722G可见分光光度计,上海仪电分析仪器有限公司;8 400超滤杯,美国Millipore公司;Five easy plus pH计,梅特勒-托利多仪器(上海)有限公司;DYCZ-24双垂直蛋白电泳仪,北京六一仪器厂;FD-1冷冻干燥机,西安予辉仪器有限公司;U-3000高效液相色谱仪,美国Thermo Fisher Scientific公司。
1.3 方法
1.3.1 蜂蜜蛋白质含量测定
采用考马斯亮蓝法测定蜂蜜蛋白质含量[12]。100 μL不同浓度牛血清蛋白标准溶液与5 mL考马斯亮蓝G250溶液中混匀,室温下反应5 min,使用紫外/可见分光光度计于595 nm处测定吸光值,以吸光值为纵坐标,牛血清蛋白含量为横坐标绘制标准曲线。5 g蜂蜜溶于5 mL去离子水中,4 500 r/min下离心10 min,吸取100 μL上清液与5 mL考马斯亮蓝液中混匀,室温下反应5 min,于595 nm处测定吸光值,根据吸光值计算蜂蜜蛋白质含量。
1.3.2 超滤法提取蜂蜜蛋白质
参考WON等[13]方法对蜂蜜中蛋白进行超滤分离。90 g蜂蜜溶于90 mL去离子水,混匀后于4 500 r/min下离心10 min,收集上清液,置于截留分子质量3 500 Da透析袋中透析4次,透析结束后经5 000 Da滤膜超滤浓缩,收集浓缩蜂蜜蛋白液,然后真空干燥成冻干粉,置于-20 ℃保存备用。
1.3.3 硫酸-钨酸钠沉淀法提取蜂蜜蛋白质
参考AOAC方法[14]采用硫酸-钨酸钠沉淀法提取蜂蜜蛋白。12 g蜂蜜于50 mL离心管中,加入4 mL去离子水混匀,将2 mL 100 mg/mL钨酸钠溶液和2 mL 0.335 mol/L H2SO4溶液迅速混匀后,加到蜂蜜样品离心管中混匀,然后80 ℃水浴30 min,水浴过程中每隔5 min旋转离心管30 s,不断有絮状沉淀析出。水浴结束后,用水反复洗涤沉淀物5次,倒去上清液,将蜂蜜蛋白沉淀真空干燥成冻干粉,置于-20 ℃保存备用。
1.3.4 蜂蜜蛋白质SDS-PAGE分析
对于蜂蜜样品,6 g蜂蜜与去离子水1∶1混匀,进行或不进行离心处理(离心参数:4 500 r/min离心10 min), 取上清液备用;对于超滤法和钨酸钠沉淀法提取蜂蜜蛋白,称取蜂蜜蛋白粉0.1 g溶于2 mL去离子水备用。电泳参考CHEVALLET等方法[15]进行,采用4%浓缩胶和12%分离胶,将蜂蜜或蜂蜜蛋白溶液与样品缓冲液1∶1混合,沸水加热3~5 min,迅速冷却至室温,然后上样20 μL,Marker上样10 μL。 凝胶电泳电压开始设定为80 V,待进入分离胶后调整为120 V,电泳结束后进行考马斯亮蓝R250染色或银氨染色,终止显色后拍照。
1.3.5 蜂蜜蛋白质RP-HPLC分析
分别称取0.25 g超滤法和0.1 g钨酸钠沉淀法提取蜂蜜蛋白粉溶于1 mL超纯水,然后过0.45 μm滤膜,参考ZHANG等方法[16]并适当修正进行RP-HPLC分析。色谱条件:色谱柱:C18,5 μm,250 mm×4.6 mm i.d,80 Å;流动相A:含0.1%三氟乙酸的水;流动相B:含0.1%三氟乙酸的乙腈;进样量:20 μL; 流速:1 mL/min;检测波长:215 nm;检测温度:30 ℃;洗脱程序:0~5 min B为10%;5~40 min B从10%到80%;40~50 min B从80%到10%;50~60 min B为10%;60 min停止。
1.3.6 数据处理
试验重复3次,采用SPSS 19.0软件进行统计学显著性分析,数据以平均值±标准偏差表示,且P<0.05认为差异显著。
2 结果与分析
2.1 不同花源蜂蜜蛋白质含量的比较
如表1所示,6种不同花源蜂蜜中蛋白质含量分布在395.49~944.51 mg/kg,按照含量高低依次为枣花蜜(944.51±38.04)mg/kg、龙眼蜜(801.37±15.49)mg/kg、土蜂蜜(609.22±18.04)mg/kg、洋槐蜜(528.82±65.10)mg/kg、油菜蜜(432.75±20.20)mg/kg、荆条蜜(395.49±12.75)mg/kg。很多研究显示蜂蜜中约含有0.1%~0.5%蛋白质,但这些通常是采用凯氏定氮法通过测定蜂蜜总氮含量计算得到,但蜂蜜中总氮仅有40%~80%来自蛋白质成分,其余则来自游离氨基酸,因此通过凯氏定氮法测定蜂蜜蛋白质含量会导致数据比实际值偏高[17-18]。蜂蜜中蛋白质组分有两类来源:一类是来自于蜜源植物的花粉、花蜜以及渗出物,另一类则来自蜜蜂自身分泌物[19-20]。6种不同花源蜂蜜的蛋白质含量在种类间差异显著(表1),这可能是由于不同蜜源植物花蜜或花粉中所含蛋白质含量差异造成的。

表1 不同花源蜂蜜中蛋白质含量Table 1 Protein content of honeyfrom different floral origin
注:同一行具有不同字母数据之间代表显著差异(P<0.05)。
2.2 不同花源蜂蜜蛋白质电泳行为分析
蜂蜜中含有少量的蜜源植物花粉,而花粉是蜂蜜中蛋白质成分的一个重要来源,为了观察花粉对蜂蜜蛋白质电泳行为是否会产生影响,电泳前对蜂蜜样品分别进行离心和不离心预处理,电泳结束经考马斯亮蓝染色后如图1-A和1-B所示。由图1-A和1-B可以看出,离心与否对蜂蜜蛋白质SDS-PAGE图谱影响不明显,无论是否经离心预处理,6种不同花源蜂蜜中蛋白质均主要集中在分子质量43~97.4 kDa,然而此区间高丰度蛋白条带的分子质量和颜色深浅在蜂蜜品种间有明显区别;对于枣花蜜、龙眼蜜和土蜂蜜,在> 97.4 kDa明显存在一些高分子质量蛋白。这说明6种花源蜂蜜中主要蛋白质组分有一定相似性,但在组成和含量上存在差异。文献中已鉴定的蜂蜜蛋白包括蜂王浆主蛋白MRJP-1~5、MRJP-7以及α-葡萄糖苷酶等,其分子质量均处于50~80 kDa[20-22]。另外,对于枣花蜜,分子质量约19 kDa处存在1条高丰度蛋白条带,而在其他5种蜂蜜中并不明显(图1-A和1-B),这可能预示着此蛋白质带可作为枣花蜜的特征花源标识成分。
除考马斯亮蓝染色外,银氨染色也常在电泳中用于蛋白质显色,其作为一种高灵敏度蛋白质染色方法,在SDS-PAGE图谱中可以更清晰地表征蛋白质组分的差异和变化。图1-C显示的是6种蜂蜜银染蛋白质SDS-PAGE图谱,可以看出,与考染相比,银染将6种蜂蜜蛋白质组分差异更清晰地呈现:除43~97.4 kDa高丰度蛋白,枣花蜜、荆条蜜、龙眼蜜、土蜂蜜和油菜蜜在31~43 kDa存在丰富的次丰度蛋白,而枣花蜜、龙眼蜜和土蜂蜜中<31 kDa和>97.4 kDa蛋白也被更好显现出来。由此可知,6种不同花源中国蜂蜜中蛋白质分子质量遍布于14.4~97.4 kDa,甚至部分品种在> 97.4 kDa还存在较多的高分子质量蛋白。MARSHALL等1987年首次采用银染SDS-PAGE将澳大利亚蜂蜜中分子质量分布于10~150 kDa的19个蛋白条带呈现出来[23]。BAUER等采用考染SDS-PAGE研究洋槐蜜、葵花蜜、栗子蜜、森林蜜时,分布于10.5~72 kDa的多条蛋白带被检测[24]。
比较6种蜂蜜的考染和银染SDS-PAGE图谱,枣花蜜考染图谱中19 kDa附近的单一蛋白带(图1-A和1-B)在银染图谱上呈现为2个明显条带(图1-C),这说明其由2个分子质量非常接近的蛋白组分构成;而对于其他5种蜂蜜,虽在银染图谱19 kDa附近也显现出微弱的蛋白带,但与枣花蜜相比含量非常低微(图1-C)。另外,在分子质量24 kDa附近,荆条蜜、龙眼蜜、土蜂蜜、洋槐蜜和油菜蜜的银染图谱中出现明显蛋白带,但在枣花蜜中并不明显(图1-C),因此,可利用此蛋白组分应用于其他5种蜂蜜尤其是低价格油菜蜜掺入到枣花蜜中的掺假鉴别。

A和B-考马斯亮蓝染色,A-离心预处理、B-不离心预处理;C-银氨染色;其中泳道M为Marker,泳道1-6分别为枣花蜜、荆条蜜、龙眼蜜、土蜂蜜、洋槐蜜和油菜蜜图1 不同花源蜂蜜蛋白质SDS-PAGE图谱Fig.1 The SDS-PAGE profiles of honey protein from different floral origin
2.3 不同花源蜂蜜提取蛋白SDS-PAGE分析
蜂蜜中仅含有痕量蛋白质,而其中大量存在的葡萄糖、果糖以及酚酸、黄酮等小分子代谢成分均可能会干扰蜂蜜蛋白质的结构表征,采取合适的方法将蜂蜜中蛋白质分离出来是准确全面鉴定蜂蜜蛋白质种类的前提[21]。文献报道的蜂蜜蛋白质提取分离方法主要分为两类:物理法(超滤、色谱法等)和化学沉淀法(硫酸-钨酸钠、硫酸铵、TCA丙酮法等),而其中的超滤分离和硫酸-钨酸钠沉淀被认为是提取蜂蜜蛋白最为有效的2种方法[18,21]。因此,本研究比较分析了超滤法和钨酸钠沉淀法分离6种中国蜂蜜蛋白质的适用性及效果。
超滤法提取蜂蜜蛋白质SDS-PAGE图谱如图2-A所示,与原始蜂蜜相比(图1-A),超滤法有效浓缩了枣花蜜、荆条蜜、土蜂蜜、洋槐蜜和油菜蜜中高丰度蛋白,在电泳图谱中表现为43~97.4 kDa的蛋白条带紧密聚集而不能分开,并且对<43 kDa甚至是14.4 kDa以下的次丰度蛋白组分也有不等程度富集效果(图2-A,泳道1、2、4、5和6)。由此可知,超滤法实现了对此5种蜂蜜蛋白质的有效分离。但对于龙眼蜜,与原始蜂蜜样品相比(图1-A,泳道3),超滤分离并没有明显增加电泳图谱中蛋白质条带的数量和含量(图2-A,泳道3)。
图2-B显示的是硫酸-钨酸钠沉淀法提取蜂蜜蛋白质SDS-PAGE图谱。与超滤法相比,洋槐蜜、油菜蜜尤其是荆条蜜中43~97.4 kDa高丰度蛋白的含量明显降低,<43 kDa次丰度蛋白条带也有一定程度减少(图2-B,泳道2、5和6),而枣花蜜SDS-PAGE图谱中则几乎没有明显的蛋白条带(图2-B,泳道1)。这说明硫酸-钨酸钠沉淀法对4种蜂蜜尤其是枣花蜜中蛋白质的分离效果差于超滤法。

A-超滤法提取蜂蜜蛋白,B-硫酸-钨酸钠沉淀法提取蜂蜜蛋白;其中泳道M为Marker,泳道1-6分别为枣花蜜、荆条蜜、龙眼蜜、土蜂蜜、洋槐蜜和油菜蜜图2 不同方法提取蜂蜜蛋白质SDS-PAGE图谱Fig.2 The SDS-PAGE profiles of honey protein obtained by different extraction methods
枣花蜜pH在7左右接近中性,而其他5种蜂蜜呈酸性(pH 3~4),蜂蜜体系酸碱性的差异可能导致硫酸-钨酸钠沉淀法不适用于提取枣花蜜蛋白[25]。CHUA等采用超滤法、钨酸钠沉淀法、硫酸铵盐析法分离马来西亚洋槐蜜、图朗蜜和吉兰蜂蜜蛋白质时,同样发现超滤法对3种蜂蜜蛋白质的提取效果更佳[21]。然而,对于土蜂蜜,钨酸钠沉淀法提取蛋白虽然没有超滤法浓度高,但其包含的蛋白质分布于泳道各个分子质量段,尤其有效富集了>97.4 kDa的高分子质量蛋白质(图2-B,泳道4);对于龙眼蜜,钨酸钠沉淀法获得的蛋白质无论从种类还是含量方面,均明显优于超滤法(图2-B,泳道3)。
由此可见,超滤法和硫酸-钨酸钠沉淀法对6种不同花源中国蜂蜜的蛋白质提取效果差异明显,超滤法适合用来提取枣花蜜、荆条蜜、洋槐蜜和油菜蜜中蛋白质,而土蜂蜜和龙眼蜜则更适合用钨酸钠沉淀法进行。
2.4 不同花源蜂蜜提取蛋白RP-HPLC分析
反相高效液相色谱利用待分离物质的极性差异进行分离,可根据出峰时间分析组分的疏水特性。图3-A和3-B分别是超滤法和钨酸钠沉淀法提取蜂蜜蛋白的RP-HPLC分析图谱,可以看出,2种方法获得的6种蜂蜜蛋白在RP-HPLC图谱中显示出明显的组成和疏水特性差异。
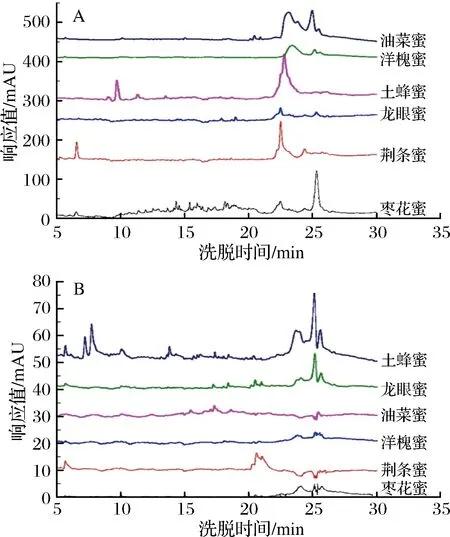
A-超滤法提取蜂蜜蛋白;B-硫酸-钨酸钠沉淀法提取蜂蜜蛋白图3 不同方法提取蜂蜜蛋白质RP-HPLC图谱Fig.3 The RP-HPLC profiles of honey protein obtained by different extraction methods
采用超滤法提取的6种蜂蜜蛋白,其色谱峰主要集中在22~26 min,但峰形和峰高在蜂蜜品种间差异明显,这预示着6种蜂蜜蛋白质中主要组分在极性上比较接近,但其种类和含量差异较大(图3-A)。另外,土蜂蜜和荆条蜜分别在洗脱时间10 min和6 min出现1个明显色谱峰,这说明这2种蜂蜜蛋白中包含特有的强亲水性组分;而对于枣花蜜,10~21 min存在非常多的小色谱峰,这预示着超滤法提取枣花蜜蛋白包含多个极性差异较大的微量组分(图3-A)。
从硫酸-钨酸钠沉淀法提取蜂蜜蛋白RP-HPLC图谱上可以看出(图3-B),土蜂蜜尤其龙眼蜜在23~26 min 出现比较明显的蛋白峰,并且5~20 min也存在一些小色谱峰,这从另一角度说明硫酸-钨酸钠沉淀法可以分离出更多种类的土蜂蜜和龙眼蜜蛋白质,与电泳结果相吻合;而对于枣花蜜、荆条蜜、油菜蜜和洋槐蜜,与超滤法相比,钨酸钠沉淀法提取蛋白RP-HPLC图谱不仅在峰形上差异较大,而且峰面积很小(图3-B),这说明钨酸钠沉淀法获得的蜂蜜蛋白在种类和含量上均很少,不适合用于此4种蜂蜜蛋白质的分离。
3 结论
本文研究了中国特色枣花蜜、荆条蜜、龙眼蜜、土蜂蜜、洋槐蜜和油菜蜜蛋白质电泳行为的差异,以及不同蛋白质提取方法对6种蜂蜜蛋白的分离效果。结果表明,6种不同花源蜂蜜表现出明显的蛋白质电泳行为差异,其蛋白条带遍布于14.4~97.4 kDa,但蛋白质组成和含量在蜂蜜品种间差异明显,且仅部分品种在> 97.4 kDa存在较多高分子质量蛋白;采用超滤法和硫酸-钨酸钠沉淀法提取蜂蜜蛋白质时,超滤法适合于枣花蜜、荆条蜜、洋槐蜜和油菜蜜,而硫酸-钨酸钠沉淀法则适合于土蜂蜜和龙眼蜜,并且2种方法获得的, 6种蜂蜜蛋白在SDS-PAGE和RP-HPLC图谱中表现出明显的分子质量大小和疏水特性差异。
