壳寡糖与屎肠球菌对肉仔鸡生长性能、免疫功能及肠道短链脂肪酸含量的影响
2019-08-12安文艺雷佳琦董元洋邵玉新张炳坤
安文艺,雷佳琦,董元洋,武 威,刘 璇,邵玉新,张炳坤
(中国农业大学动物科学技术学院,动物营养学国家重点实验室,北京100193)
肉仔鸡生长快,饲养集约化程度高、密度大,致其免疫力低下,抗病力差,易受到各种病原菌侵袭。抗生素在改善畜禽免疫力和生产性能方面做出重要贡献[1],但抗生素在畜禽饲料中的禁用势在必行,寻找抗生素替代物以改善畜禽免疫力成为当今畜牧业关注的热点。壳寡糖(Chitooligosaccharides, COS)是目前发现的自然界中唯一碱性功能寡糖,有来源广、分子量小、活性高等优点,在调节肠道微生物区系、提高机体免疫力和改善动物生长性能方面均有显著效果。研究显示,COS可提高肉仔鸡胸腺指数和法氏囊指数,降低肠道中大肠杆菌数,促进肉仔鸡生长[2-3]。屎肠球菌(Enterococcus faeciums,PNC)是人和动物肠道菌群组成成员,可代谢产生有机酸、过氧化氢和细菌素等,降低肠道pH,抑制病原菌,有益生特性[4]。研究表明,PNC 可促进肉鸡生长,缓解大肠杆菌和沙门氏菌导致的肉仔鸡生产性能下降,并提高血清中IgA 含量,增加盲肠生物多样性,改善肠道微生物组成[5-6]。
脂多糖(Lipopolysaccharide,LPS)是革兰氏阴性菌细胞壁的重要组分,是免疫系统的有效激活剂,广泛应用于炎症反应模型构建。研究表明,LPS 刺激降低肉仔鸡生长性能,诱发全身炎症反应,导致IL-1β 等表达量上升[7-8],COS 抑制LPS 刺激的RAW 264.7 细胞中促炎介质如IL-1β 和NO 产生[9]。目前,关于COS 与PNC 联合使用的报道较少,但已发现COS 可促进益生菌增殖[10],二者同时添加或能更好地发挥益生作用。因此,本试验用LPS 构建炎症反应模型,多次注射模拟细菌感染,探究COS 与PNC 对LPS 诱导炎症反应的作用效果,为其在肉鸡饲粮中的应用提供理论依据。
1 材料与方法
1.1 试验材料 COS 为寡糖素COS(II),化学名称为寡聚β-(1-4)-2- 氨基-2- 脱氧-D- 葡萄糖,聚合度2~10。寡糖素COS(II)(以下简称COS)产品是以甲壳类动物多糖为原料,采取酶法降解壳聚糖与膜分离结合技术生产的一种吸收性寡糖,含COS10%,载体为麦芽糊精。
PNC 为实验室保藏鸡源屎肠球菌PNC01[11],将保藏菌种用MRS 培养基培养3 代后,发酵、喷粉,以稻壳为载体,有效含量为5×1010CFU/g。
1.2 试验动物及日粮 选取1 日龄健康且体重相近的AA公雏560 羽,采用2(LPS 刺激/非LPS 刺激)×2(添加COS/不添加COS)×2(添加PNC/不添加PNC)三因素试验设计,共8 个处理,每处理7 重复,每重复10只鸡(各笼鸡平均体重为鸡群平均体重±3%),试验期21 d。试验饲粮参照《鸡营养需要》(NY/T 33-2004),结合《AA 肉鸡饲养管理手册》配制,呈粉状,基础日粮组成和营养成分见表1。采用玉米-豆粕型基础饲粮,试验饲粮分别在基础日粮基础上添加COS(200 mg/kg)和PNC(1×109CFU/kg)。

表1 基础日粮组成和营养成分(风干基础)
1.3 LPS 刺激与饲养管理 试验用LPS 为大肠杆菌源脂多糖,购自Sigma-Aldrich(美国),于试验鸡17、19和21 日龄早晨每只鸡腹腔注射1 mg/kg BW 的LPS,对照组腹腔注射生理盐水。
动物饲养试验于中国农业大学家禽试验基地进行,肉仔鸡3 层笼养,自由采食和饮水,常规免疫。每天观察温度、湿度变化和采食情况,记录死亡情况。
1.4 样品采集与指标测定 于试验鸡21 日龄,每重复随机选取1 只健康且接近平均体重的鸡,于腹腔注射LPS 3 h 后,称活重,翅静脉无菌采血,颈静脉放血致死,分离肝脏、脾脏、法氏囊和胸腺后称重。取脾脏和回肠组织样于2 mL RNAase free 管中,液氮速冻,-80℃保存待测。取盲肠食糜于5 mL 离心管,-80℃保存,测定短链脂肪酸(SCFA)含量。
1.4.1 生长性能 试验开始,第17 天和21 天早晨以重复为单位称取空腹重,用于生长性能的统计。计算阶段采食量、体增重和耗料增重比(采食量/体增重)。
1.4.2 器官指数 根据肝脏、脾脏、法氏囊和胸腺的重量和鸡只活重,计算器官指数:器官指数=器官重(g)/宰前活重(kg)。
1.4.3 肠道组织形态 回肠组织样品经10%中性甲醛固定后,用石蜡包埋,制作石蜡切片,PAS 染色后进行肠道形态的观测。用活细胞工作站进行绒毛高度和隐窝深度的测定。每个切片选取10 根完整且平直的绒毛和对应的10 个隐窝深度,绒毛高度为绒毛顶端到隐窝入口处的垂直距离,隐窝深度为隐窝入口到绒毛基部的垂直距离。
1.4.4 血清中IgA 含量测定 翅静脉无菌采血2 mL,4℃,3 000 r/min 离心15 min,分离所得血清-20℃保存待测。用双抗夹心ELISA 法测定血清中IgA,试剂盒购自美国Bethyl 公司,测定方法参照说明书,血清稀释8 000 倍测定,用ELISA calc 软件绘制标准曲线。
1.4.5 脾脏和回肠mRNA 表达量测定 总RNA 采用RNAiso Plus 试剂(TaKaRa,日本)提取,步骤参见Wang 等[8]。RNA 浓度和纯度采用Nanodrop 2000 测定,用0.8%的琼脂糖凝胶电泳检查其完整性,浓度、纯度和完整性均符合要求的RNA 进行反转录。反转录采用PrimeScript™RT reagent Kit with gDNA Eraser(Perfect Real Time)试剂(TaKaRa,日本)。操作按照试剂盒说明书进行,取910 ng RNA 反转录为cDNA,-30 ℃保存备用。qPCR 在7500 荧光定量PCR 仪(Applied Biosystems,Foster City, California, USA)上进行,试剂为SYBR®Premix Ex Taq™(TaKaRa,日本)。PCR反应条件参考试剂盒说明书。反应结束后用熔解曲线和琼脂糖凝胶电泳检测表达产物的特异性。用2-ΔΔCt计算相对表达量,目的基因及内参基因的引物序列见表2。
1.4.6 盲肠食糜中SCFA 含量的测定 取盲肠冻存样品,用剪刀剪开肠壁取0.1 g 左右于10 mL 离心管,加入5 mL盐酸甲酸混合液,200 µg 内标溶液,钢珠2 颗,迅速放回;置于冰上1 h,并间歇震荡混匀;14 000 r/min离心20 min;用2 mL 注射器吸取1 mL 左右离心上清液,通过0.2 µm 的滤膜过滤至2 mL 样品瓶中。用气象色谱(SCION-456-GC)检测,使用氮气作为载气,流速为20 mL/min,氢气流量为30 mL/min,空气流量为300 mL/min。将检测器和注射器温度分别加热至230℃和200℃,进样量为2 μL,测定乙酸、丙酸和丁酸含量。结果表示为每克食糜样品中SCFA 的微克数(μg/g)。

表2 Real-time PCR 引物序列
1.5 统计分析 数据经Excel 2007 处理后,采用SPSS 18.0 一般线性模型(GLM)分析;当LPS 刺激、COS与PNC 处理的交互作用显著时,做单因素方差分析,当组间差异显著时,采用Duncan's 结合LSD 多重比较进行分析,P<0.05 表示差异显著,P<0.01 表示差异极显著。试验结果用平均值和SEM(标准误)表示。
2 结 果
2.1 COS 和PNC 对肉仔鸡生长性能的影响 由表3 可知,各处理组肉仔鸡0~17 d 的生长性能无显著差异。由表4 可知,LPS 刺激降低了肉仔鸡17~21 d 采食量(P<0.01),有提高耗料增重比的趋势,对体增重及0~21 d 生长性能无显著影响。添加COS 可缓解LPS 刺激下的采食量下降(P<0.05),提高0~21 d 肉仔鸡体增重(P<0.05),有提高0~21 d 采食量并降低耗料增重比的趋势。COS 与PNC 对0~21 d 肉仔鸡的体增重和采食量交互作用显著(P<0.05):在非LPS 刺激条件下,同时添加COS 和PNC 较单独添加PNC 可提高肉仔鸡体增重和采食量(P<0.05),但刺激条件下各日粮处理组差异不显著。LPS、COS 和PNC 三因素互作对生产性能无显著影响。
2.2 COS 和PNC 对肉仔鸡器官指数的影响 由表5 可知,LPS 刺激提高21 d 肉仔鸡肝脏和脾脏指数(P<0.01),对胸腺指数无显著影响。COS 可降低21 d 肉仔鸡脾脏指数(P<0.05),PNC 可降低21 d 肉仔鸡脾脏指数(P<0.01)。LPS、COS 和PNC 三因素互作对法氏囊指数有显著差异(P<0.05),LPS 刺激降低肉仔鸡法氏囊指数(P<0.05),单独或同时添加COS 和PNC 均能缓解法氏囊指数降低。

表3 COS 和PNC 对LPS 刺激前(0~17 d)肉仔鸡生长性能的影响
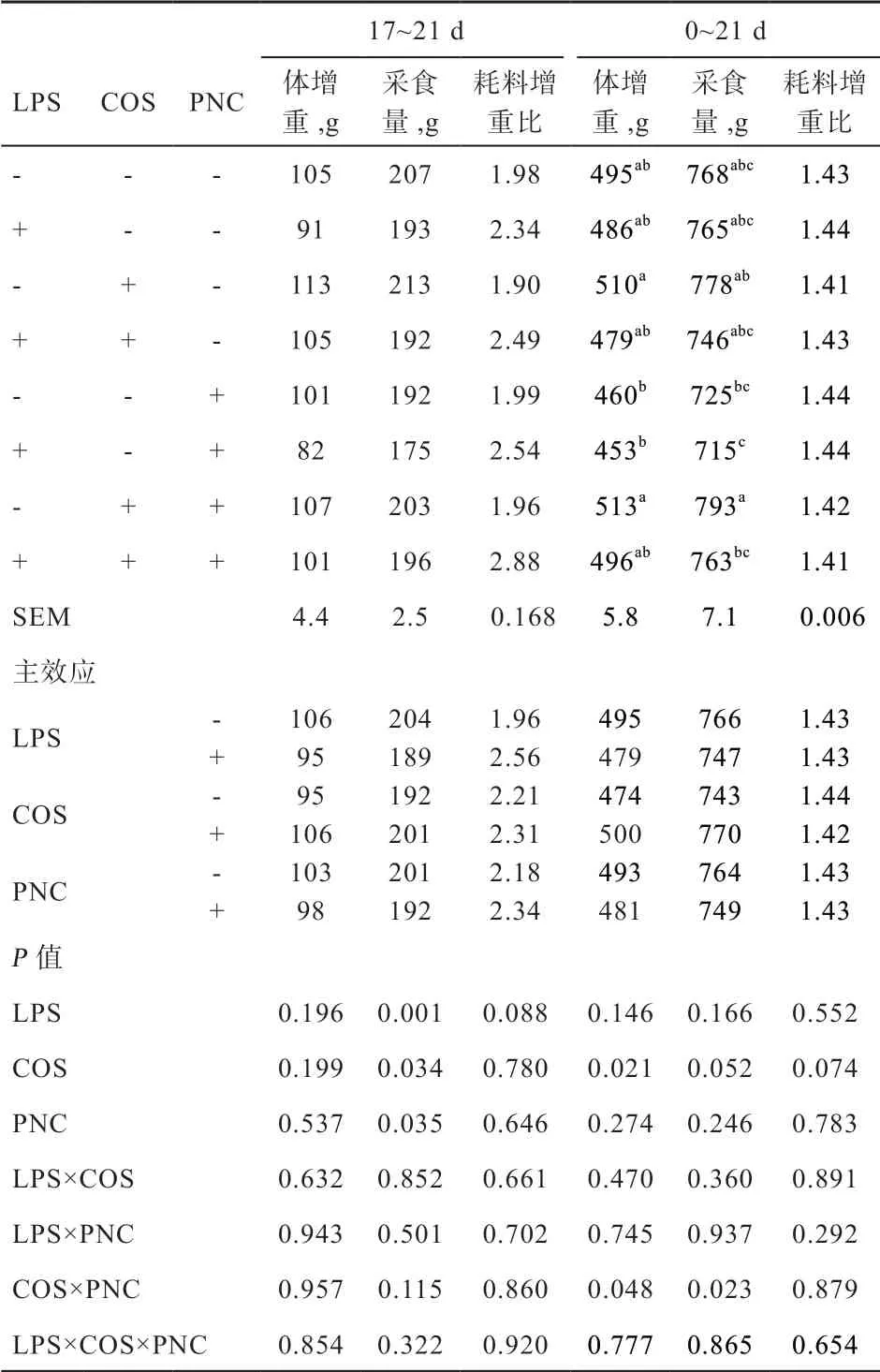
表4 COS 和PNC 对LPS 刺激后(17~21 d)和全期(0~21 d)肉仔鸡生长性能的影响
2.3 COS 和PNC 对肉仔鸡肠道形态的影响 由表6 可知,LPS 刺激降低21 d 肉仔鸡回肠绒毛高度和隐窝深度(P<0.01),对绒毛高度/ 隐窝深度无显著影响;PNC 降低21 d 肉仔鸡回肠隐窝深度(P<0.05),对绒毛高度和绒毛高度/隐窝深度无显著影响;COS 及各因素互作对肠道形态无显著影响。

表5 饲粮中添加COS 和PNC 对肉仔鸡免疫器官指数的影响 g/kg BW
2.4 COS 和PNC 对肉仔鸡血清IgA 含量的影响 由表7可知,LPS 刺激降低21 d 肉仔鸡血清IgA 含量(P<0.05),COS 降低21 d 肉仔鸡血清IgA 含量(P<0.05),PNC可提高21 d 肉仔鸡血清IgA 含量(P<0.05),各因素互作对血清IgA 含量无显著影响。
2.5 COS 和PNC 对肉仔鸡脾脏和回肠mRNA 相对表达量的影响 由表8 可知,LPS 刺激提高肉仔鸡脾脏和回肠IL-1β 和脾脏IL-8 mRNA 表达量(P<0.01),降低脾脏TLR4 mRNA 表达量(P<0.01),对NF-κB mRNA 表达量无显著影响;COS 有降低脾脏IL-1β 表达量的趋势(P=0.097),降低LPS 刺激后IL-8 mRNA表达量(P<0.05)。PNC 及各因素互作对各基因表达量无显著影响。

表6 饲粮中添加COS 和PNC 对肉仔鸡回肠形态的影响
2.6 COS 和PNC 对肉仔鸡盲肠SCFA 含量的影响 由表9 可知,LPS 刺激降低21 d 肉仔鸡盲肠食糜中丁酸含量(P<0.05),对盲肠食糜中乙酸和丙酸含量无显著影响。COS 提高盲肠食糜中丙酸和丁酸含量(P<0.05),有提高乙酸含量的趋势。LPS 和PNC 对盲肠食糜中乙酸含量交互作用显著(P<0.05);非LPS 刺激条件下,同时添加COS 和PNC 增加盲肠食糜中乙酸含量(P<0.05),LPS 刺激条件下,添加PNC 降低盲肠食糜中乙酸含量(P<0.05)。各因素互作对丙酸和丁酸含量无显著交互作用。
3 讨 论
3.1 COS 和PNC 对肉仔鸡生长性能的影响 益生菌与益生元是重要的抗生素替代物。前人研究表明,COS单独添加及与干酪乳杆菌共同添加可显著提高肉仔鸡的平均日增重[12]。COS 的免疫调节效果以及鸡源PNC的促生长效果均已经被证实[9,11],但同时添加COS 和PNC 的免疫调节功能有待探究。本试验通过LPS 多次刺激肉仔鸡,建立肉仔鸡炎症反应模型,以探究COS和PNC 的免疫调节作用。LPS 刺激导致免疫应激,研究表明,LPS 刺激提高肉鸡肝脏的相对重量,降低体重和饲料利用率,还可影响骨骼代谢,降低胫骨重量与胫骨强度,增加骨骼的分解代谢,改变机体组成成分[13];另外,LPS 刺激还会消耗营养物质用于细胞因子等分泌,造成分解代谢增强,合成代谢减弱[14]。本试验发现,LPS 刺激降低肉仔鸡17~21 d 采食量,COS 可以提高应激状态下的采食量,改善体增重,降低了LPS 对肉仔鸡生长的不良影响。
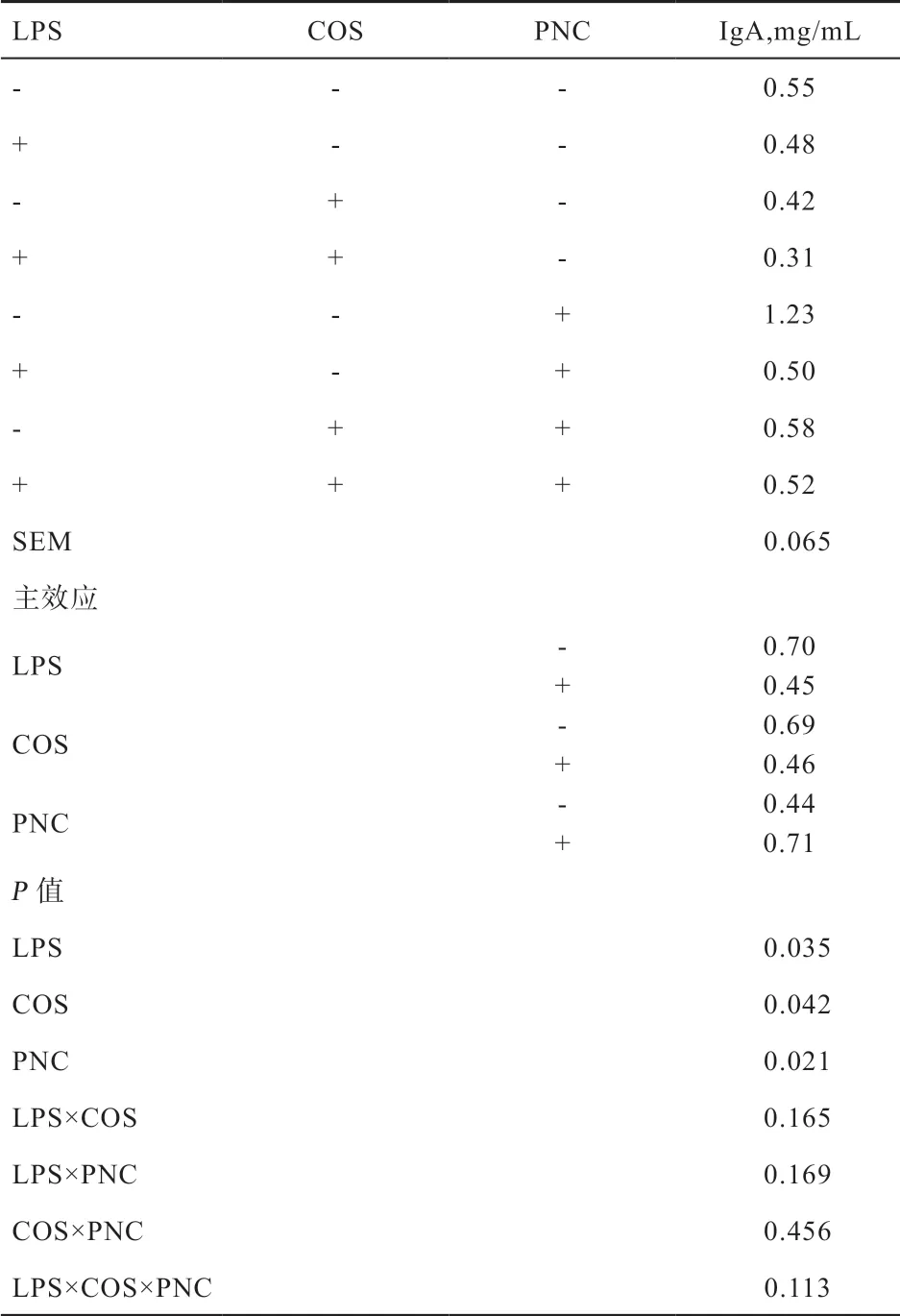
表7 饲粮中添加COS 和PNC 对肉仔鸡血清IgA 的影响
3.2 COS 和PNC 对肉仔鸡器官指数的影响 肝脏是急性期蛋白合成的场所,脾脏则是机体重要的外周免疫器官,是免疫感应发生的重要场所,二者相对指数增加有利于提高抗原清除速度。研究发现,LPS 多次刺激显著提高肉仔鸡肝脏和脾脏的器官指数[7]。本试验发现添加COS 和PNC 可抑制LPS 刺激后脾脏指数上升。法氏囊则是禽类特有的中枢免疫器官,可产生B 淋巴细胞,从而产生特异性抗体完成特定免疫应答。本试验发现,COS 可缓解LPS 刺激后法氏囊萎缩,这与Deng 等[15]发现的COS 促进法氏囊发育的报道相一致。
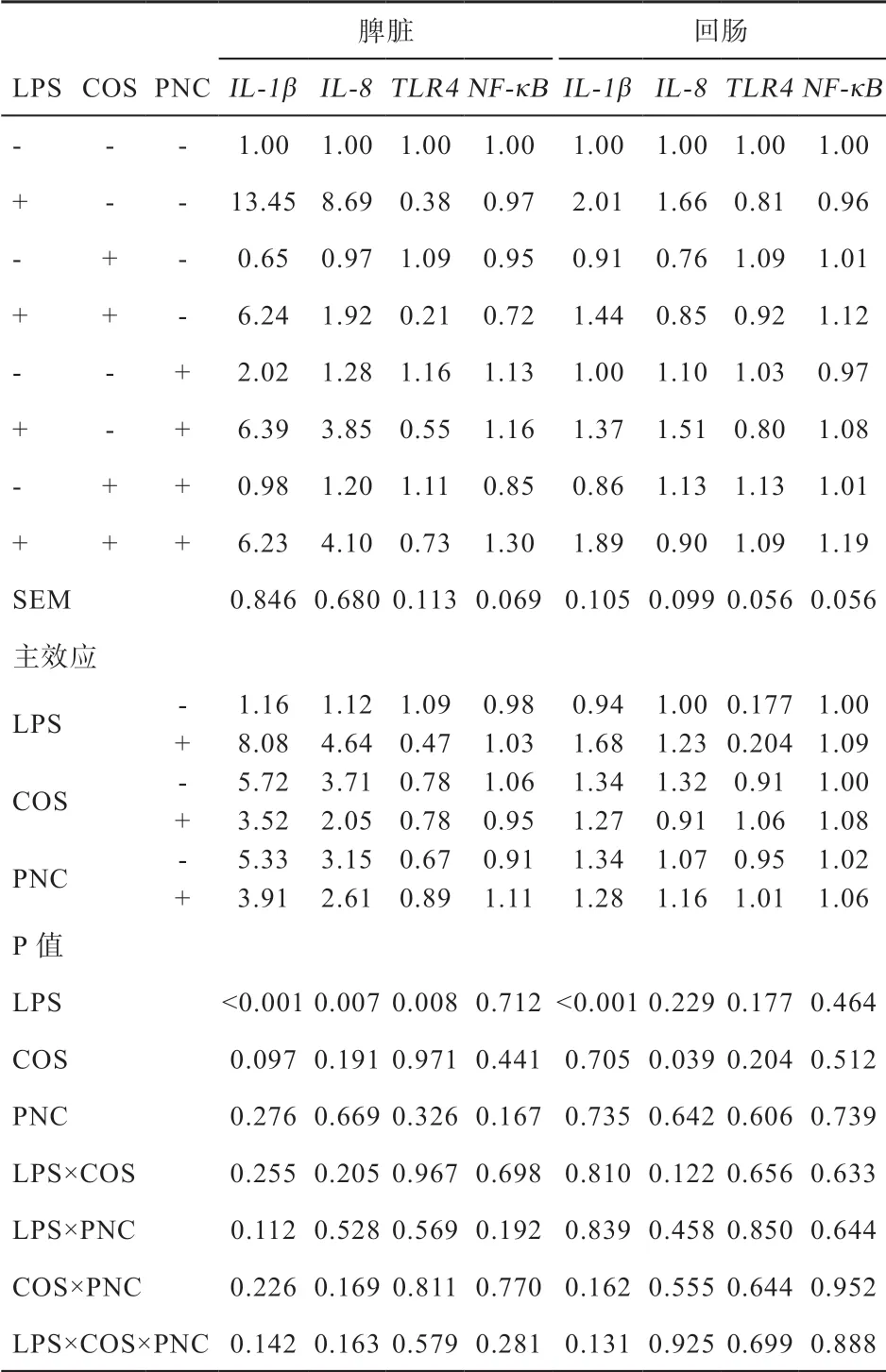
表8 饲粮中添加COS 和PNC 对肉仔鸡脾脏mRNA 表达量的影响
3.3 COS 和PNC 对肉仔鸡肠道组织形态的影响 肉仔鸡生长早期,持续的LPS 刺激会降低肠道的生长速度和肠道上皮细胞的增殖速度,进而降低肉仔鸡十二指肠和空肠的绒毛高度和隐窝深度,进而降低肠道的吸收能力[16]。本试验中LPS 刺激后肉仔鸡回肠形态被破坏,肉仔鸡生长性能下降。一般来说,回肠更接近后肠段,pH 更高,食糜流通速度慢,更易受到微生物影响,进而通过改变SCFA 含量,尤其是丁酸含量来改变肠道形态,然而本试验条件下COS 和PNC 没有显著改善LPS 造成的肠道形态改变。
3.4 COS 和PNC 对肉仔鸡血清IgA 含量的影响 IgA是在体液免疫应答中发挥重要作用的免疫分子,也是外分泌液中主要的免疫球蛋白,具有抗菌、抗病毒和抗毒素作用,而应激反应会导致IgA 水平的波动。Huang 等[17]研究发现,添加COS 可提高肉鸡血清中IgA 水平,与本试验结果有差异,这可能与添加水平和壳寡糖组分有关。据报道,PNC 可提高肉仔鸡血清中IgA 水平[6],与本试验结果一致,表明添加PNC 可提高肉仔鸡体液免疫水平,这可能与其对肉仔鸡肠道微生物区系的改善有关,也可能是PNC 作为抗原通过树突细胞和巨噬细胞等上调了机体体液免疫水平。
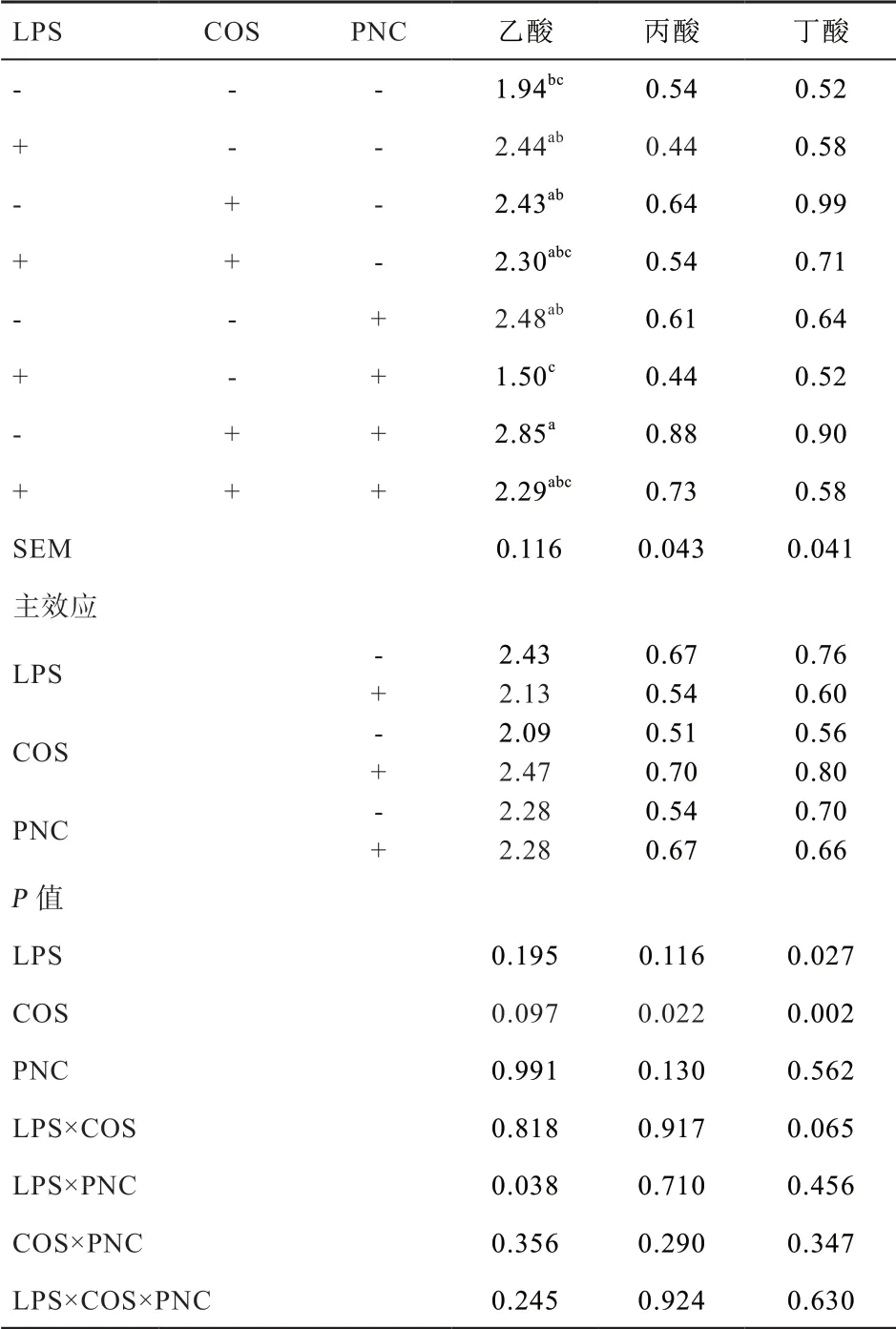
表9 饲粮中添加COS 和PNC 对肉仔鸡盲肠食糜中SCFA 含量的影响 μg/g
3.5 壳寡糖和PNC 对肉仔鸡脾脏和回肠mRNA 相对表达量的影响 Takahashi 等[18]研究发现,LPS 刺激后2~4 h,脾脏中炎症相关因子IL-1β mRNA 相对表达量先升高后降低,且在刺激后3 h 达到峰值,而脾脏TLR4 的表达量在刺激后4 h 内持续下降,与本试验结果一致。IL-1β 是重要的促炎细胞因子,IL-8 是重要的趋化因子,可以募集异噬细胞,用于抗原清除,COS 降低IL-1β 和IL-8 表达可能有利于抑制过度的炎症反应,避免机体损伤。研究证实,COS 抑制LPS 与TLR4/MD-2 受体复合物结合,快速磷酸化ERK、JNK和p38,降低MAPK 的活化,减少NF-κB 核易位,最终使LPS 刺激的RAW 264.7 细胞中促炎介质(如IL-1β、NO 等)产生减少[9]。Lin 等[19]在研究COS 对血管内皮细胞的抗炎作用时得到了相似结果。本试验结果发现,壳寡糖降低IL-1β 基因表达,却未见对NF-κB表达量的显著影响,其具体机制仍需探究;而LPS 多次刺激降低TLR4 基因表达,这可能是LPS 多次刺激引起了免疫耐受,炎症反应弱化[7]。
3.6 壳寡糖和PNC 对肉仔鸡盲肠SCFAs 含量的影响免疫应激影响肠道微生物区系[20]。肠道中SCFA 主要由微生物发酵未消化的碳水化合物产生,肠道微生物区系影响SCFA 含量及组成。本研究显示,LPS 刺激后盲肠丁酸含量显著降低,可能是由于LPS 刺激扰乱了肠道微生物区系,使发酵产生SCFA 的厌氧菌含量下降,从而降低了盲肠SCFA 含量。丁酸可抑制IκB 降解,降低NF-κB 表达,从而抑制IL-1β 产生,这可能是LPS刺激后IL-1β 表达增加的原因之一。COS 显著提高盲肠食糜中丙酸和丁酸含量,丁酸和丙酸在不同生理浓度共同存在情况下,其生物学作用十分复杂,丁酸对基因表达影响最大,丙酸次之[21]。丁酸盐抑制NF-κB 的核转录及与DNA 的结合,或诱导IκB-β 高表达抑制NF-κB表达,抑制NF-κB 信号通路的激活,缓解炎症反应[22],这可能是COS 抑制炎症反应发生的途径之一,但目前缺乏家禽上SCFAs 受体的报道,因此关于其相互作用机制还有待进一步探究。
4 结 论
本试验发现,添加COS(200 mg/kg)可提高盲肠中SCFA 含量,可改善LPS 刺激肉仔鸡的生长性能改变;添加PNC(1×109CFU/kg)可改善机体体液免疫;二者均能缓解LPS 刺激导致的脾脏肿大和IL-1β mRNA 表达增加,缓解机体炎症反应,改善LPS 刺激对肉仔鸡的不利影响。
