木枣多糖诱导胃癌细胞MKN-45凋亡的作用机制
2019-08-12冀晓龙王晓琴
冀晓龙 韩 林 王晓琴 彭 强 王 敏
(西北农林科技大学食品科学与工程学院 陕西杨凌 712100)
红枣(Zizyphus jujuba Mil1.)又名大枣、刺枣、美枣、华枣等,是鼠李科(Rhamnaceae)枣属植物枣树(Ziziphus Mill.)的果实。我国是世界上最大的枣生产国,据国家数据网统计2018年我国红枣产量为852.20万t,枣产量占全世界的95%以上,在国际贸易市场中占据主导地位[1]。枣果的营养价值高且具有多种功效,是一种天然的药食两用食品。除基本营养物质及多种维生素、微量元素、有机酸等,红枣中还含有糖类、皂甙类、萜酸类、黄酮类、腺苷类等多种功能性植化成分,而多糖已成为近年来研究的热点[2-3]。红枣富含多糖,多为中性多糖和酸性多糖,分子质量较大,结构复杂,研究证明红枣多糖具有抗氧化、免疫调节、抗肿瘤、降血糖、保肝、调节肠道菌群等活性[4-5]。
木枣(Zizyphus jujuba cv.Muzao)别名吕梁母枣,为鼠李科枣属植物枣树的果实,主要分布于山西省吕梁地区和陕西省榆林地区黄河沿岸,为当地主栽品种[6]。然而,目前关于木枣多糖的报道较少。曹犇[7]通过小鼠游泳试验,发现木枣多糖能够延缓小鼠运动后疲劳的产生,具有抗疲劳作用。王永杰等[8]对木枣多糖分离纯化得到3个组分HJP1、HJP2和HJP3,而仅对HJP1和HJP3进行结构鉴定和抗肿瘤活性研究,未研究其抗肿瘤作用机制。为此,本研究采用水提、醇沉、脱蛋白和脱色等工艺提取木枣多糖,研究其对胃癌肿瘤细胞MKN-45的凋亡作用及其机制,为实现木枣多糖在功能性食品上的应用提供参考。
1 材料与方法
1.1 材料与试剂
木枣多糖(ZMP)为本课题组用热水浸提、醇沉、脱蛋白和脱色工艺制得,其分子质量为59.1 ku,由鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖和半乳糖醛酸组成,其物质的量比为2.3∶19.7 ∶1.2 ∶1.0 ∶2.6 ∶8.3 ∶13.2[6]。
MKN-45(人低分化胃癌细胞系,Human poorly differentiated gastric cancer cell line),西北农林科技大学动物科技学院曹斌云教授惠赠。
DMEM高糖培养基,GIBCO公司;胰酶(Trypsin)、 二 甲 基 亚 砜 (DSMO)、LPS( 批 号L2880)、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐 (MTT)、4’,6’-二脒基-2-苯基吲哚(DAPI)、丫啶橙(AO)、溴化乙啶(EB),Sigma 公司;BCA蛋白定量试剂盒、Western及IP细胞裂解液 (P0013),碧云天生物技术研究所;胎牛血清(FBS),SeraPro公司;SOD超化物歧化酶检测试剂盒、MDA细胞丙二醛测定试剂盒、LDH乳酸脱氢酶测定试剂盒,南京建成生物工程研究所;硫酸链霉素(100万单位)和青霉素(80万单位),哈药集团制药总厂;抗体:Bcl-2抗体、Bax抗体、cytochrome c抗体、caspase 3 抗体、cleaved caspase 3抗体、β-actin,碧云天生物技术公司;其它试剂均为分析纯级。
1.2 仪器与设备
CO2细胞培养箱、冷冻离心机,美国热电公司;洁净工作台,苏州安泰空气技术有限公司;荧光电子显微镜,OLYMPUS IX71;实时定量仪、垂直电泳槽、转膜仪,伯乐公司;酶标仪,Bio-Rad 680;凝胶成像系统,北京生物技术有限公司;倒置显微镜,西安测维光电技术有限公司;自动灭菌锅,西安海联有限公司;液氮罐、-80℃冰箱,海尔集团;冻存盒,天根生化科技有限公司;移液器,Eppendorf公司;烘箱,上海齐欣科学仪器有限公司。
1.3 试验方法
1.3.1 MKN-45肿瘤细胞培养 细胞培养箱的温度37℃,CO25%,湿度5%。从液氮中拿出装有肿瘤细胞的冻存管,置于37℃水浴使其快速融化,迅速将细胞液移至离心管中,1 000 r/min离心3 min,小心吸去离心管中的泡沫后弃上清液,加入1 mL DMEM高糖培养液,用移液器吹打均匀,将离心管中的细胞液重新移入预先添加3 mL培养液的3.5 cm培养皿中,混合均匀后置于培养箱中培养。一般将细胞被培养2代,待细胞状态稳定后即可用于试验。
1.3.2 木枣多糖对MKN-45细胞毒性测定 采用MTT比色法测定木枣多糖对MKN-45细胞毒性。将ZMP用培养液配成质量浓度为 6.4 mg/mL,再用培养液将样液进一步1∶1 000稀释。将96孔板内的细胞液小心吸出后,依次加入样液稀释液,每孔200 μL,置培养箱中分别培养24 h和48 h。设对照组(含细胞和培养液)、空白对照组(只含培养液)、阴性对照组(含DMSO的培养液,DMSO的含量小于1%),每组样液设5个复孔,独立重复试验3次。加MTT溶液,孵育4 h,测定吸光度值。
ZMP对肿瘤细胞的生长抑制率%=(OD对照组-OD试验组)/(OD对照组-OD空白)。
1.3.3 DAPI/AOEB染色 将细胞均匀地铺板在24孔细胞培养板中,培养24 h后将各孔细胞用相应浓度的样液处理24 h。收集细胞,PBS(pH 7.4)清洗3遍,每次2 min,收集细胞,用4%多聚甲醛在4℃固定15 min。接着用PBS清后,细胞经过DAPI (1 μg/mL) 处理后在 37℃孵育 15 min,用PBS清洗,将细胞悬液滴加到载玻片上,在暗室观察。
将细胞均匀地铺板在6孔板中,细胞密度为105个/mL/孔。24 h后,每孔细胞经相应浓度的样液处理,继续孵育24 h。清洗细胞后,用10 μL AO/EB溶液直接孵育30 s,在荧光显微镜下观察。
1.3.4 测定细胞中SOD活性和MDA含量 实验处理后弃培养基,各组肿瘤细胞用PBS洗涤2遍,胰酶消化后,离心沉淀,收集细胞,加入300 μL裂解液,在4℃放置30 min后,冷冻离心,收集上清液,按SOD和MDA试剂盒说明书检测细胞内SOD活性和MDA含量。
1.3.5 测定细胞组织中LDH活性 实验处理后立即取各组细胞培养上清500 μL,按试剂盒说明书测定肿瘤细胞组织中的LDH含量。
1.3.6 Bcl-2、Bax、Cyt-c、Caspase-3 蛋白表达量测定[9]取对数生长期的MKN-45细胞,调整细胞密度为106个/mL/皿,加入不同浓度ZMP样液培养24 h。根据蛋白提取试剂盒操作说明书提取各组细胞总蛋白,将细胞的蛋白样液定量、变性,聚丙烯酰胺凝胶电泳,转膜,用脱脂牛奶封闭2 h,洗膜,加入 Bcl-2、Bax、Cyt-c、Caspase-3(稀释倍数1 ∶1 ∶000)的一抗,以 β-actin (稀释倍数 1∶1 000)作为阳性对照,4℃过夜。加入稀释好的二抗,室温孵育1 h,然后洗膜、风干,使用ChemiBox凝胶成像系统对蛋白膜进行曝光。使用Quantity one 4.6.2软件对得到的蛋白条带进行条带灰度分析。
1.3.7 统计学分析 采用Excel 2007和SPSS 20.0对各测定指标进行比较分析,采用单因素方差分析One-way ANOVA检验方差齐性,并用Student’s-t分析。*P<0.05表示有显著性差异。所有结果均用±s表示。
2 结果与分析
2.1 木枣多糖对MKN-45细胞毒力测定
如图1所示,用不同质量浓度的ZMP样液(0,50,100,200,400,800,1 600,3 200,6 400 μg/mL)分别处理MKN-45肿瘤细胞24 h和48 h,在ZMP浓度和培养时间相应增加后,MKN-45细胞的存活率明显下降,呈剂量依赖性。当质量浓度达6 400 μg/mL时,培养24 h的ZMP对癌细胞抑制率达74.28%,48 h后达77.29%,与巢蕾等[10]用5-FU对MKN-45细胞做阳性对照相比,抑制效果显著(P<0.01)。根据对肿瘤细胞的毒力测定,选择ZMP 质量浓度为 1 600,3 200 μg/mL 和 6 400 μg/mL,处理24 h来研究其对MKN-45细胞蛋白酶活力及凋亡相关蛋白表达的影响。
2.2 DAPI染色结果

图1 ZMP对MKN-45细胞活力的影响Fig.1 Effect of ZMP on the macrophages viability of MKN-45
根据 MTT试验结果,用0,3 200 μg/mL的ZMP样液处理MKN-45细胞,染色观察发现,图2中空白对照样液(Control)的细胞核呈现均匀的蓝色核,而样液 ZMP 处理组(图 2 中 1,2,3)的细胞核的形态变小,细胞核的颜色亮,并有星状或者点状的亮蓝色凝聚,这主要是由细胞核和染色体凝聚,细胞核碎片和凋亡小体产生。试验结果表明,3 200 μg/mL ZMP对MKN-45细胞凋亡起诱导作用。

图2 MKN-45细胞DAPI染色图(400×)Fig.2 Morphological changes in MKN-45 cells by DAPI staining (400×)
2.3 AOEB染色结果
根据MTT试验结果,选取不同的浓度ZMP样液处理MKN-45细胞,染色发现,图3中空白对照样液(Control)的肿瘤细胞形态呈完整的梭状,核呈均匀的荧光绿,当ZMP样液质量浓度为1600 μg/mL时,细胞核出现细胞凋亡的早期现象,细胞核固缩,变为黄绿色,这可能是由于细胞膜渗透性改变,细胞核和染色质凝聚的结果 (图3A)。当ZMP样液质量浓度为6 400 μg/mL时,部分细胞皱缩为橘红色,出现晚期凋亡的特征(图3B)。
2.4 ZMP对肿瘤细胞中SOD含量的影响
超氧化物歧化酶(SOD)是一种重要的细胞内自由基清除剂,它能够防御由ROS产生的氧化应激而造成的细胞损伤[11]。多糖是一种重要的生物活性成分,ZMP可以刺激MKN-45细胞,降低细胞内SOD活力,使其不能及时发挥抗氧化作用,从而受到氧自由基的攻击,引起细胞的损伤和凋亡。
如图4所示,随着ZMP浓度的增加,细胞中SOD活力下降,呈浓度依赖性。在样液质量浓度分别为 0,1 600,3 200 μg/mL 和 6 400 μg/mL 时,其对MKN-45细胞的SOD活力分别为22.31,20.92,15.91 nmol/mg蛋白和3.10 U/mg蛋白。与对照组相比,ZMP质量浓度为6 400 μg/mL时,细胞SOD活力明显下降,这可能会引发因氧自由基攻击而产生的癌细胞凋亡。
2.5 ZMP对肿瘤细胞中MDA含量的影响
丙二醛(MDA)是膜相关的脂质过氧化降解的产物,是细胞膜氧化损伤的指标。如图5所示,随着ZMP浓度的增加,细胞中MDA的活力明显升高,且呈浓度依赖性,在ZMP样液质量浓度分别为 0,1 600,3 200 μg/mL 和 6 400 μg/mL 时,其对MKN-45 细 胞 的 活 力 分 别 为 7.41,10.61,25.86 nmol/mg蛋白和47.33 nmol/mg蛋白。与对照组相比,ZMP对MKN-45细胞的MDA含量影响显著,随着ZMP浓度的增加,细胞膜氧化损伤加剧,细胞凋亡更明显。

图3 MKN-45细胞AOEB染色图(400×)Fig.3 Morphological changes in MKN-45 cells by AOEB staining (400×)

图4 ZMP对MKN-45细胞的SOD活力的影响Fig.4 The effect of ZMP on SOD activity in MKN-45 cells

图5 ZMP对MKN-45细胞的MDA含量的影响Fig.5 The effect of ZMP on MDA content in MKN-45 cells
2.6 ZMP对肿瘤细胞中LDH含量的影响
乳酸脱氢酶(LDH)的释放量是细胞膜完整性以及氧化负担引起的细胞坏死的一个重要指标。随着细胞的凋亡,LDH含量增加,凋亡明显。如图6所示,随着ZMP浓度的增加,细胞中LDH的活力明显增强,且呈浓度依赖性。在样液质量浓度分别 为 0,1 600,3 200 μg/mL 和 6 400 μg/mL 时 ,ZMP对MKN-45细胞的LDH活力分别为548.77,880.35,912.78和1 165.19。与对照组相比,在试验浓度范围,ZMP对MKN-45细胞的LDH活力虽有增强趋势但不显著,表明随着ZMP浓度的升高,肿瘤细胞呈现一定的凋亡趋势。

图6 ZMP对MKN-45细胞的LDH含量的影响Fig.6 The effect of ZMP on LDH content in MKN-45 cells
2.7 Western blot验证肿瘤细胞凋亡通路
根据MKN-45细胞毒性试验及细胞染色试验结果,ZMP可引起胃癌细胞MKN-45凋亡。为进一步研究ZMP诱导细胞MKN-45可能的凋亡机制,采用Western blot技术研究抗凋亡蛋白(Bcl-2)和促凋亡蛋白(Bax,Cyt-c 和 Caspase-3)的表达。
如图7所示,在ZMP质量浓度为1 600,3 200 μg/mL和6 400 μg/mL时,ZMP可抑制抗凋亡蛋白Bcl-2的表达,同时促进促凋亡蛋白Bax,Cyt-c和Caspase-3的表达,促进Cyt-c从线粒体释放至细胞质中。与对照组相比,Bcl-2蛋白和Bax蛋白的比值在ZMP的质量浓度为3 200 μg/mL时,明显下降。随着ZMP浓度的升高,活化的Cleavedcaspase-3与Caspase-3蛋白表达的比值明显升高。与对照组相比,Cyt-c的释放量增加趋势不显著。

图7 ZMP对Bcl-2家族,Caspase 3以及Cyt-c蛋白表达的影响Fig.7 The effect of ZMP on protein expressions of Bcl-2 family,Caspase 3 and Cyt-c
2.8 讨论
细胞凋亡常常伴随着各种相关凋亡通路的激活,包括Caspases,基因表达改变,线粒体紊乱以及ATP消耗[12]。虽然信号在细胞死亡的调节中发挥重要作用,但二级氧化产物的积累引起的细胞凋亡也是不可忽视的,尤其是细胞内氧化还原水平[11]。机体内SOD水平与细胞氧化还原相关,也是细胞内自由基清除效果的指示酶。MDA是脂质过氧化的二级代谢产物,代表体内脂肪氧化水平。LDH的过度积累会引起细胞损伤。以木枣多糖刺激MKN-45细胞,检测到MKN-45细胞的SOD水平下降,MDA和LDH水平升高,说明木枣多糖可通过降低肿瘤细胞内SOD水平,提高MDA水平来诱导肿瘤细胞凋亡。
Bcl-2家族蛋白在细胞凋亡中发挥关键作用,Caspase-3是细胞线粒体凋亡通路中非常关键的蛋白[13-14]。抗凋亡分子如Bcl-2可阻断Cyt-c的释放,从而中止细胞凋亡的联级反应;相反,促凋亡蛋白Bax,则可以促进Cyt-c从线粒体释放到细胞质,活化Caspase-9,Caspase-3,进而引起 DNA断裂,细胞形态和生物化学改变以致凋亡[15]。经ZMP处理,可减少MKN-45细胞的Bcl-2/Bax表达,增加Cyt-c和Caspase-3表达,表明ZMP可能通过线粒体内源途径介导MKN-45细胞凋亡 (如图8所示)。
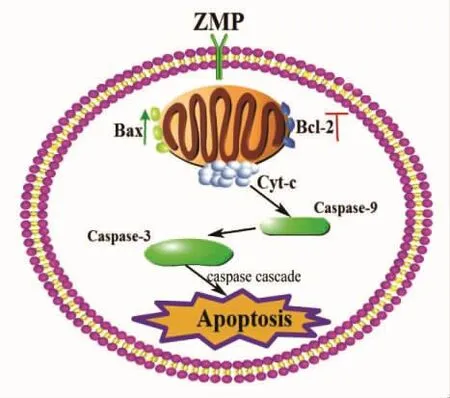
图8 木枣多糖通过线粒体内源途径诱导胃癌细胞MKN-45凋亡Fig.8 Possible schematic representations of mechanisms involved in the activation of apoptotic signaling pathway in MKN-45 cell by ZMP
3 结论
本研究表明:木枣多糖具有显著诱导肿瘤细胞凋亡的作用,并随着浓度的升高,细胞凋亡程度增强;其诱导肿瘤细胞凋亡与减弱SOD的活性,增加MD和LDH含量有关。木枣多糖可下调肿瘤细胞中Bcl-2/Bax的蛋白表达,上调Cyt-c和Cleaved caspase-3/Caspase-3的蛋白表达,木枣多糖可能通过线粒体介导的内源途径诱导胃癌细胞MKN-45凋亡。
