胃炎性纤维性息肉的临床和内镜特点分析
2019-08-12张馨梅张予蜀张振玉
张馨梅, 关 月, 吴 寒, 张予蜀, 张振玉
1.南京医科大学附属南京医院(南京市第一医院)消化科,江苏 南京 210006;2.中国人民解放军东部战区总医院消化科
胃炎性纤维性息肉(inflammatory fibroid polyp,IFP)为消化道良性肿瘤,发病率低,文献报道占胃息肉的0.1%~3.1%[1-2]。其发病机制尚未明确,病理以特殊排列的纤维组织和血管及嗜酸性粒细胞浸润为主要特征[3-5],而内镜及超声内镜下表现多样,临床上易误诊。本文对近年收治于南京市第一医院消化科及中国人民解放军东部战区总医院消化科的胃IFP病例进行回顾,对其临床症状、内镜表现、超声内镜表现、治疗及预后情况进行分析,以期对该病的诊治提供参考。
1 资料与方法
1.1 一般资料2011年1月1日至2017年12月31日在南京市第一医院消化科及中国人民解放军东部战区总医院消化科就诊,经内镜和/或超声内镜发现胃息肉/黏膜下肿物,并行内镜下切除,且病理确诊为胃IFP的患者共27例,男9例,女18例,男女比例为1∶2;年龄(60.5±9.9)岁(27~77岁)。1例患者临床表现为黑便,其余患者多表现为隐痛、腹胀等上腹不适或仅于胃镜体检时发现病灶。相关手术、治疗均签署知情同意书。
1.2 方法记录病灶的内镜表现、超声内镜表现,内镜下治疗方式及随访结果。
1.3 分析指标(1)病变的部位:胃窦、贲门等。(2)病变形态(山田分型):Ⅰ型:病灶的起始部平滑,病灶呈丘状隆起;Ⅱ型:病灶的起始部与周边黏膜分界明显,病灶呈半球状隆起;Ⅲ型:隆起病灶的起始部与周边成锐角,病灶基本为球形;Ⅳ型:隆起病灶基底部明显小于顶端,呈有蒂隆起。(3)病变大小。(4)超声内镜表现:病灶起源及回声特征。(5)内镜下治疗方式:内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)或内镜下黏膜切除术(endoscopic mucosal resection, EMR)。

2 结果
2.1 内镜表现27例IFP患者中,单发26例,多发(2枚)1例。位于胃窦26例,贲门1例。山田分型Ⅰ型3例,Ⅱ型17例,Ⅲ型3例,Ⅳ型5例,其中1例多发病灶的2枚病灶分别为Ⅱ型和Ⅲ型(见表1、图1)。病灶直径(1.2±0.5)cm(0.6~2.5 cm)。病灶表面溃疡/糜烂7例,直径(1.4±0.6)cm;其中病灶表面溃疡1例,直径2.5 cm,患者表现为黑便(见图2)。表面黏膜光滑20例,直径(1.1±0.3)cm。表面糜烂/溃疡病灶与表面光滑病灶的大小差异无显著统计学意义(P>0.05)。
2.2 超声内镜表现27例IFP患者中,15例术前行超声内镜检查。其中,3例起源于黏膜肌层,12例起源于黏膜下层,向黏膜肌层内延伸,固有肌层均完整(见图3)。回声性质均为低回声团块,内部回声欠均匀。
2.3 治疗及预后27例IFP患者中,15例行EMR切除,12例行ESD切除,术后无出血、穿孔等并发症。病理均符合IFP特征(见图4),其中1例患者行免疫组化染色,结果示CD34(-)、CD117(-)、DOG-1(-)、SMA(+)、Ki-67(<1%)。6例患者术后0.5~1年复查胃镜,未见复发。
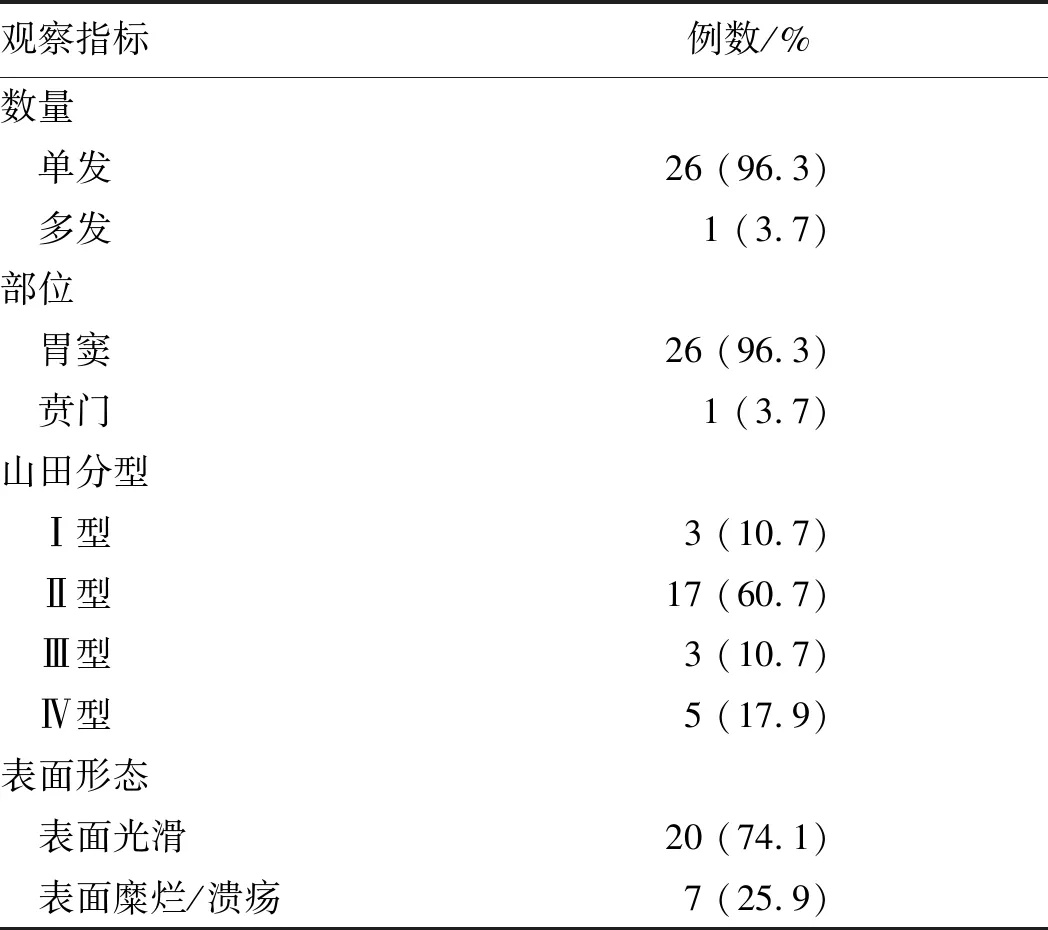
表1 胃IFP患者的内镜特征Tab 1 Endoscopic characteristics of gastric IFP patients

图1 胃窦多发IFP; 图2 胃窦部直径约2.5 cm的带蒂IFP,表面溃疡形成伴出血; 图3 超声内镜显示胃壁黏膜下层内低回声病变,向黏膜肌层延伸; 图4 活检组织镜检示,增生的梭形细胞围绕小血管呈“洋葱皮”样改变,伴大量嗜酸性粒细胞浸润(HE 200×)
Fig 1 Multiple IFP located in the gastric antrum; Fig 2 A 2.5 cm large, ulcerated, pedunculated mass located in the gastric antrum; Fig 3 EUS showed a hypoechoic tumor located in the submucosal layer and extended to the laminae muscularis mucosae; Fig 4 Microscopic findings of the biopsy specimen obtained from the tumor. Inflammatory infiltrates rich in eosinophils andproliferation of spindle cells were seen, and the spindle cells presented whorl patterns around the small vessels (HE 200×)
3 讨论
IFP是一种较少见的良性消化道肿瘤,可见于全消化道。研究[6]发现,IFP最好发的部位是胃,约占70%,但也有研究发现,IFP的好发部位依次为大肠(37%)、胃窦(23%)和小肠(20%)[7]。该肿瘤高发年龄为50~70岁,统计资料显示男女发病率无明显差异,女性略高。本研究患者年龄区间与文献基本相符,男女比例悬殊可能与样本量较小,和女性就诊依从性较高有关。
IFP的具体致病因素和组织起源仍未明确。以往认为IFP是由感染、创伤、炎症修复导致的非肿瘤性病变。有学者认为寄生虫、幽门螺杆菌的感染均可能是胃IFP发病的诱因[8]。但根除幽门螺杆菌是否可缩小病灶在不同报道中结果不尽相同[9-10]。近年来,分子生物学研究揭示,IFP与血小板衍生生长因子受体α (platelet-derived growth factor receptor alpha,PDGFR-α)基因激活突变有关,目前广泛认同IFP是一种伴有PDGFR-α基因突变的消化道良性间叶源性肿瘤[5,11]。
IFP多数不引起明显的临床症状,较多见的临床表现有腹痛、腹胀等,也有报道指出IFP可引起消化道梗阻或出血[12-13]。本研究中,大多数患者表现为轻度上腹痛、腹胀等非特异性症状,或仅在体检时发现,1例患者因病变表面溃疡出血而导致黑便。文献报道胃IFP好发于胃窦部,多为单发实性占位,直径多<1.5 cm,表面常见糜烂或溃疡[14-15]。本研究所见病变除1例位于贲门外,其余均发生于胃窦部,平均直径<1.5 cm,最大病变直径约2.5 cm(黑便患者)。山田Ⅰ、Ⅱ、Ⅲ、Ⅳ型均可见,以山田Ⅱ型最为常见(60.7%),且表面是否发生糜烂或溃疡与病变大小无关。
本研究有15例患者行超声内镜检查,病变大部分起源于黏膜下层,并向黏膜肌层延伸,呈低回声改变,内部回声欠均匀,不累及固有肌层,提示IFP为非上皮源性病变。对于部分形态呈黏膜下隆起的IFP,需要注意与胃平滑肌瘤、异位胰腺、胃间质瘤等相鉴别,此三种病变在超声内镜下均表现为低回声,部分可来源于固有肌层,而IFP几乎不侵犯固有肌层[16]。
IFP内镜表现多样,而内镜下常规黏膜活检易误诊为增生性息肉,确诊主要靠切取后行病理检查。IFP镜下以梭形细胞围绕小血管,及黏膜腺体形成经典的“洋葱皮样”结构为特点,部分呈交织状或束状排列,伴有较多嗜酸细胞为主的炎性细胞浸润[5]。文献报道100%病例表达Vimentin,82%~100%病例表达CD34, 不同程度的灶性表达SMA,但不表达CD117、CD10、DOG-1、Desmin、S-100、Ⅷ因子及间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)[17]。当与间质瘤、平滑肌瘤等其他间叶性来源的肿瘤鉴别困难时,可行免疫组化检查。本研究1例患者行免疫组化,符合上述特征。
治疗上,IFP的治疗较早时多采用外科手术,近年来随着消化内镜技术的发展,EMR和ESD成为主要的治疗方式。本研究经超声内镜判断起源于胃壁黏膜肌层+黏膜下层的病变均选择ESD治疗,患者均未出现并发症,随访患者均未见复发。IFP被普遍认为是一种胃肠道良性病变,切除后罕见复发。但值得关注的是,迄今为止,已有2篇文献报道了侵袭性IFP病例,病变突破黏膜下层,侵犯至固有肌层及浆膜层,经外科手术后病理确诊[18-19]。因而对于怀疑起源于黏膜下层的病变,术前超声内镜对于判断病变深度、选择手术方式具有重要的参考价值。
