大黄素对慢性压迫性损伤大鼠脊髓细胞因子的影响
2019-08-11吴智兵林兴栋
王 琛, 吴智兵, 林兴栋, 陈 鹏
(1.广州中医药大学,广东 广州510400;2.广州中医药大学第一附属医院,广东 广州510400;3.贵州中医药大学,贵州贵阳550000)
慢性压迫性损伤动物模型为外周单一神经损伤模型[1],其症状与人类因外周神经损伤而引起痛觉过敏相似,故该模型常用来进行神经病理性疼痛药物疗效评估及机制研究[2],许多研究者对不同种类细胞因子在神经病理性疼痛中的作用表现出越来越多的关注[3]。
大黄是具有活血祛瘀、清泄湿热作用的中药,其成分中以大黄素为代表的蒽醌类物质具有显著调节炎性细胞因子(如IL-1β、IL-10 等) 表达的作用[4-6]。前期课题组[7]报道,大黄素对慢性压迫性损伤大鼠具有一定镇痛作用;目前已有研究者发现,大黄素可抑制慢性压迫性损伤模型中初级感觉神经元受体表达,从而起到了改善疼痛的作用[8]。因此,本实验探讨大黄素对慢性压迫性损伤大鼠脊髓的影响,为其镇痛机制研究提供实验依据。
1 材料
SPF 级雄性健康SD 大鼠,体质量180~220 g,购于广州中医药大学动物实验中心,实验动物生产许可证号SCXK(粤) 2013-0034。 大黄素 (含 有量>98%, 批号MUST-15042711) 购于成都曼斯特生物科技有限公司。IL-1β、IL-10 抗体购于英国Abcam 公司;BCA 蛋白浓度测定试剂盒、固定液等试剂购于上海碧云天生物技术有限公司。2390 系列von Frey 电子测痛仪、390 爪刺激痛觉测试仪(美国IITC-Life Science 公司);BX-60 光学显微镜、显微摄像仪(日本Olympus 公司);IPP6.0 软件。
2 方法
2.1 分组、造模及给药 42 只大鼠随机分为假手术组、模型组、大黄素组,每组14 只,按照文献[9] 方法进行造模,在坐骨神经分叉处上5 mm 采用4-0 丝线间隔约1.0 mm进行4 次结扎。从术后第1 天开始,按照前期研究确定的剂量给药[7],大黄素(50 mg/kg) 灌胃,1 次/d,共15 d。
2.2 行为学测试 分别于造模前2 d 及造模后第3、7、11、15 天进行机械痛觉和热痛觉测试以评估疼痛情况。上午10 点至下午6 点将大鼠置于检测环境30 min 后,由不同实验人员进行行为学测试,参考文献[10] 方法,将大鼠置于有机玻璃箱(22 cm×12 cm×22 cm) 中,底部为金属网,电子测痛仪垂直刺激大鼠左侧足底正中,逐渐加压至其出现疼痛反应,表现为抬足或舔足,主机显示屏上的机械缩足反射阈值。休息2 h 以上后参照文献[11] 方法,将大鼠置于有机玻璃箱(20 cm×15 cm×18 cm) 中,底部为玻璃板,热辐射刺激仪移动到其后足正下方,按下开始键,大鼠感觉到疼痛出现抬足时停止,主机屏幕时间为热缩足潜伏期,时间上限设置为20 s。每足机械缩足反射阈值、热缩足潜伏期均测量5 次,每次间隔10 min,取平均值。
2.3 脊髓IL-1β、IL-10 阳性标记检测 行为学测试后每组随机取6 只大鼠,腹腔注射水合氯醛(350 mg/kg) 麻醉,暴露心脏,插管灌流固定,先以0.9%氯化钠溶液冲洗至流出液澄清,再以4%多聚甲醛灌流至四肢僵硬,暴露脊髓后,取出L4~L6 损伤侧组织,浸泡在4%多聚甲醛溶液中固定24 h;剩余大鼠于术后15 d 取材完毕。处理后的组织石蜡包埋,切片(片厚4 μm),放入片盒后于-20 ℃冰箱中保存。石蜡切片脱蜡水化后,PBS 缓冲液冲洗3 次,每次5 min 进行抗原修复。适当比例稀释IL-1β、IL-10 一抗,37 ℃下孵育1 h 以上,PBS 缓冲液冲洗3 次,每次5 min,再加入生物素标记二抗,37 ℃下反应30 min。DAB 显色,苏木素复染5 min,盐酸酒精分化,梯度酒精脱水,二甲苯透明,晾干,中性树脂封片,用显微镜及显微摄像仪对染色组织切片进行观察,图片通过IPP 6.0 软件进行分析,每个切片随机取5 个视野(×400),计算出阳性颗粒的平均光密度值。
2.4 脊髓IL-1β、IL-10 蛋白表达检测 行为学测试后每组随机取6 只大鼠,腹腔注射水合氯醛(350 mg/kg) 麻醉,取出左侧L4~L6 段脊髓,尖镊于冰生理盐水中将软脊膜剥离,放入-80 ℃超低温冰箱中备用;术后15 d 同法取出各组剩余大鼠损伤侧脊髓。在脊髓组织中加入RIPA(强)裂解液(1 mg 组织∶20 μL 裂解液) 充分混匀、研磨,超声裂解后,加入5×Loading Buffer 蛋白上样缓冲液(5 ∶1),100 ℃煮沸5 min使其变性,13 000 r/min 离心5 min,取上清液,BCA 法进行蛋白定量。电泳分离蛋白后,转膜至PVDF 膜,于脱脂牛奶室温摇床下封闭1 h,4 ℃摇床下孵育IL-1β 抗体(1 ∶1 000)、IL-10(1 ∶1 000)、GAPDH 抗体(1 ∶1 000) 过夜,TBST 漂洗3 次,每次10 min,加入1∶40 000 稀释二抗中,室温下摇床孵育1 h,TBST 再漂洗3次,每次10 min,ECL 发光液显色曝光,图片通过IPP 6.0软件进行分析。
2.5 统计学分析 通过SPSS 21.0 软件进行重复测量方差分析,数据以表示,满足方差齐性者组间比较采用LSD 法,不满足者采用Dunnett's T3 法。以P<0.05 为差异有统计学意义。
3 结果
3.1 行为学测试 表1 ~2、图1 显示,术后3、7、11 d,模型组大鼠机械痛、热痛阈值较假手术组显著降低(P<0.01),大黄素组两者较模型组显著升高(P<0.05,P<0.01);术后15 d,模型组两者仍较假手术组显著降低(P<0.01),而大黄素组与模型组相比显著升高 (P <0.01)。
表1 各组大鼠机械痛阈值比较(g,n=14)

表1 各组大鼠机械痛阈值比较(g,n=14)
注:与假手术组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01
组别 基础值 术后3 d 术后7 d 术后11 d 术后15 d假手术组 53.69±1.33 53.76±2.70 53.63±1.10 53.04±1.76 53.43±1.90模型组 54.31±1.23 34.17±3.75## 37.56±2.95## 35.79±1.88## 34.17±3.75##大黄素组 54.11±0.90 40.72±3.06##* 41.43±2.46##** 42.58±1.64##** 44.34±2.34##**
表2 各组大鼠热痛阈值比较(s,,n=14)

表2 各组大鼠热痛阈值比较(s,,n=14)
注:与假手术组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01
组别 基础值 术后3 d 术后7 d 术后11 d 术后15 d假手术组 14.67±1.95 14.27±1.55 14.63±2.00 13.91±1.76 15.03±2.28模型组 15.22±1.84 7.72±0.80## 7.30±0.67## 7.86±0.68## 8.23±1.13##大黄素组 15.13±1.79 8.53±1.16##* 8.96±0.82##** 9.43±1.43##* 12.13±1.47##**

图1 各组大鼠机械痛阈值(A) 与热痛阈值(B)
3.2 IL-1β、IL-10 阳性标记 图2 ~3 显示,术后7 d,模型组、大黄素组IL-1β 表达与假手术组相比显著升高(P<0.05),大黄素组IL-10 表达显著高于假手术组、模型组(P<0.05);术后15 d,模型组IL-1β 表达仍显著高于假手术组(P<0.05),而大黄素组较假手术组、模型组显著降低(P<0.05),同时大黄素组、模型组IL-10 表达均较假手术组显著降低(P<0.05)。

图2 各组大鼠脊髓IL-1β 平均光密度值(×400)

图3 各组大鼠脊髓IL-10 平均光密度值(×400)
3.3 IL-1β、IL-10 蛋白表达 图4 ~5 显示,术后7 d,模型组IL-1β 蛋白表达与假手术组相比显著升高(P<0.05),大黄素组较假手术组、模型组显著升高(P<0.05);术后15 d,模型组IL-1β 蛋白表达仍显著高于假手术组(P <0.05),大黄素组较假手术组、 模型组显著降低 (P <0.05),但3 组IL-10 蛋白表达无显著差异(P>0.05)。
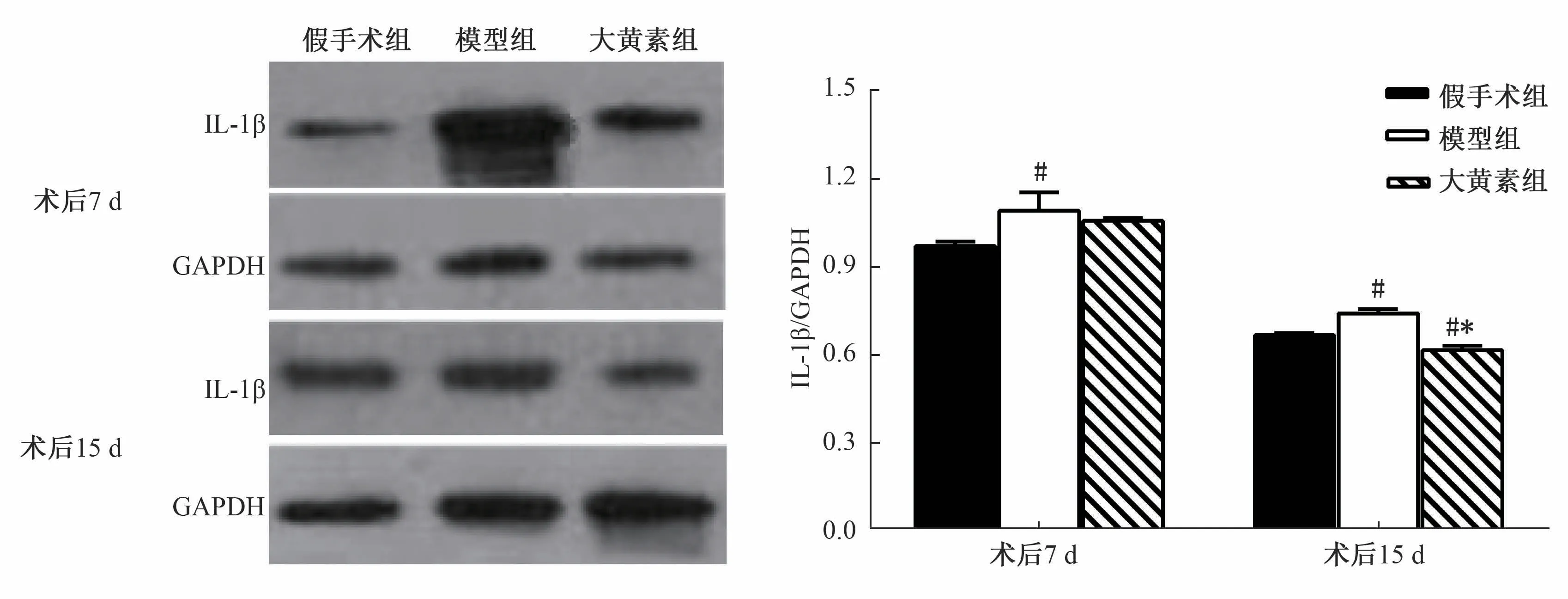
图4 各组大鼠脊髓IL-1β 蛋白表达

图5 各组大鼠脊髓IL-10 蛋白表达
4 讨论
大黄素具有有抗病毒、神经保护、抗炎、抗肿瘤等药理作用,是大黄主要有效成分之一,也存在于芦荟、何首乌等常用中草药中[12-14]。在胶原诱导关节炎动物模型研究中发现,大黄素能通过抑制NF-κB 途径来抑制巨噬细胞释放炎症因子[15-16];在急性胰腺炎模型中,大黄素能通过抑制ER 压力传感器IRE1α 及其下游分子来阻止JNK、p38 MAPK 磷酸化,进而抑制IL-1β 释放[17-18],但关于大黄素镇痛效果及其机制的报道相对较少。本研究将大黄素应用于慢性压迫性损伤大鼠的治疗,发现它在术后7 d 开始展现出一定镇痛效果,至术后15 d 效果明显优于模型组,而且对IL-1β、IL-10 有一定调节作用。
在慢性压迫性损伤动物模型中,疼痛症状往往依赖于外周感觉纤维损伤后引发的脊髓背角中神经元异常兴奋性反应,以及不同类型神经胶质细胞的激活[19-20]。细胞因子作为胶质细胞激活的下游因子,是一种非结构式蛋白,根据其生物活性可分为促炎性细胞因子(如IL-1 家族) 和抗炎性细胞因子(如IL-10 家族)。其中,胶质细胞激活后释放促炎性细胞因子(如IL-1β 等),可增加脊髓背角神经元兴奋性,并且提高其中NMDA 受体磷酸化水平,进而激活p38 MAPK,最终产生痛觉过敏症状[21];IL-10 可降低NFκB 活性,导致包括IL-1β、TNF 在内的促炎性细胞因子水平衰减[22]。文献[23-24] 报道,降低IL-1β 水平可达到缓解疼痛的作用,而在慢性压迫性损伤模型和紫杉醇引起的疼痛模型中注射外源性IL-10 时,可缓解异常性疼痛,表明神经病理性疼痛形成机制中IL-1β、IL-10 水平变化具有重要作用。本实验采用免疫组化和Western blot 技术检测慢性压迫性损伤大鼠脊髓中IL-1β、IL-10 水平,发现前者显著升高;术后7 d 大黄素灌胃后能促进后者,但15 d 时反而被抑制,同时在术后各个时间点行为学测定中,大黄素组大鼠痛觉过敏症状有所改善,与细胞因子检测结果符合。由此认为,IL-1β、IL-10 作为2 类具有不同作用的细胞因子,参与了慢性压迫性损伤大鼠术后痛觉过敏的形成。
综上所述,大黄素可降低促炎性细胞因子IL-1β 水平、升高抗炎性细胞因子IL-10 水平,从而产生综合性的效果,改善慢性压迫性损伤大鼠疼痛症状。但不同细胞因子在诸多疾病形成机制中均有重要作用,故若要验证大黄素抑制神经病理性疼痛的作用靶点,还需进行具体通路上、下游指标的检测,如MAPK、NF-κB 等,从而为其作用机制探索提供更充足的实验依据。
