康艾注射液联合TACE 治疗原发性肝癌的Meta 分析
2019-08-11李浩田魏士长邹亚峰赵艳玲
马 骁, 何 璇, 李浩田, 魏士长, 邹亚峰, 赵艳玲*
(1.成都中医药大学药学院,中药材标准化教育部重点实验室,四川 成都611137;2.成都市新都区石板滩镇卫生院,四川 成都610511;3.中国人民解放军总医院第五医学中心药学部,北京100039)
肝癌是世界五大常见恶性肿瘤之一,位居癌症致死原因的第三位,年均诊断病例约70 万例,原发性肝癌占肝癌总发生数的90%,其中55%发生在我国[1],手术与肝移植是常用治疗手段,但由于它起病隐匿,目前仅有30%的病例可在早期诊断,大多经确诊后已是中晚期,难以根治[2]。肝动脉插管栓塞化疗术(TACE) 是目前非手术治疗肝癌的首选方法,国内外多项循证医学研究均证实它与化疗、手术相比具有创伤面积小、效果稳定、恢复快速的特点,同时副作用也较少[3],但它并不能完全阻断肿瘤环境血液供应,并会导致肝门静脉对肿瘤细胞代偿性供血效应的增加,故仍有一定局限性, 并且多次进行也会导致肝功能迅速恶化[4]。
原发性肝癌在中医属于“癥瘕积聚” 的范畴,正气亏虚是其发生基础,湿热病邪外感、久治不愈、蕴结癌毒则是重要诱因[5]。康艾注射液具有益气扶正、解毒抗癌的功效,临床常用于原发性肝癌的辅助治疗[6],近年来已有许多关于它联合TACE 的临床研究[7-8],而且有少量研究采用Meta分析,但缺少亚组分析,难以明确干预措施剂量、疗程等因素与病情之间的关系,同时对安全性系统分析涉及较少。因此,本研究采用Meta 分析,对康艾注射液联合TACE 治疗原发性肝癌的疗效及不良反应进行系统评价,并进一步通过亚组分析为其临床合理、安全、有效应用提供参考。
1 方法
1.1 文献检索 检索CNKI、万方、维普(VIP)、中国生物医学文献(CBM)4 个中文数据库,以及Pubmed、Embase、Cochrane Library 3 个英文数据库,时间从建库起至2018 年12 月,完成对文献的预搜索、搜索与收集工作。根据PICOS 原则,在检索时将研究题目分解为P(原发性肝癌)、I(康艾注射液与TACE)、C(TACE)、S(随机对照试验),以“康艾注射液+TACE+原发性肝癌” 为主题词预检索中英文数据库,并根据结果与匹配情况进一步优化检索策略,进行最终检索与收集文献。
1.2 纳入与排除标准
1.2.1 纳入标准 ①与随机对照试验相关的研究文献;②原发性肝癌的病情诊断经过临床、病理学、细胞学证实或影像学检查,有明显的TNM 分期、BCLC 分级或肝功能Child-Pugh 分级;③观察组为康艾注射液联合TACE,对照组为单用TACE或伴随后续保肝治疗。
1.2.2 排除标准 ①非随机对照试验(包括个案报道、文献综述、动物实验、前后对照研究等);②重复发表的学术论文或会议文章,学位论文与期刊论文重复者酌情使用报道详细的相应文献;③结局疗效评定不全面、不规范或未具体公布准确结果的相关文献;④观察组给药情况不明确,对照组未用TACE 或用其他中药联合TACE 进行干预;⑤对原发性肝癌的报道未提及TNM 分期、BCLC 分级或肝功能Child-Pugh 分级的文献。
1.3 数据提取 将文献进行整理汇总,严格按照Cochrane 协作网的系统评价工作手册相关标准进行数据筛选与评估,并提取出患者基线情况、给药信息、疗效指标等信息。
1.4 方法质量评价 参照Cochrane 协助网制订随机对照试验质量评估标准,采用随机方法、分配隐藏、实施者与参与者双盲、结局评估盲法、不完整结局数据、选择性报告、其他偏倚7 个维度的评价项目,对纳入文献质量进行评价,明确其偏倚情况与结果可靠性。
1.5 统计方法 采用Revman 5.3 软件进行数据统计分析,二分类变量采用相对危险度(RR),连续性变量采用平均差值(MD)。若合并的数据无明显异质性(P≥0.10,I2≤50%),采用固定效应模型;异质性明显(P≤0.10,I2≥50%),采用随机效应模型。然后,针对文献数量充分的指标采用漏斗图,用于分析是否存在发表偏倚。
2 结果
2.1 文献检索与筛选 共检索出1 253 篇相关文献,在初步排除重复文献747 篇及综述或评论、不相关研究419 篇后,共收集到87 篇进行全文评价,再通过阅读全文,按照纳入、排除标准筛选出符合Meta 分析的12 篇[9-20]。流程见图1。
2.2 纳入研究基本特征 12 项研究中原发性肝癌患者有747 例,其中观察组381 例,对照组366例;单个随机对照试验样本量最多80 例,最少50例;年龄18 ~72 岁;均报道了患者诊断情况,处于Ⅱ~Ⅳ期,肝功能分级Child A ~Child C;疗程14~60 d。见表1。

图1 文献检索与筛选流程Fig.1 Literature retrieval and screening process
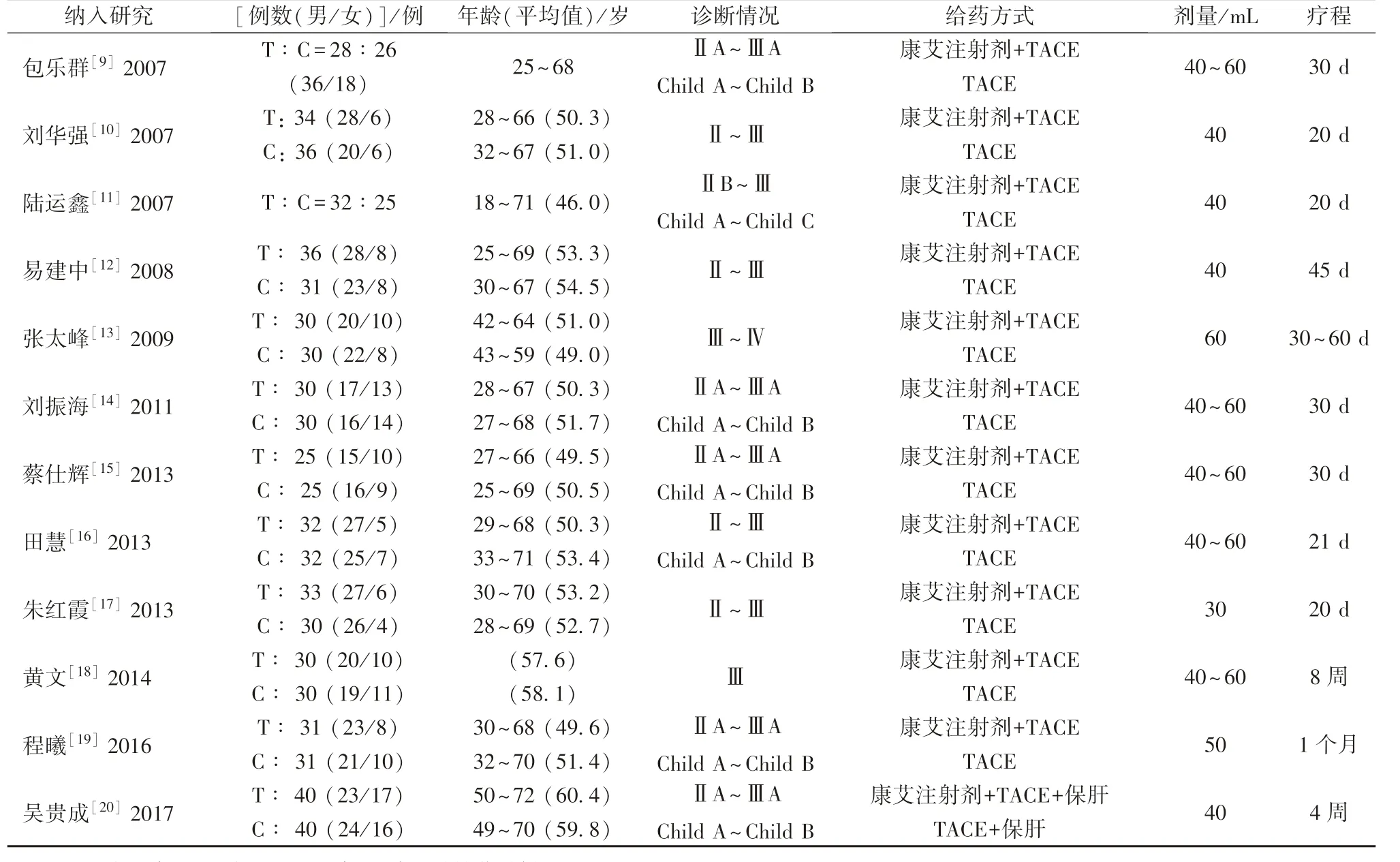
表1 纳入研究基本特征Tab.1 Basic characteristics of included studies
2.3 纳入研究质量评价 12 项研究均提及随机分配组别,其中5 项采用随机数字表或随机信封方法,而1 项以入院顺序作为随机方法,具有高风险;5 项采用正确的分配隐藏相关方法;11 项对研究指标进行充分报道;2 项数据可能不完整;1 项未按照研究方法对指标进行充分说明,存在选择性报道的风险,同时可能有其他偏倚;所有研究均未采用双盲法及对结局评价实施盲法。见图2。
2.4 主要结局指标Meta 分析
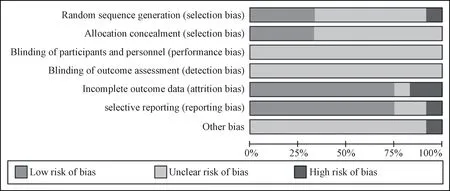
图2 纳入研究质量评价Fig.2 Quality evaluation of included studies
2.4.1 有效率 所有研究均报道了有效率(完全缓解+部分缓解),由于各项研究之间无明显异质性(P=0.67,I2=0),故采用固定效应模型,结果见图3,可知观察组有效率显著高于对照组[RR =1.41,95%CI(1.23,1.63),P<0.000 01]。
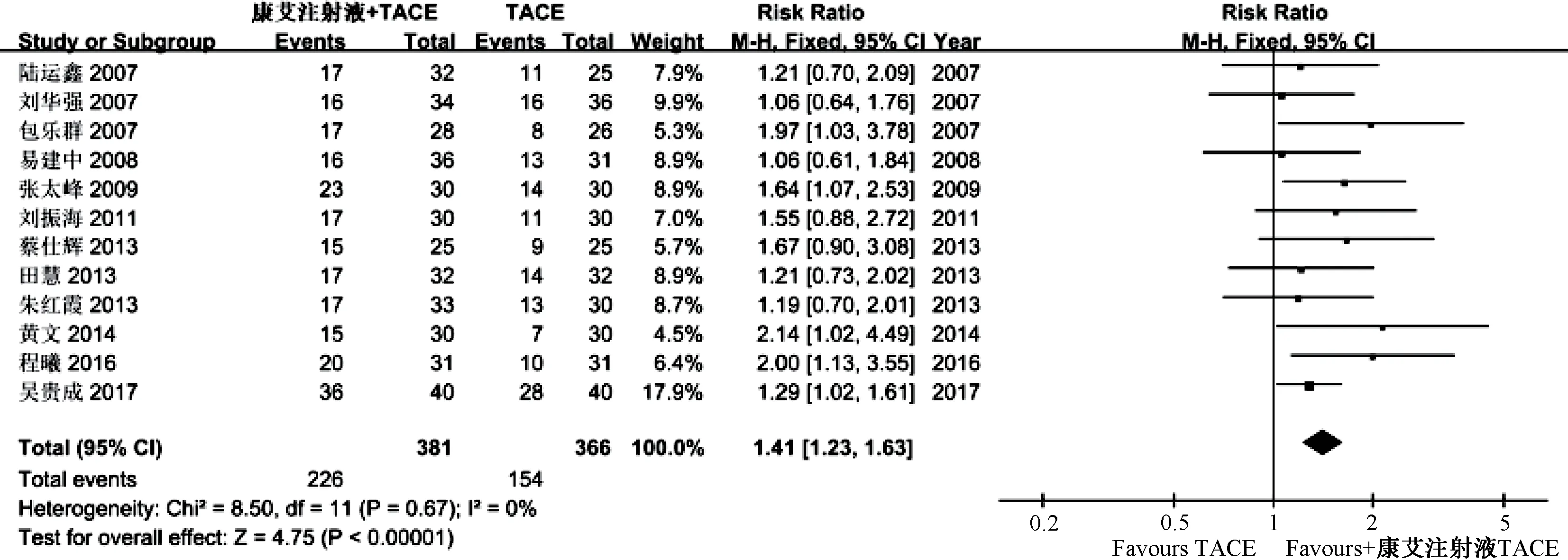
图3 有效率Meta 分析Fig.3 Meta-analysis of effective rates
2.4.2 KPS 评分 4 项研究报道了KPS 评分,由于各项研究之间无明显异质性(P =0.90,I2=0),故采用固定效应模型,结果见图4,可知观察组与对照组相比可显著提高KPS 评分 [RR =2.10,95%CI(1.49,2.95),P<0.000 1]。
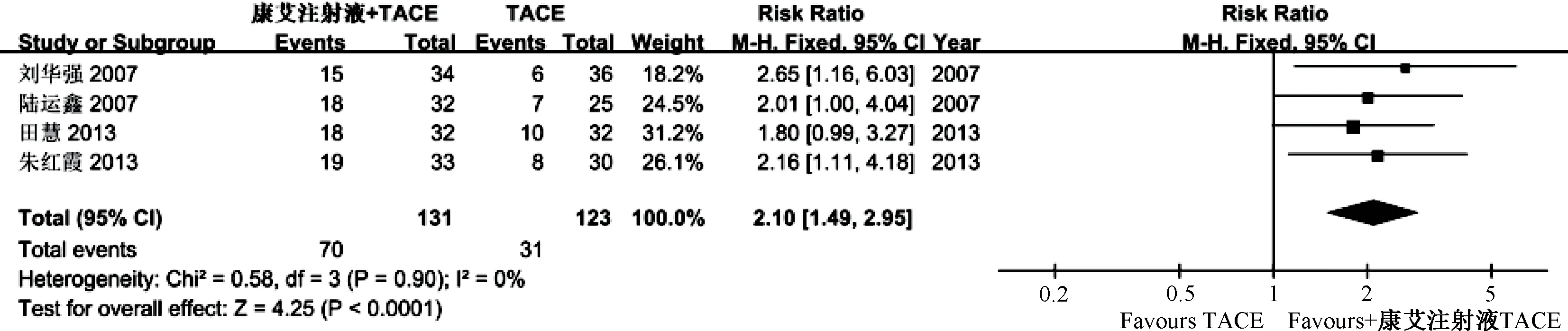
图4 KPS 评分Meta 分析Fig.4 Meta-analysis of KPS scores
2.5 次要结局指标Meta 分析 3 项研究报道了CD3、CD4 细胞活性,2 项研究报道了CD8、NK细胞活性,由于CD4、CD8 细胞活性之间无明显异质性(P =0.70,I2=0;P =0.49,I2=0),故采用固定效应模型;CD3、NK 细胞活性之间有明显异质性(P =0.002,I2=84%;P =0.05,I2=73%),故采用随机效应模型,结果见图5,可知观察组与对照组相比可显著提高T 淋巴细胞亚群(CD3、CD4、CD8) [RR =7.30,95%CI(3.75,11.02),P =0.000 1;RR =4.07,95%CI(3.03,5.11),P<0.000 01;RR =3.88,95%CI(2.60,5.16),P<0.000 01]、 NK 细 胞 [RR =8.00, 95%CI(5.21,10.80),P<0.000 01] 活性。
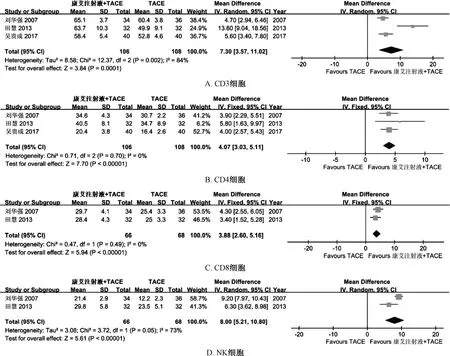
图5 细胞活性Meta 分析Fig.5 Meta-analysis of cell viabilities
2.6 给药剂量与疗程亚组分析 本研究将给药剂量分为30 ~40、50 ~60 mL 2 个亚组,同时将疗程分为14~28、30~60 d 2 个亚组,由于各亚组之间无明显异质性,故采用固定效应模型(P =0.93,P =0.59,P =0.97,P =0.71,I2=0),结果见图6,可知在30~40 mL 给药剂量下与观察组与对照组相比有提高有效率的趋势,但差异无统计学意义[RR=1.18,95%CI(0.97,1.43),P =0.09],而在50~60 mL 下有显著性差异[RR =1.79,95%CI(1.26,2.54),P =0.001];在14 ~28、30 ~60 d疗程下观察组与对照组相比可显著提高有效率[RR =1.20, 95%CI (1.00, 1.45), P =0.05;RR=1.65,95%CI(1.33,2.05),P<0.000 01]。
2.7 安全性分析
2.7.1 一般不良反应 分别有8、4、3、2 项研究报道恶心呕吐、腹痛、发热、神经毒性,由于各项研究之间无明显异质性(P =0.10,I2=42%;P =0.15,I2=43%;P =0.65,I2=0;P =0.49,I2=0),故采用固定效应模型,结果见图7,可知观察组恶心呕吐、腹痛发生率显著低于对照组[RR =0.79,95%CI(0.66,0.94), P =0.009; RR =0.64,95%CI(0.47,0.88), P =0.006], 而发热、神经毒性发生率无显著性差异[RR =0.76,95%CI(0.48,1.22),P =0.26;RR =0.58,95%CI(0.14,2.32),P =0.44]。
2.7.2 血液学毒性 分别有3、5、3、3 项研究报道了血液学毒性,由于各项研究之间无明显异质性,故采用固定效应模型,结果见表2,可知观察组较对照组可显著降低血液毒性(P<0.000 1) 及白细胞、血红蛋白减少(P<0.05) 发生率,但对血小板减少发生率无显著影响(P>0.05)。
2.7.3 肝功能损伤 分别5、2、2 项研究报道了肝功能损伤,由于各项研究之间无明显异质性,故采用固定效应模型,结果见表3,可知观察组较对照组可显著降低肝功能异常 (P <0.000 01) 及ALT 异常、胆红素升高(P<0.05) 发生率。
2.7.4 肾功能损伤 分别2、2、2 项研究报道了肾功能损伤,由于各项研究之间无明显异质性,故采用固定效应模型,结果见表4,可知观察组、对照组在肾功能异常、尿素氮异常、肌酐异常发生率方面均无显著性差异(P>0.05)。

图6 给药剂量与疗程亚组分析Fig.6 Subgroup analysis of administration dosages and therapeutic courses

表2 康艾注射液联合TACE 对血液学毒性的影响Tab.2 Effect of Kangai Injection combined with TACE on hematologic toxicity
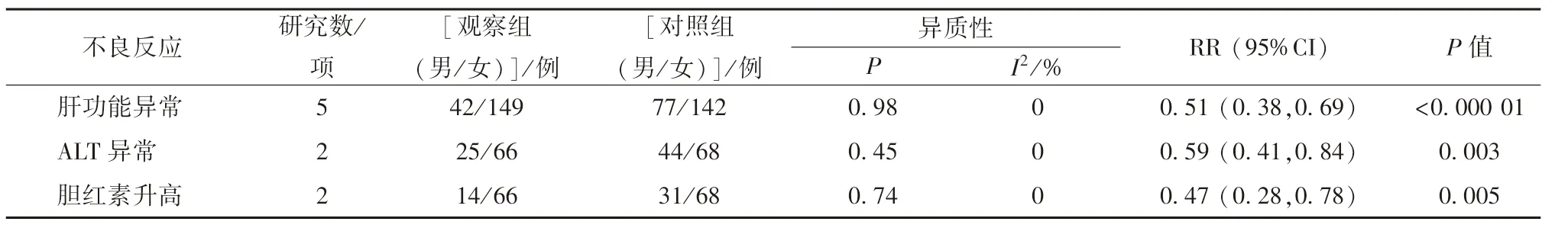
表3 康艾注射液联合TACE 对肝功能损伤的影响Tab.3 Effect of Kangai Injection combined with TACE on hepatic impairment

图7 一般不良反应Meta 分析Fig.7 Meta-analysis of of general adverse reactions
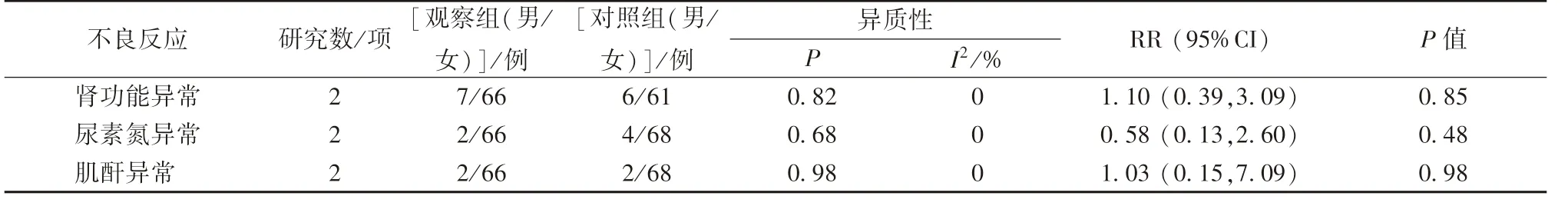
表4 康艾注射液联合TACE 对肾功能损伤的影响Tab.4 Effect of Kangai Injection combined with TACE on renal impairment
2.8 发表偏倚分析 以有效率为指标,绘制漏斗图分析潜在的发表偏倚情况,结果见图8,可知存在一定发表偏倚。
3 讨论
康艾注射液由黄芪、人参、苦参素组成,临床常用于原发性肝癌、肺癌、直肠癌、胃癌等恶性肿瘤的治疗,尤其在治疗原发性肝癌方面,不仅能抑制肿瘤细胞的生长,提高机体免疫力,同时还可减轻化疗所导致的不良反应,进而提高患者生活质量[21]。现代研究表明,方中黄芪可明显抑制小鼠移植性肿瘤S-肝癌生长,并通过改善T 细胞活性,提高CD3,调节CD4 与CD8 比例来增强机体免疫力,从而达到抑制肿瘤增殖的目的[22];人参中的皂苷类成分Rg3 能有效抑制人肝癌细胞的生长,可能作用与阻滞肿瘤细胞G0/G1 期过渡阶段,降低肝癌细胞侵袭与转移过程中重要蛋白PCNA、MMP-9 表达密切相关[23];苦参素可通过促进肿瘤细胞凋亡、阻滞细胞周期蛋白D1 表达等途径,从而有效抑制人肝癌细胞HepG2 增殖[24]。
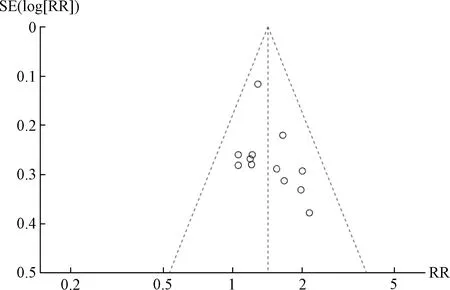
图8 有效率漏斗图Fig.8 Funnel plot for effective rates
目前,尽管部分临床与基础研究均显示康艾注射液联合TACE 是有效延迟原发性肝癌进程的重要手段,也有相关循证药学研究为相关治疗提供高证据级别的支撑,但缺乏对给药剂量、疗程等因素的分析,而且鲜有涉及安全性分析,难以为临床应用提供直接指导。 本研究发现, 康艾注射液联合TACE 相较于单用TACE 可显著增加有效率和KPS评分,同时提高T 细胞亚群(CD3、CD4、CD8)、NK 细胞活性,在50~60 mL、30~60 d 条件下疗效更明显,而且一般不良反应、血液学毒性、肝功能损伤发生率更低,安全性更高。
然而,本研究仍有着局限性。首先,纳入文献中随机对照试验在质量评估方面均存在偏倚风险,所提供的细节内容(如随机化方法、分配隐藏、盲法、数据完整性、选择性报道等) 信息不足,对所得结果的证据力度存在一定影响;其次,由于部分随机对照试验对安全性指标的描述不够细致,难以对其作进一步亚组分析来明确具体特征;最后,由于纳入文献中随访等条件的限制,故缺少长期生存指标(如总生存期、无进展生存期) 的报道,难以分析长期受益情况,整体有效性评价尚有缺陷。因此,建议今后临床导致试验可采用大样本、多中心、 随机、 双盲等高质量方法进行设计[25],并结合康艾注射液联合TACE 在给药剂量、疗程、不良反应发生率方面的特征,严格随访并采集长期有效性指标,从而获取联合用药治疗原发性肝癌的高水平证据,为进一步临床实践提供指导。
