左心房心外膜脂肪结构与心房颤动患者首发缺血性脑卒中的关系
2019-08-08陆曹杰张丹沈才杰邬武斌吕迪王菊飞张彬傅杰
陆曹杰 张丹 沈才杰 邬武斌 吕迪 王菊飞 张彬 傅杰
已有研究证实心外膜脂肪组织(epicardial adipose tissue,EAT)结构异常除可引起心房颤动外[1-2],也可导致缺血性脑卒中(ischemic stroke,IS)及恶化冠状动脉硬化[3-4],可能因EAT产生的多种生物因子引起心肌组织慢性炎症及纤维化,参与血管内皮功能损伤、血小板激活及纤维蛋白素原增加等有关[5]。在EAT分布部位研究上,心室和心房EAT似乎具有类似引起心房颤动发生及加剧的效应,左心房(如肺静脉、左心房后壁)是常见的引起心房颤动及IS区域,其周围同时富含迷走神经节[7-8],我们推测左心房心外膜脂肪组织(left atrium epicardial adipose tissue,LA-EAT) 结构和功能对心房颤动IS作用更具有代表性,而LA-EAT结构和功能的关系,以及这种关系对IS的影响权重尚未完全阐明。本研究旨在探讨心房颤动患者LA-EAT结构和(或)功能对首发缺血性脑卒中(first episode of ischemic stroke,FEIS)的预测价值,现报道如下。
1 对象和方法
1.1 对象 收集2014年1月至2017年12月在宁波市奉化区人民医院心内科住院的非瓣膜病心房颤动患者150例,根据头颅CT或MRI结果,心房颤动并发FEIS患者100例(FEIS组),其中男46例,女54例,年龄 42~88(66.4±16.7)岁;所有患者符合《中国急性缺血性脑卒中患者诊治指南2014》诊断标准[9]。FEIS 纳入标准为:(1)急性起病;(2)局灶神经功能缺损;(3)发病入院,经头颅CT或MRI证实有缺血性病灶;(4)既往无脑梗死病史,影像学排除陈旧性梗死。另采用随机单盲法选择心房颤动未并发FEIS患者50例(非FEIS组),其中男24例,女26 例;年龄 39~79(56.6±14.2)岁;排除标准:心脏瓣膜疾病,非首次发生IS,头颅CT或MRI提示陈旧性梗死灶,甲状腺功能亢进。
1.2 方法
1.2.1 临床资料收集 对所有患者进行CHA2DS2-VASc评分,包括慢性心力衰竭病史或左心室射血分数(LVEF)≤40%(C=1分)、高血压病(H=1分)、年龄(A≥75岁=2分)、糖尿病(D=1分)、FEIS(S=2分)、血管性疾病(包括心肌梗死、主动脉瓣粥样斑块、主动脉导管未闭(V=1分)、年龄65~74岁(a=1分),女性(s=1分)[10];记录心房颤动相关指标包括心房颤动类型(阵发性心房颤动指持续时间<7d,一般<48h,多为自限性;持续性心房颤动指持续时间>7d,一般不能自行复律)、心房颤动病程;记录其他相关疾病(包括原发性心肌病、肺源性心脏病、除主动脉导管未闭外的先天性心脏病)、BMI及药物 [抗血小板聚集药物、抗凝药物、肾素-血管紧张素-醛固酮(RASS)受体阻滞剂、β受体阻滞剂、他汀类药物] 。
1.2.2 经胸心脏彩色多普勒超声检查 采用彩色多普勒超声仪(荷兰飞利浦公司,Philips Elite),记录左心房内径(LAD)、左心室舒张末期内径(LVEDd)、LVEF。
1.2.3 LA-EAT相关功能血浆指标检测 所有患者血浆指标于入院后24h内进行,经酶联免疫吸附试验(ELISA)测定的LA-EAT相关功能指标包括:超敏C 反应蛋白(hs-CRP)、肿瘤坏死因子 α(TNF-α)、白介素 6(IL-6)、半乳糖凝集素 -3、白介素 8(IL-8)、血管性血友病因子(vWF)。其他血浆指标包括:甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、白细胞计数(WBC)、D-二聚体、纤维素蛋白原、肌酐。
1.2.4 LA-EAT结构及左心耳形态测定 所有患者接受64排螺旋增强CT检查(日本东芝公司),扫描方法:采用高压注射器在肘前注射非离子对比剂碘帕醇(370mgI/ml)50ml,从左心房顶部及肺静脉开始扫描,扫描参数:电压120kV,电流50mA,层厚0.6mm。使用专用工作站重建影像,人工逐层勾勒心外膜边界,手动剔除二尖瓣环前的左心室周EAT、右肺上静脉旁右心房周及冠状窦平面及以下的EAT,剩余即为LA-EAT,设定-200~-50HU的CT值为脂肪组织,见插页图1。将LA-EAT人为分成6个区域:肺静脉(肺静脉前庭及外周1cm)+左心耳区域(左心耳底部外周1cm)、后壁(上肺静脉最前缘与下肺静脉最后缘间连线区域)、前壁(右界:上肺静脉前缘右至二尖瓣前壁,左界:至左心耳底部前缘及二尖瓣前壁,上界上肺静脉最前缘)、底部(下肺静脉下缘至二尖瓣环后壁),靠近间隔和侧壁的剩余组织对应间隔及侧壁区域,同时记录左心耳形态特(仙人掌型、鸡翅型、风袋型、菜花型)[11],分析LA-EAT最大厚度值及区域分布、总体积值及最大体积值及区域分布。
1.3 统计学处理 采用SPSS23.0统计软件,符合正态分布的计量资料以表示,多个样本比较采用方差分析,多个样本间两两比较采用LSD-t检验,两组比较采用非配对t检验;计数资料以百分率表示,两组比较采用χ2检验。对于非正态分布的资料,采用非参数检验。采用多因素logistic回归分析心房颤动并发FEIS的独立危险因素,变量进入标准为0.1,排除标准为 0.15,计算比值比(OR)值,采用线性回归分析LA-EAT结构与相关血浆指标的关系。P<0.05为差异有统计学意义。
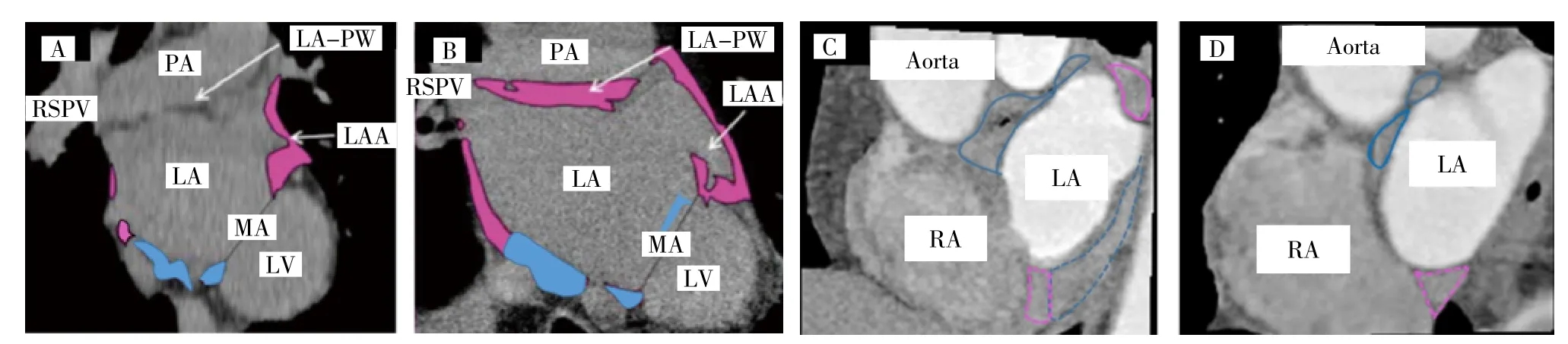
图1 LA-EAT二维CT重建分布示意图 [A、B图为矢状轴横断面,C、D图为冠状轴横断面。A:1例阵发性心房颤动未并发FEIS患者,左心房(LA)前壁区域EAT标记实心蓝色,右侧实心粉色区域为间隔LA-EAT,左侧实心粉色区域为肺静脉(PA)+左心耳(LAA)区域;B:1例阵发性心房颤动并发FEIS患者,粉色实心箭头指示区域为后壁(LAPW)上部,可见B图LA-EAT分布多于A图。C:1例持续性心房颤动并发FEIS患者;D:1例持续性心房颤动未并发FEIS患者,蓝色实线区域为前壁,蓝色虚线区域为后壁,粉色虚线区域为间隔,粉色实线区域为肺静脉区域,可见C图LA-EAT分布多于D图。RSPV:右上肺静脉,MA:二尖瓣环,LV:左心室,Aorta:主动脉,RA:左心房]
2 结果
2.1 两组一般临床资料及超声指标比较 见表1。
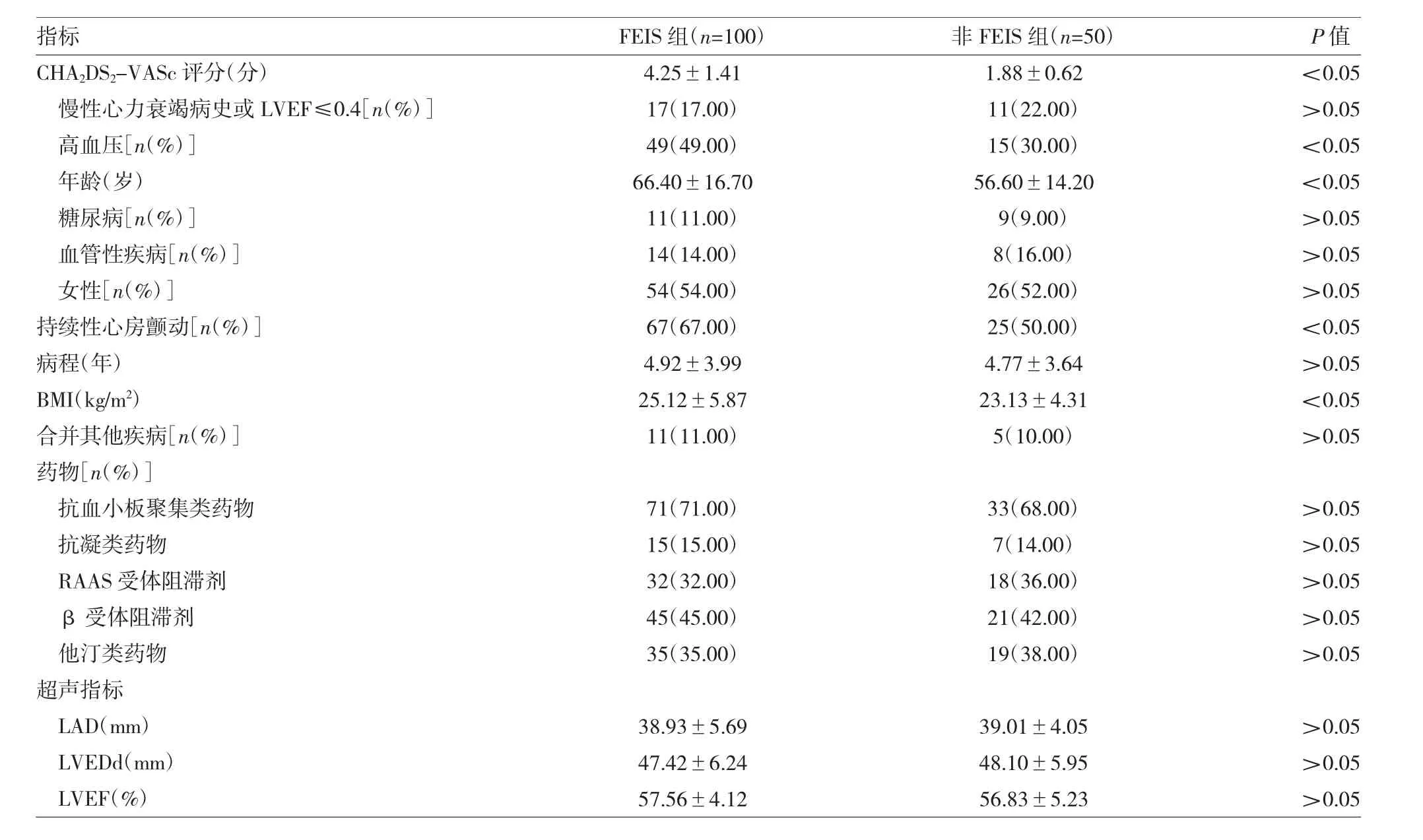
表1 两组一般临床资料及超声指标比较
由表1可见,FEIS组患者CHA2DS2-VASc评分、高血压、年龄、持续性心房颤动、BMI均高于非FEIS组(均P<0.05),余指标差异均无统计学意义(均P>0.05)。
2.2 两组LA-EAT结构指标及左心耳形态比较 见表 2、图 2。
由表2、图2可见,FEIS组患者LA-EAT最大厚度、肺静脉+左心耳区域LA-EAT厚度、后壁LA-EAT体积及总体积均高于非FEIS组(均P<0.05或0.01)。FEIS组及非FEIS组患者肺静脉+左心耳区域及前壁LA-EAT厚度均明显高于其他区域(均P<0.05),且两区域间LA-EAT厚度差异均无统计学意义(均P>0.05)(图 2A、2B),FEIS组患者肺静脉+左心耳区域及前壁LA-EAT厚度均明显高于非FEIS组对应区域(均P<0.05),两组其余区域LA-EAT厚度差异均无统计学意义(均P>0.05);FEIS组患者后壁LA-EAT体积明显高于其他区域(P<0.01),非FEIS组各区域间差异无统计学意义(P>0.05)(图 2C、2D),FEIS组后壁 LA-EAT体积明显高于非FEIS组(P<0.01),两组其余区域LA-EAT体积差异均无统计学意义(P>0.05)。FEIS组鸡翅型左心耳比例低于非FEIS组(P<0.05),菜花型左心耳比例高于非FEIS组(P<0.05),两组间仙人掌型及风袋型左心耳比例差异均无统计学意义(均P>0.05)。
2.3 两组LA-EAT相关血浆指标比较 见表3。
由表3可见,两组患者hs-CRP、IL-6、半乳糖凝集素-3、vWF、D-二聚体差异均有统计学意义(均P<0.05),余指标差异均无统计学意义(均P>0.05)。
2.4 LA-EAT最大厚度及总体积与血浆指标的关系 线性回归分析显示,LA-EAT最大厚度及总体积均与 hs-CRP(r=0.57、0.62,均P<0.01)及 D- 二聚体(r=0.72、0.57,均P<0.05)呈正相关,LA-EAT厚度与半乳糖凝集素呈正相关(r=0.61,P<0.05),LA-EAT总面积与半乳糖凝集素无相关性(P>0.05),LA-EAT 最大厚度及总体积与 IL-6、vWF 均无相关性(均P>0.05)。
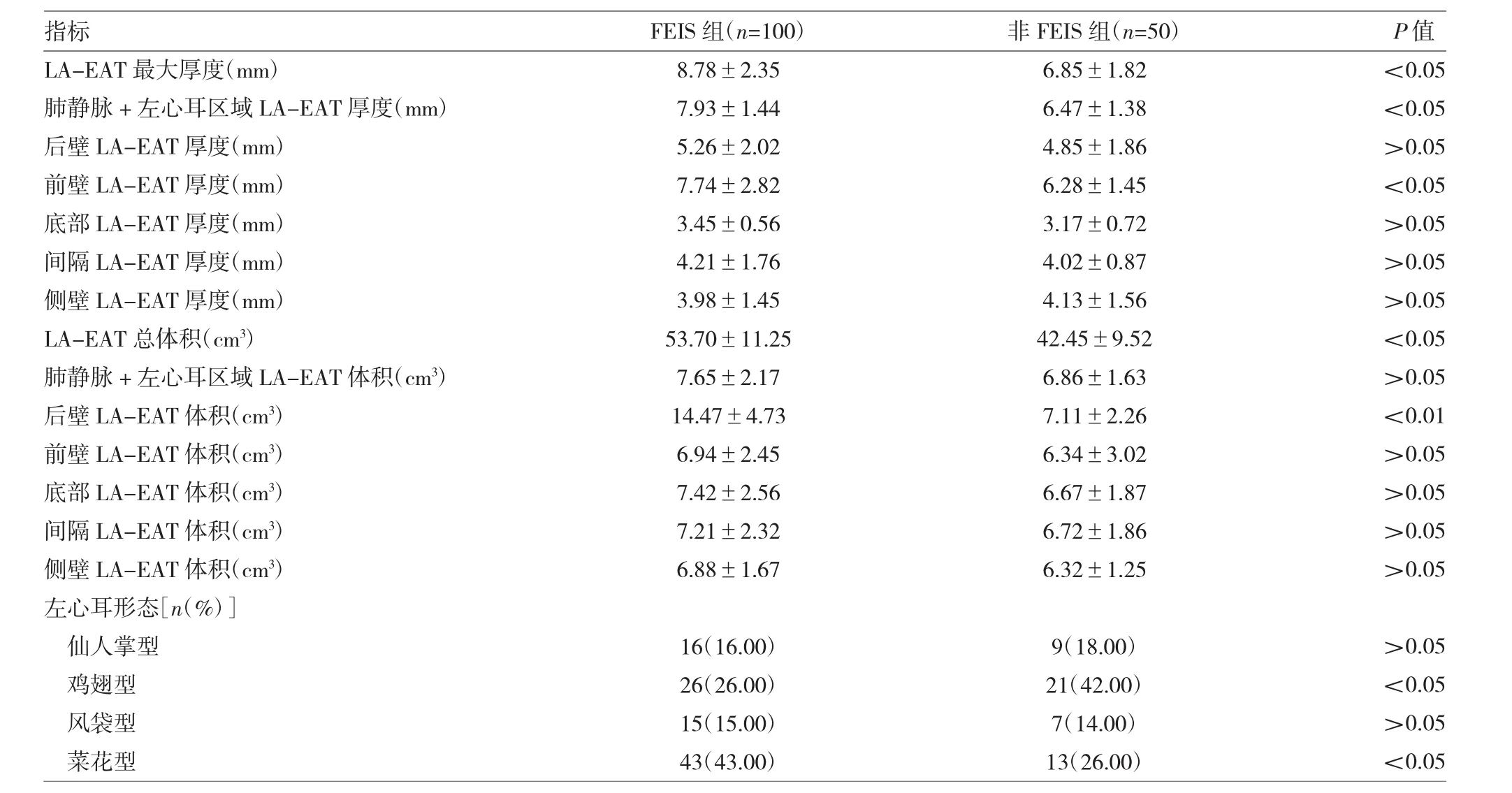
表2 两组LA-EAT结构指标及左心耳形态比较
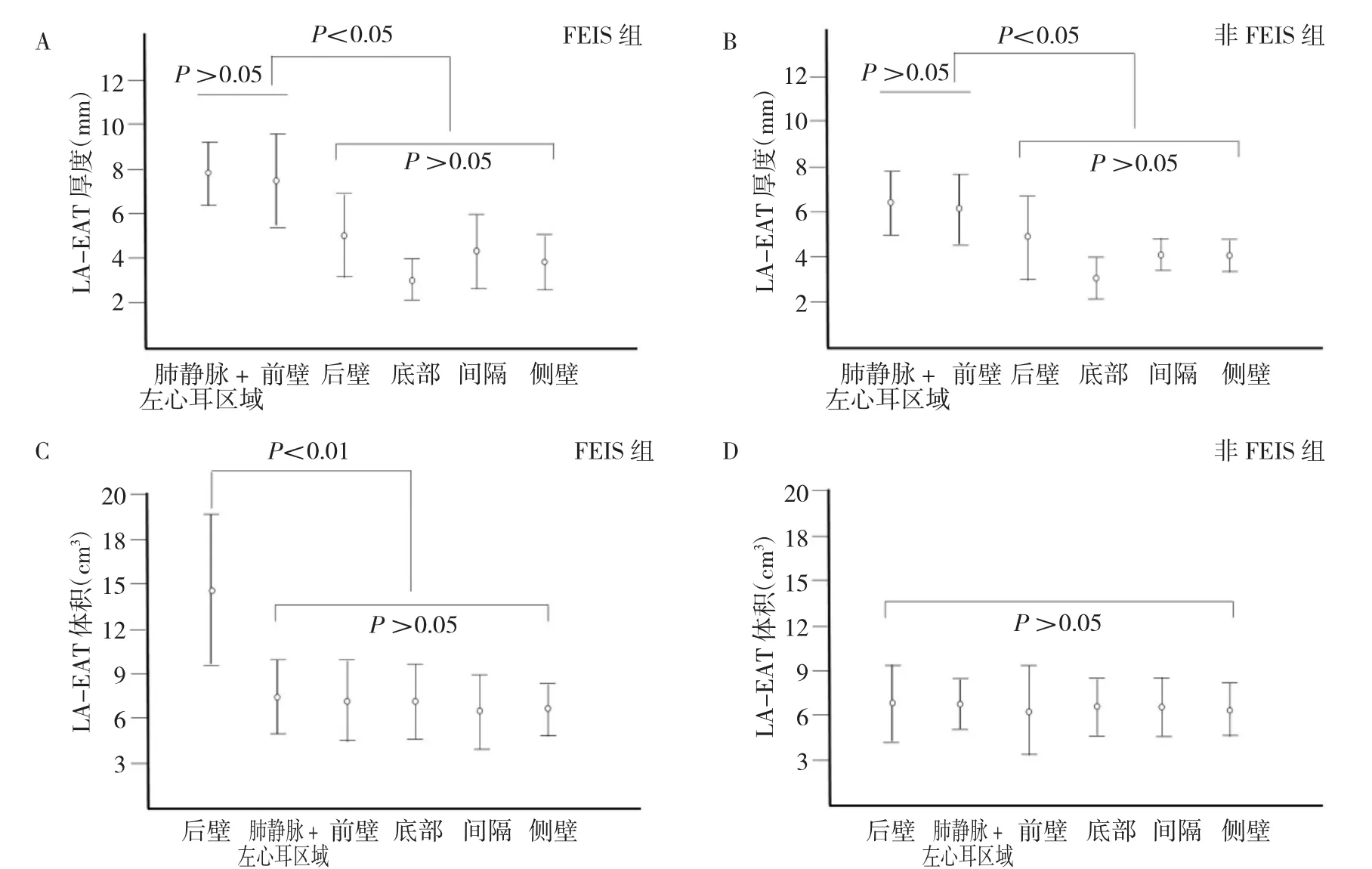
图2 两组各区域LA-EAT厚度及体积比较(A:FEIS组各区域LA-EAT厚度比较;B:非FEIS组各区域LA-EAT厚度比较;C:FEIS组各区域LA-EAT体积比较;D:非FEIS组各区域LA-EAT体积比较)
2.5 心房颤动并发FEIS的危险因素分析 单因素纳入高血压、年龄、持续性心房颤动、BMI、LA-EAT最大厚度及总体积、鸡翅型及菜花型左心耳、hs-CRP、IL-6、半乳糖凝集素 -3、vWF、D- 二聚体进行二分类logistic逐步回归分析,LA-EAT最大厚度及总体积预测心房颤动患者并发FEIS价值最大,其次为D-二聚体,见表4。
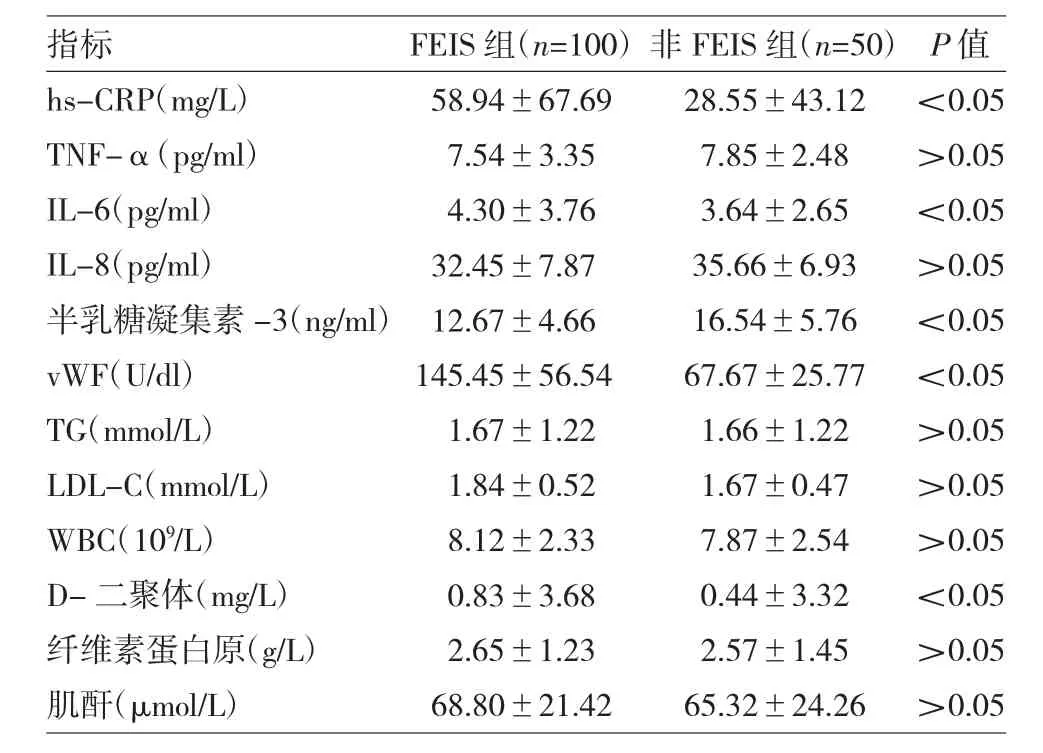
表3 两组LA-EAT相关血浆指标比较
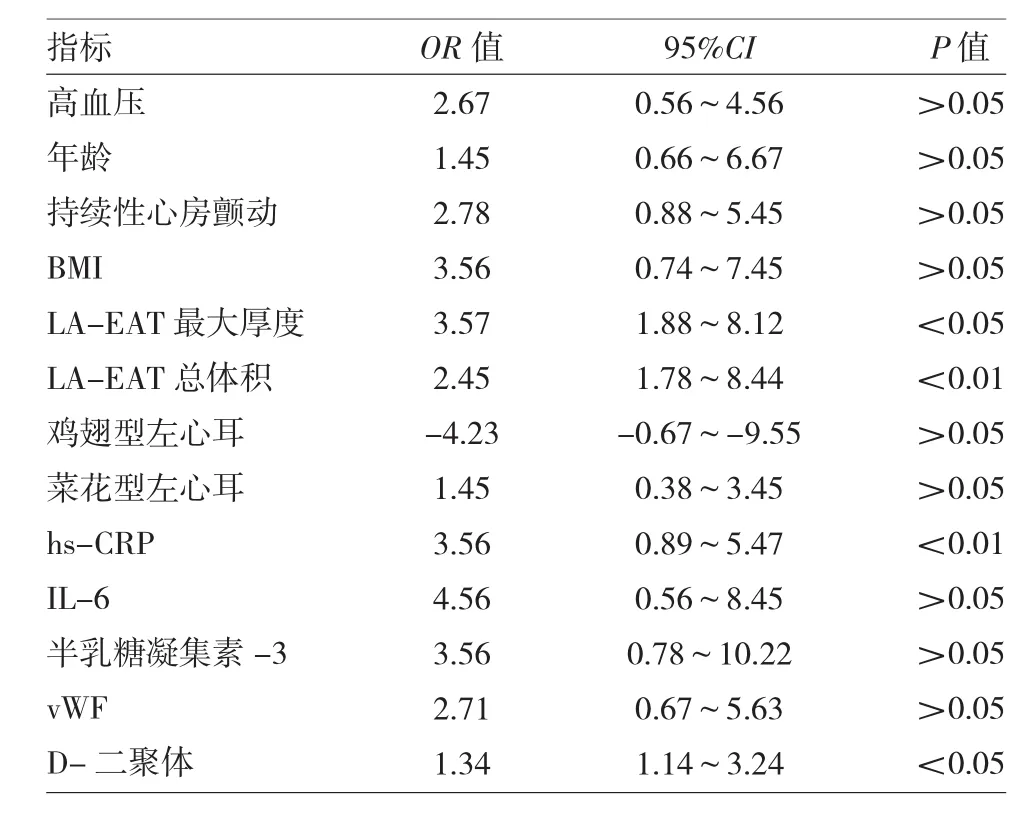
表4 多因素logistic回归分析心房颤动患者并发FEIS的危险因素
3 讨论
EAT是位于心包膜脏层与心肌间的内脏脂肪组织,其引起IS的机制主要可能涉及三方面:首先,LA-EAT可能直接作用于左心房心肌组织引起FEIS。LA-EAT可经分泌及旁分泌产生多种生物因子或迷走神经节直接作用于左心房心肌组织,引起左心房电解剖重构[5-6],这有别于体脂指标BMI。Greif等[1]发现EAT体积除与心房颤动有关外,与左心房重构也密切相关,另外Shin等[2]发现左心房容积与总EAT体积、LA-EAT厚度也密切相关。Batal等[12]经校正年龄、BMI、左心房面积后,发现食管与左心房间(相当于本文后壁区域)EAT厚度可预测心房颤动负荷,邻近多数心房颤动起源点肺静脉环,这与本研究FEIS组患者中持续性心房颤动较多,且以肺静脉+左心耳区域LA-EAT厚度及后壁LA-EAT体积最大的结论相符。Mazurek等[13]借助正电子发射计算机断层显像(PETCT)发现EAT葡萄糖代谢水平明显高于对照组,间接证实心房颤动患者EAT有更高的炎症活性。本研究进一步发现,FEIS患者LA-EAT最大厚度及总体积、hs-CRP、IL-6、半乳糖凝集素-3明显高于非FEIS患者,LA-EAT厚度及体积大小决定部分生物活性因子分泌量,包括炎性指标hs-CRP及纤维化指标半乳糖凝集素-3,结合两组持续性心房颤动患者比例存在显著差异,间接提示左心房纤维化加重、心房颤动迁延进展增加FEIS 风险[143-16]。
其次,LA-EAT可能直接作用于脑血管组织引起FEIS。LA-EAT最大厚度(OR=3.57)及总体积(OR=2.45)作为预测心房颤动患者并发FEIS价值最大的指标,LA-EAT产生的多种炎症因子可能直接参与心房颤动患者血管内皮功能损伤、血小板激活及纤维蛋白素原增加,从而导致FEIS[5]。Tousoulis等[17]证实在左心房扩大及左心耳功能减退心房颤动患者中,IL-6及CRP明显增加,CRP水平与心房颤动持续时间呈正相关,且增加左心耳自发显影、左心耳血栓形成,两者增加水平与IS风险升高均有关。Aulin等[18]对纳入RE-LY研究中心房颤动患者分析IL-6、CRP及纤维素蛋白原发现,IL-6除与IS及主要出血事件有关,可独立预测血管性死亡和复合血栓栓塞事件。Antonino等[19]报道心源性IS患者TNF-α、IL-6及IL-1β明显高于平均血浆水平,而腔隙性IS患者则低于该水平。Whiteley等[20]通过监测炎性标志物IL-6、CRP、纤维蛋白原及白细胞计数,发现血清IL-6高水平与IS再发及进展相关。另有基础研究证实,IS后阻断或抑制内源性保护机制-诱导抗凋亡丝裂原蛋白激酶信号通路可增强炎症和凋亡反应,同时伴有TNF-α、IL-6的升高,可见上述炎症因子对IS的发生、发展甚至预后均极其重要[21]。本研究中高血压比例及vWF较高可间接反映血管内皮损伤,D-二聚体可反映高凝状态,在FEIS患者vWF较高、LA-EAT最大厚度及总体积与D-二聚体呈正相关情况下,D-二聚体仍为心房颤动患者并发FEIS的独立危险因素(OR=1.34),提示诸多因素可引起心房颤动并发FEIS患者D-二聚体升高,不仅仅限于本研究中涉及的炎症指标。
最后,EAT可作为始动因素导致多种心房颤动IS的传统高危因素形成。在合并心力衰竭、高血压、糖尿病等疾病的心房颤动患者中,EAT体积和(或)厚度可明显升高,而心力衰竭、高血压等均为IS的高危因素[22-24]。本研究发现,虽然FEIS组患者年龄较高,同时高血压比例亦高于未并发FEIS患者,但两者并非心房颤动患者并发FEIS的独立危险因素,提示高血压可能为LA-EAT结构或功能异常的伴随表现。另外,本研究入选患者只包括FEIS,排除既往发生IS患者,这种选择偏倚可能直接导致本文结果与前述研究结论不一。本研究尚存在以下不足:样本量较小且仅选择FEIS患者,存在一定的偏倚,进一步大样本前瞻性研究很有必要。在检测手段上,64排除螺旋CT因分辨率有限可能影响LA-EAT结构测定的准确性;最后,如能进行外科干预LA-EAT,再次评估LA-EAT结构及功能指标与术后预后关系,可使本研究结果更具说服力。