泡菜中高耐镉乳酸菌的选育及吸附特性
2019-08-08陈宇凌陈银元刘安倩李文李同祥王陶
陈宇凌,陈银元,刘安倩,李文,李同祥,王陶
(江苏省食品资源开发与质量安全重点建设实验室(徐州工程学院),江苏 徐州,221018)
近年来,重金属污染引起的食品安全问题已成为人们广泛关注的热点[1-2]。在所有重金属污染问题中,镉因其生物毒性大、移动性强成为最受关注的对象之一[3]。镉是一种蓄积性十分强的重金属元素,即便处于很低的浓度,一旦蓄积起来,会对人体和其他生物造成危害[4]。镉虽然在通常情况下含量低,但还可以通过食物链来富集而达到高浓度。食品中镉的存在形态主要与蛋白质、脂类和多糖等形成螯合配体[5-7]。由于环境污染、农药残留和食品加工问题等,常常会引起食品中镉的污染。因此,对食物中镉的去除和吸附研究就至关重要。
传统处理重金属的方法有很多,如膜分离法、电解法、沉淀法等,但这些方法也呈现出成本高、技术要求高、释放副产物、对环境造成二次污染等问题[8-9]。近年来,生物吸附法引起了人们的高度重视,生物吸附法具有高效、廉价的优点。生物吸附是指利用生物材料去除重金属,利用吸附剂与金属离子发生物理或化学反应,而生物材料划分为微生物材料、植物材料和动物材料[10-11]。其中,微生物具有繁殖快、代谢旺、易培养、成本低的优势,因此,其在重金属吸附中具有独特地位[12-13]。乳酸菌作为食品安全级别的益生菌,能够通过离子交换、物理吸附、胞内扩散等方式吸附镉[14],是很好的镉污染防治菌株。可将其作为镉的吸附剂添加到镉污染的食品中去,移除食品中的镉[15-18];或者作为膳食补充剂摄入到体内,使其在肠道内吸附镉,再通过粪便将镉排出体外[19-20],防止镉在体内积累。KINOSHITA等[21]从牛肠、猪肠、日式泡菜、日本甘酒、韩国泡菜和酸奶中分离出了包括乳酸杆菌、链球菌、肠球菌等103株乳酸菌,并对其进行了吸附研究,发现大部分乳酸菌都具有良好镉吸附能力。目前,虽有筛选得到能耐受一定镉浓度的乳酸菌株,但这些菌株仍存在耐镉和/或吸附镉的能力不强,遗传稳定性不高,菌体生长及吸附条件窄等诸多不足,高耐镉乳酸菌种资源的挖掘工作还有待于进一步进行。
因此,本研究拟从四川自制泡菜汁中筛选出乳酸菌,通过含不同浓度的镉培养基驯化乳酸菌,从而得到耐镉最高的菌株,对此菌株进行初步鉴定,并进一步研究其吸附镉及其他重金属的性能,为乳酸菌株治理食品中重金属镉及其他重金属污染奠定一定基础。
1 材料与方法
1.1 材料与试剂
四川万源自酿泡菜汁;CdCl2·2H2O、MnSO4、CuSO4·5H2O、吐温-80(分析纯),国药集团化学试剂有限公司;PbSO4(分析纯),阿拉丁生化科技股份有限公司;其他试剂均为分析纯。
1.2 仪器与设备
HH.B11.600-S-Ⅱ型电热恒温培养箱,上海跃进医疗器械厂;TU-1810紫外可见分光光度计,北京普析通用仪器有限责任公司;酸度计,上海市羲精密仪器有限公司;生物显微镜,南京江南永新光学有限公司;A3AFG-13原子吸收分光光度计,北京普析通用仪器有限责任公司。
1.3 培养基
1.3.1 MRS培养基
(1)MRS液体培养基配制方法(g/L):葡萄糖20.0、牛肉浸膏 15.0、酵母浸膏5.0、蛋白胨10.0、无水乙酸钠5.0、柠檬酸氢二铵2.0、KH2PO42.62、MnSO4·4H2O 0.198、MgSO4·7H2O 0.58、吐温-80 1.0 mL,无菌水1 000 mL,pH 6.0~6.5,121 ℃蒸汽灭菌20 min。
(2)MRS固体培养基:在MRS液体培养基中加入20 g/L的琼脂粉。
1.3.2 高镉培养基
在MRS固体/液体培养基中按所需浓度加入相应CdCl2·2H2O。
1.4 耐镉乳酸菌株的富集、筛选及耐镉能力
1.4.1 乳酸菌株的初筛
将四川自酿食用泡菜汁原液,稀释成10-2,10-3,10-4,10-5,10-6,将10-4,10-5,10-6泡菜稀释液取100 μL至已凝固好的含Cd2+质量浓度为50 mg/L 的MRS固体培养基上,用灭过菌的涂布棒将稀释液反复涂布至均匀,37 ℃培养箱中倒置培养2 d。
1.4.2 乳酸菌株的复筛
将初筛出的菌株进行革兰氏染色、接触酶试验,复筛出接触酶试验阴性,革兰氏阳性菌株,作为下一步耐镉驯化的菌株。
1.4.3 高耐镉乳酸菌株的富集、筛选与遗传稳定性
将复筛出的菌株分别转移接种到Cd2+质量浓度更高的250、400、500、1 300、2 000、4 000、6 000、10 000、11 000 mg/L 的固体培养基和100、300、500、600、800、900、1 000 mg/L的液体培养基中,观察其生长状况,每个质量浓度设置3个平行,对筛选出的高耐隔菌株分别在最高耐受浓度的固体和液体培养基上连续传代10代,观察其生长和耐隔情况。
1.5 耐镉乳酸菌的鉴定
1.5.1 菌落形态观察及生理生化鉴定
将活化后的高耐镉菌株接种到MRS固体培养基上,37 ℃的培养箱中倒置培养2 d后,观察其菌落大小、颜色、组织状态及边缘特征,生理生化的鉴定参考标准方法进行[22]。
1.5.2 菌株的分子生物学鉴定
1.5.2.1 菌株 16S rDNA的PCR扩增和序列测定
按细菌基因组提取试剂盒说明,提取出目标菌株的基因组DNA。
根据细菌16S rDNA序列保守性设计通用引物[23]:
上游引物:5′-AGAGTTTGATCCTGGCTCAG-3′
下游引物:5′-GGTTACCTTGTTACGACTT-3′
反应体系 40 μL:DNA模板6 μL;上游引物 1 μL; 下游引物 1 μL;ddH2O 12 μL;2×Taq PCR Master Mix 20 μL;
PCR循环条件:96 ℃预变性4 min;96 ℃变性30 s; 55 ℃退火40 s;72 ℃延伸1 min;30个循环;72 ℃ 延伸10 min,4 ℃终止反应。
1.5.2.2 序列比对与进化树构建
用经琼脂糖凝胶电泳检测PCR扩增产物后,送到生工(上海)生物工程股份有限公司测序,在序列库提交所测得的序列,用BLAST对比细菌的16S rDNA基因序列;将菌ZY-6测序后所得序列与GenBank中相关菌株的16S rRNA基因序列,用Clustal X进行比对,在MEGA3.1 中采用Neighbor-Joining(邻位发生法) 法构建系统发育树,分析鉴定此菌株与模式菌株的同源性[24]。
1.6 耐镉乳酸菌的镉吸附特性
菌株ZY-6接种于MRS培养基活化18 h后,于8 000 r/min离心20 min,收集菌体,超纯水洗涤2次后,将湿菌体悬浮于镉离子质量浓度分别为50、100、200、300、500、700、900 mg/L的水溶液中,使菌体终质量浓度为5 g/L,于 37 ℃吸附2 h,8 000 r/min离心20 min,采用原子吸收分光光度计火焰法分别测定吸附前后上清液中的Cd2+浓度,代入公式(1)计算吸附率(A)。
(1)
式中:ρ0、ρ1分别为上清中Cd2+的初始和吸附后的质量浓度,mg/L。
1.7 耐镉乳酸菌对其他重金属的吸附性能
将活化洗涤后的ZY-6湿菌体分别悬浮于100 mg/L 的含Pb2+、Cu2+、Mn2+的水溶液中,使湿菌体终质量浓度为5 g/L,于 37 ℃吸附2 h,8 000 r/min离心20 min,采用原子吸收分光光度计火焰法分别测定吸附前后上清液中的重金属浓度,计算吸附率。
2 结果与分析
2.1 乳酸菌的筛选
将梯度稀释后的四川自制泡菜汁涂布于Cd2+质量浓度为50 mg/L的MRS固体培养基上,倒置培养2~3 d后,结果见图1,由图1可知,有大量乳酸菌类似菌落长出,选取128株长势较好的单菌落进行划线分离和驯化,直至得到纯的单菌落。对这128个菌株进行革兰氏染色和接触酶试验,筛选出革兰氏染色阳性、接触酶试验阴性的疑似乳酸菌7株。
图1 初筛菌株单菌落Fig.1 Single colony of stains by primary screening
2.2 高耐镉乳酸菌的富集、筛选及遗传稳定性
2.2.1 固体耐镉结果及遗传稳定性
挑取7株疑似乳酸菌单菌落在MRS培养基上进行划线分离,并不断提升培养基中的镉浓度,对菌株进行驯化,结果见表1。由表1可以看出,随着Cd2+浓度的不断提升,7株菌的生长受到不同程度的抑制,Cd2+质量浓度为400 mg/L时,菌株ZY-4停止生长;500 mg/L时,菌株ZY-2、ZY-5、ZY-7停止生长;1 300 mg/L时, 菌株ZY-1停止生长;4 000 mg/L时,菌株ZY-3停止生长;11 000 mg/L时,菌株ZY-6停止生长。图2显示当离子质量浓度从250 mg/L上升到10 000 mg/L过程中,菌株ZY-6在平板上的菌落数在逐渐变少。将菌株ZY-6连续传代培养10次后,其仍可在含10 000 mg/L的镉培养基上生长,具有一定的遗传稳定性。
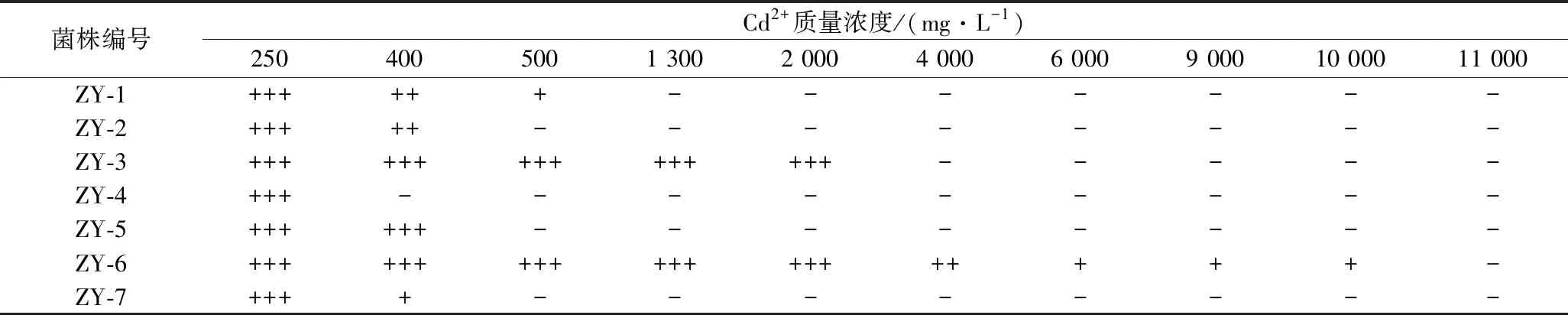
表1 七株菌株在固体高镉培养基上的生长情况Table 1 The Growth of seven cadmium tolerant strains in solid medium containing high concentrations of Cd2+
注:“+++”表示生长旺盛;“++”表示生长情况一般;“+”表示菌株微生长;“-”表示菌株不生长。
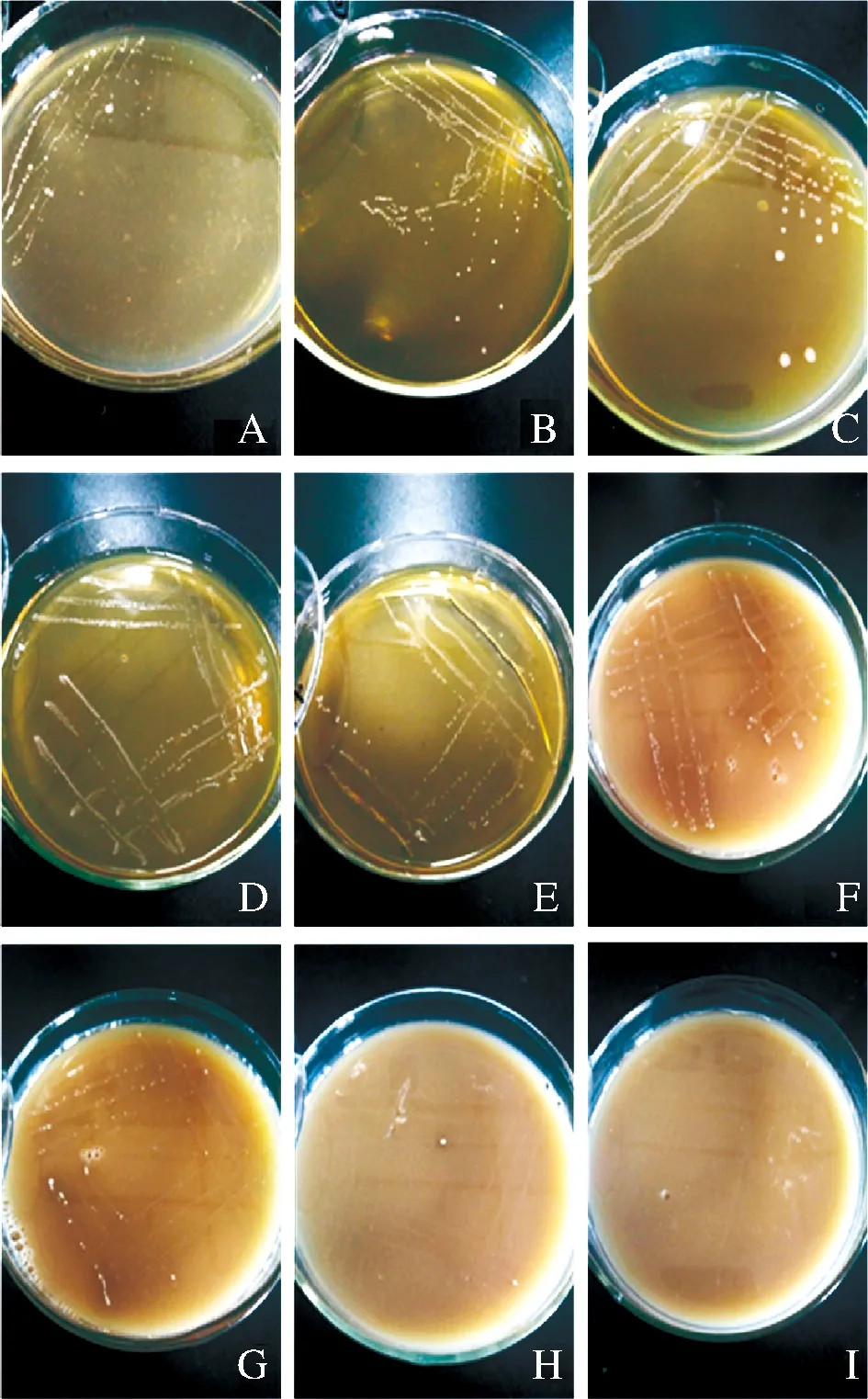
A~I-Cd2+质量浓度分别为250、400、500、1 300、2 000、4 000、6 000、9 000、10 000 mg/L图2 ZY-6在不同Cd2+质量浓度平板中的生长情况Fig.2 The Growth of ZY-6 in solid medium containing different concentrations of Cd2+
综上,菌株ZY-6固体耐镉性能最好,在固体培养基中可以耐受10 000 mg/L的镉,高于目前报道的菌株在高镉平板上的耐隔性能。
2.2.2 液体耐镉结果及遗传稳定性
将7株菌接种于高镉液体培养基中进行培养,并不断提升镉浓度,测定OD600以判断菌株的生长情况,结果见表2。可以看出,随着镉浓度的不断提升,菌的生长受到了不同程度的抑制,镉离子质量浓度为500 mg/L时,菌株ZY-1、ZY-2、ZY-4、ZY-5、ZY-7停止生长;900 mg/L时,菌株ZY-3停止生长;1 000 mg/L时,菌株ZY-6停止生长。相比较其他菌株,菌株ZY-6的液体耐镉性能最好,可以耐受900 mg/L的镉。传代培养10次后,其仍可在含900 mg/L的镉液体培养基上生长,具有良好的遗传稳定性。结合固体耐受实验结果,最终选择菌株ZY-6进行后续实验。
2.3 耐镉乳酸菌ZY-6的鉴定
2.3.1 菌落形态
菌株ZY-6的菌落形态如图3。由图3可知,菌株ZY-6在MRS固体培养基上呈现不透明的小菌落,乳白色,表面光滑,呈微隆起圆状轮廓,直径1~2 mm, 较湿润,易挑取。
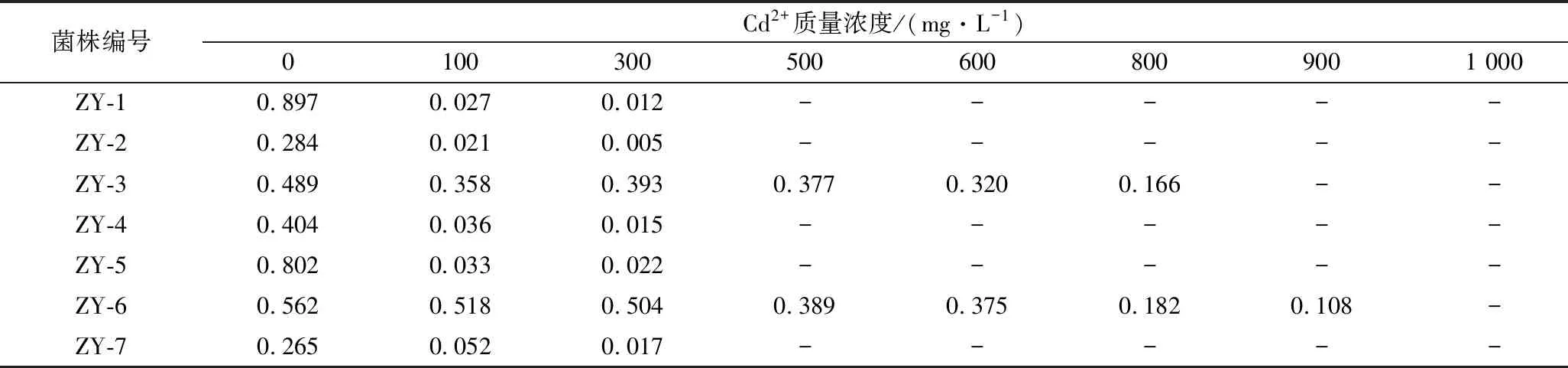
表2 七株菌株在高镉液体培养基中的生长情况Table 2 The Growth of seven cadmium tolerant strains in liquid medium containing high concentrations of Cd2+
注:表内结果为OD600值;“-”表示不生长。

图3 ZY-6菌落形态图Fig.3 Colonies of ZY-6
2.3.2 显微形态
将菌株ZY-6 37 ℃培养2 d,形成明显菌落后,取单菌落进行革兰氏染色,结果如图4所示。菌株ZY-6染色后呈现紫色,为革兰氏阳性菌,菌体呈现不规则的短杆状,两端钝圆,无鞭毛,无芽孢。
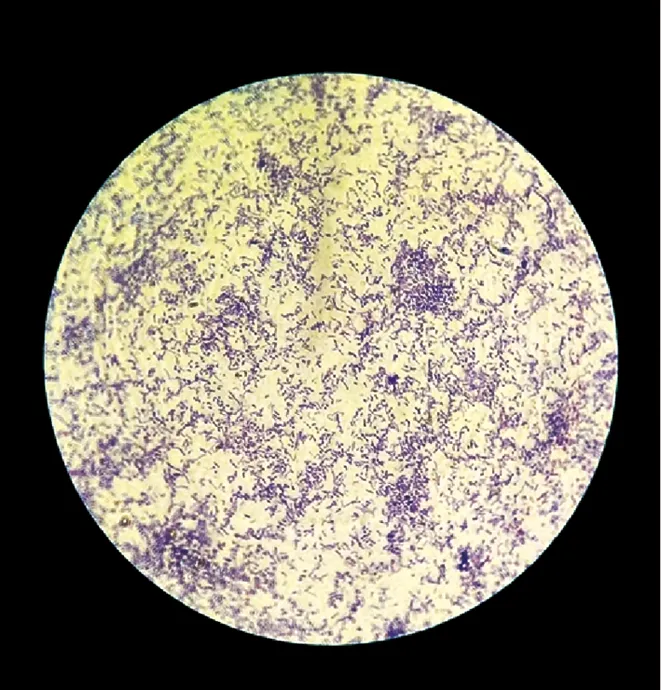
图4 ZY-6显微形态图(×1 000)Fig.4 Morphology of single cell obeserved by microscope
2.3.3 生化试验结果
甲基红实验结果呈阳性;H2O2、乙醇氧化乙酸、淀粉水解、葡萄糖发酵、乳糖发酵、蔗糖发酵、V-P实验、吲哚实验、硫化氢实验、硝酸盐还原实验、明胶液化、菌体运动实验结果均呈阴性。
2.3.4 生理试验结果
2.3.4.1 初始pH对菌株生长的影响
菌株接种于不同初始pH的MRS培养基中,培养后测定OD600,结果如图5。ZY-6生长较适的pH范围较宽(pH=5~8),最适pH值为7。当pH<3或>11时,菌株ZY-6生长受到抑制。
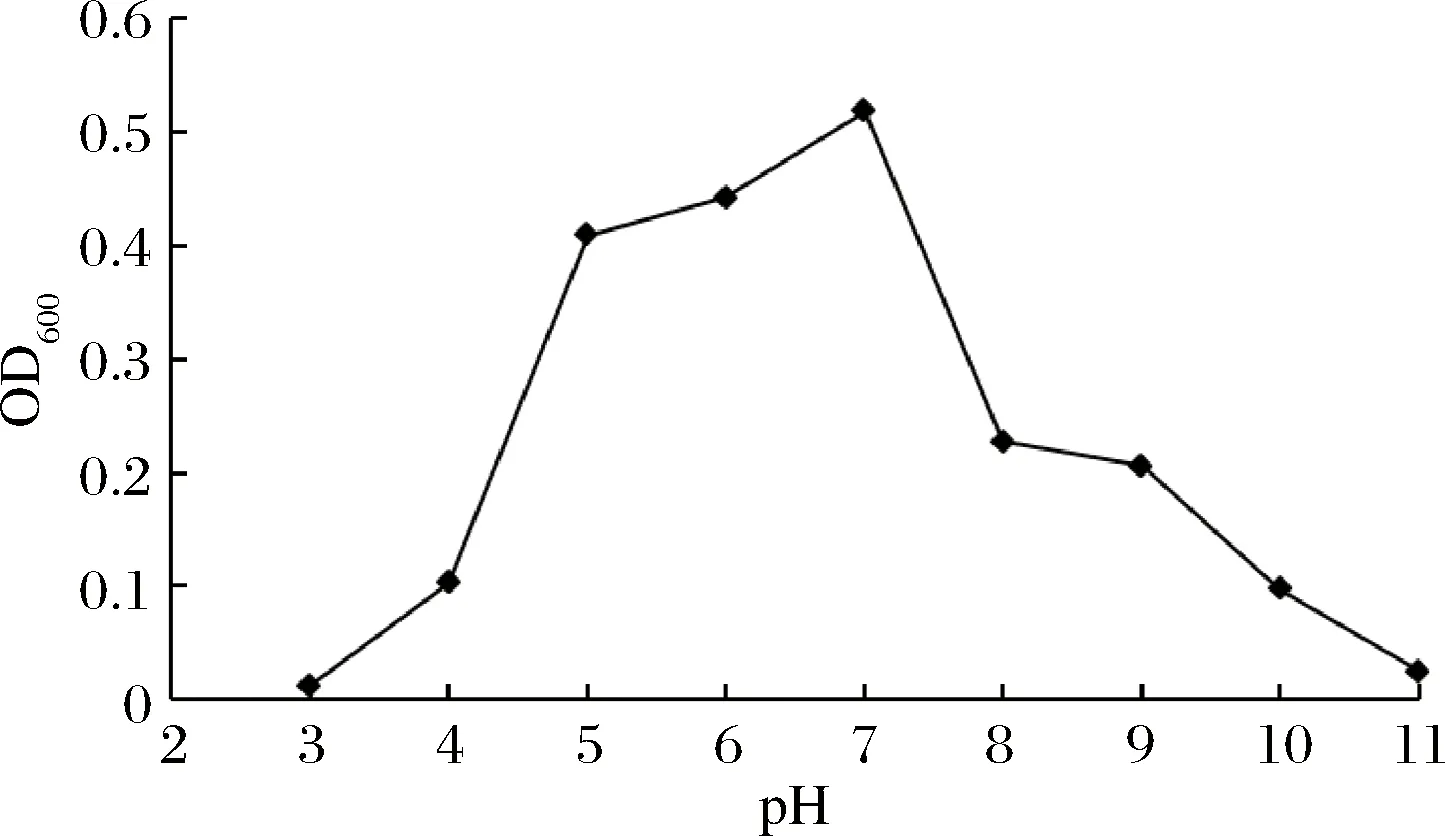
图5 初始pH对菌株ZY-6生长情况的影响Fig.5 The effect of pH on growth of ZY-6
2.3.4.2 耐盐性实验
将菌株接种于不同NaCl质量浓度的培养基中,培养后测定OD600,结果如图6所示。菌株在NaCl质量浓度为0~30 g/L时,生长得较好,最佳生长NaCl质量浓度为10 g/L时,最大耐受NaCl质量浓度为50 g/L, 具有一定的耐盐性。

图6 NaCl质量浓度对菌ZY-6生长情况的影响Fig.6 The effect of concentration of NaCl on growth of ZY-6
2.3.4.3 温度对菌株生长的影响
将菌株接种于培养基中,置于不同温度下培养后测定OD600,结果见图7。可以看出菌株ZY-6在20~42 ℃ 生长较好,最适生长温度为37 ℃。
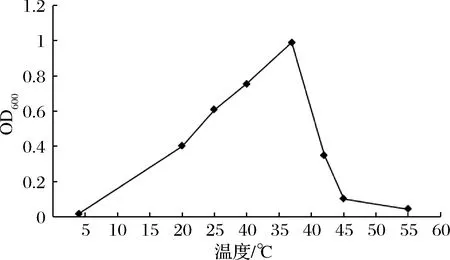
图7 生长温度对菌株ZY-6生长情况的影响Fig.7 The effect of temperature on growth of ZY-6
2.3.5 分子生物学鉴定结果
2.3.5.1 16S rDNA的电泳图
以ZY-6基因组DNA为模板,PCR扩增其16S rDNA, 以1%的琼脂糖电泳,并将产物与Marker对比,结果见图8。由图8可见,菌株ZY-6在1 500 bp左右处出现清晰条带,表明菌株ZY-6的16S rDNA序列大小约为1 500 bp。
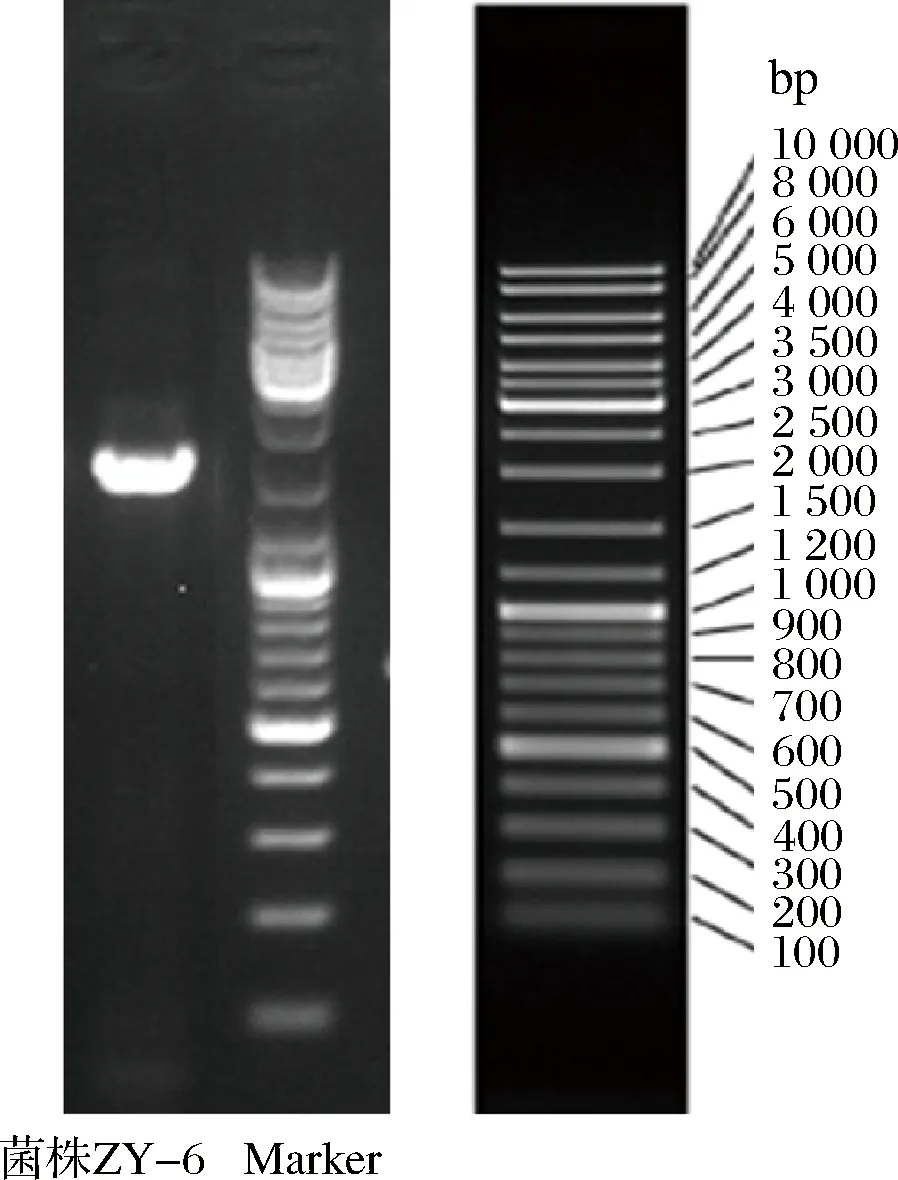
图8 16S rDNA电泳结果图Fig.8 The electrophoresis analysis of 16S rDNA
2.3.5.2 进化树结果
将菌株ZY-6的PCR产物电泳条带切割回收,并对其进行测序,序列长度为1 523 bp,序列提交至Gene Bank,获得其登录号为MK417560,将此序列与Gene Bank中已发表的 16S rDNA序列进行同源性比对,构建以菌株ZY-6和其相关模式菌株16S rRNA基因序列的系统发育树,如图9所示。菌株ZY-6和WeissellaviridescensNRIC 1536 AB023236 100.0处于一个分支,同源性为100%,因此,结合形态鉴定、生理生化试验,确定此菌株为绿色魏斯菌(Weissellaviridescens)。
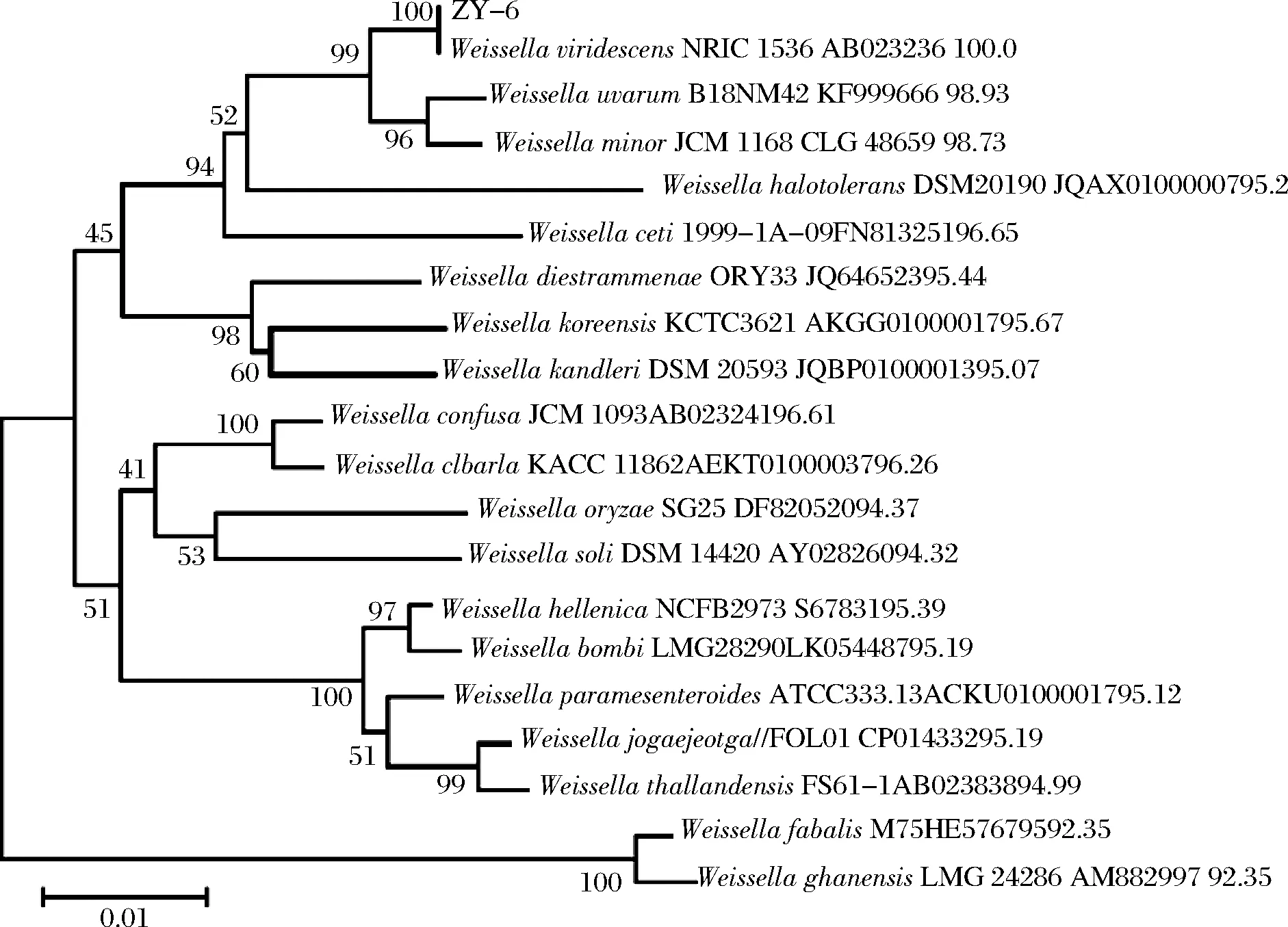
图9 系统发育树Fig.9 Phylogenetic dendrogram
2.4 菌株ZY-6对镉的吸附作用
检测绿色魏斯菌ZY-6对不同Cd2+质量浓度的吸附作用,结果见图10。可以看出,菌体对于50~900 mg/L的Cd2+都呈现出了一定的吸附作用,随Cd2+浓度的增大,吸附率逐渐降低,表明菌体对镉的吸附能力有限,浓度过高会对菌体造成不良影响,从而影响菌体对镉的吸附能力,菌体对50 mg/L的Cd2+吸附效果最好,吸附率达61.78%。
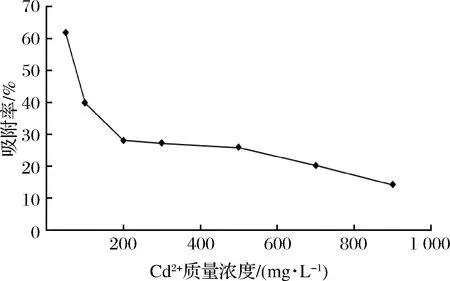
图10 ZY-6在不同质量浓度镉溶液中的吸附率Fig.10 The adsorption rate of ZY-6 in solution containing different concentrations of Cd2+
2.5 菌株ZY-6对其他重金属的吸附作用
检测菌株ZY-6对另外3种重金属铅、铜、锰的吸附作用,结果见图11,可以看出,菌株ZY-6对这3种重金属都显示出了一定的吸附效果,对铅和铜的吸附率较高,分别为83.65%和71.31%,对锰的吸附率较低,为18.16%。菌体对于不同的金属显示出不同的吸附能力可能和该菌株对不同重金属的抗性机制不同有关[25]。

图11 菌株ZY-6对Pb2+、Cu2+、Mn2+的吸附作用Fig.11 Adsorption of Pb2+, Cu2+, Mn2+by ZY-6
3 结论
本研究从四川自制泡菜汁中筛选出高耐镉乳酸菌株ZY-6,其在液体和固体MRS培养基中耐镉质量浓度分别为900 mg/L和10 000 mg/L,其固体耐镉性能高于目前报道的菌株,具备较好的应用潜力;其湿菌体对50 mg/L Cd2+的吸附率为61.34%,对100 mg/L Cd2+的吸附率为39.84%,高于邵鑫等筛选的高耐镉乳酸菌株LAB-5的吸附率31.40%[14]。同时该菌株对多种重金属如铅、铜、锰显示出一定的吸附能力,对铅的吸附率高达83.65%。在筛选高吸附性能的菌株时将筛选标准定为当吸附率高于18%则认为该菌株具有高吸附性能[26],因此,菌株ZY-6被认为是高吸附菌株,可为复合污染的生物修复提供良好的菌株材料。
经形态学、生理生化及分子生物学鉴定,该菌株属于绿色魏斯菌(Weissellaviridescens),目前鲜见绿色维斯菌作为镉吸附剂的报道,从生长特性上看来,该菌株能在较宽的温度范围及pH范围内生长,有较好的耐盐性,有利于其实际利用。该菌株的获得在一定程度上丰富了耐镉菌株资源,下一步可优化其镉吸附条件及研究其吸附镉的机理。
